「アルツハイマー病の超早期細胞死の解明と新たな治療標的を発見」【岡澤均 教授】
― アミロイド仮説を修正する病態発症の新仮説を提唱 ―
ポイント
| ● | アミロイド仮説※1を修正する新たなアルツハイマー病態仮説を提唱しました。 |
| ● | 細胞外アミロイド蓄積以前の早期段階から細胞死が起きていることを明らかにしました。 |
| ● | 本研究の成果から、早期段階の細胞死を標的とする遺伝子治療等の治療開発が期待されます。 |
東京医科歯科大学難治疾患研究所/脳統合機能研究センター神経病理学分野の岡澤均教授の研究グループは、東京都健康長寿医療センター、名古屋大学、自治医科大学、慶応義塾大学、国立精神神経医療研究センター、国立シンガポール大学、バロー神経学研究所などのグループとの共同研究で、アミロイドベータ細胞外凝集の出現前の超早期段階に生じる細胞死が、その後のアルツハイマー病態進展の鍵を握ること、また、この細胞死を標的とする治療法(発症後にも適応可能)の開発が可能であることを実験的に示しました。この研究は文部科学省科学研究費補助金(新学術領域・シナプス・ニューロサーキットパソロジーの創成)、日本学術振興会科学研究費補助金(基盤A)ならびに平成26年度~平成30年度・文部科学省『革新的技術による脳機能ネットワークの全容解明プロジェクト』(平成27年度から日本医療研究開発機構:AMEDへ移管)などの支援のもとでおこなわれたもので、その研究成果は、国際科学誌Nature Communicationsに、2020年1月24日午前10時(英国時間)にオンライン版で発表されます。
研究の背景
アルツハイマー病を初めとする神経変性疾患は、細胞の内外に異常タンパク質が蓄積することが病理学的な特徴です。アルツハイマー病では、細胞外にアミロイドベータ※2(以後、アミロイドと略称)と呼ばれる異常ペプチドが沈着する老人斑と、細胞内にタウタンパク質が凝集する神経原線維変化の2つが起こることが知られています。これまで数々の治療法が試みられてきましたが、十分な有効性を示すものは得られていません。特に、約15年前からアミロイドに対する抗体医薬品の臨床試験※3が国際的な規模で行われてきましたが、脳内のアミロイド除去に成功したものの、患者の症状は改善が見られないことも予想外の知見として得られました。このため、発症後から治療を開始するのでは既に遅く、発症前にアミロイド抗体療法を開始する、あるいは、脳内の細胞外アミロイド凝集が起きる以前の超早期(Phase 0)に生じる脳内分子変化を解明して、新たな分子標的に対する治療を開発する必要があると考えられるようになってきました。
本研究グループは先行研究において、脳内細胞外アミロイド凝集前にリン酸化の異常変動を示すタンパク質MARCKSを同定し(Tagawa et al, Hum Mol Genet 2015)、リン酸化MARCKS(pSer46MARCKS)が細胞外アミロイドの周囲にある変性神経突起に存在することを報告しました(Fujita et al, Sci Rep 2016)。また、pSer46MARCKSの上流シグナルがHMGB1であることを示し、MARCKSのリン酸化を誘導する細胞外分子HMGB1を標的とする抗体治療法がアルツハイマー病の発症を予防することを報告してきました(Fujita et al, Sci Rep 2016)。
本研究グループは先行研究において、脳内細胞外アミロイド凝集前にリン酸化の異常変動を示すタンパク質MARCKSを同定し(Tagawa et al, Hum Mol Genet 2015)、リン酸化MARCKS(pSer46MARCKS)が細胞外アミロイドの周囲にある変性神経突起に存在することを報告しました(Fujita et al, Sci Rep 2016)。また、pSer46MARCKSの上流シグナルがHMGB1であることを示し、MARCKSのリン酸化を誘導する細胞外分子HMGB1を標的とする抗体治療法がアルツハイマー病の発症を予防することを報告してきました(Fujita et al, Sci Rep 2016)。
研究成果の概要
HMGB1はネクローシス※4というタイプの細胞死を起こした時に放出されることが知られています(Scaffidi et al, Nature 2002)。そこで、患者さんの髄液中のHMGB1を測定したところ、アルツハイマー病として診断される時期の髄液よりも、軽度認知障害(MCI)の時期の患者さんの髄液の方が、HMGB1がより高値であることを見出しました。このことは発症前にすでに細胞死が活発に起きていることを示唆しています。そこで、アルツハイマー病の2種類のモデルマウスを用いて、本研究で開発したpSer46MARCKS抗体で進行中の神経細胞ネクローシスを検出する技術によって、現在進行形のネクローシスを定量したところ、認知機能障害を起こすより前に、なおかつ、細胞外アミロイド蓄積が見られる前から、ネクローシスが盛んに起きていることが明らかになりました。そして、現在進行形ネクローシスは、発症前にピークがあるものの、発症後にも続いているということも示されました(図1)。
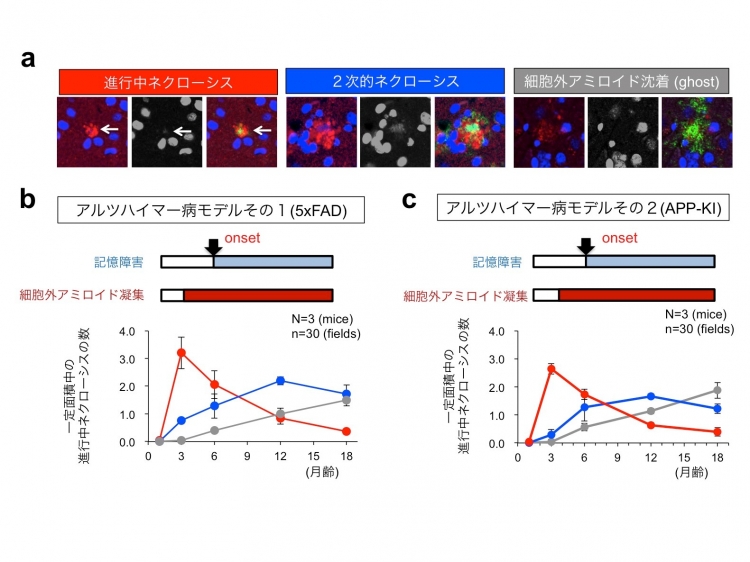
また、ゲノム編集技術を用いてアルツハイマー病遺伝子変異を導入したヒトiPS細胞をから分化作成したヒト・アルツハイマー病ニューロンの詳細な観察から、このようなネクローシスは細胞内アミロイドがYAP※5と呼ばれるタンパク質を巻き込んで、YAPの細胞生存維持作用が奪われるために生じる新しいタイプのネクローシス(TRIAD)※4であることが分かりました。
さらに、本研究ではネクローシスを引き起こすYAP機能障害を正常化する目的で、遺伝子治療※6によるYAP補充をアルツハイマー病モデルマウスに対して行いました。その結果、TRIADネクローシスの抑制、認知機能改善、そして、細胞外アミロイド蓄積の抑制が観察されました。
さらに、本研究ではネクローシスを引き起こすYAP機能障害を正常化する目的で、遺伝子治療※6によるYAP補充をアルツハイマー病モデルマウスに対して行いました。その結果、TRIADネクローシスの抑制、認知機能改善、そして、細胞外アミロイド蓄積の抑制が観察されました。
研究成果の意義
本研究を通じて、細胞外アミロイド凝集を最上流の原因と考えるアミロイド仮説を訂正する必要性が強く示唆されました。 代わりに、1)細胞内アミロイド蓄積に始まるネクローシスの結果として細胞外アミロイド凝集がおきること、2)(a)細胞内アミロイド蓄積に起因するネクローシス過程および(b)ネクローシスを起こした細胞の周辺神経細胞が起こす二次的細胞死過程が神経機能障害を引き起こしていること、3)細胞内アミロイド蓄積がトリガーするネクローシスはYAP機能低下に起因するTRIADであること、4)YAP機能回復を基盤とする遺伝子治療等の治療開発が今後可能であること、を示しました(図2)。また、5)髄液HMGB1量がアルツハイマー病の発症前分子マーカーとして開発しうる可能性を示しました。

用語解説
※1 アミロイド仮説
アロア・アルツハイマー博士が1904年に初めて報告したアルツハイマー病は銀染色での病理所見に基づいており、この時は物質沈着の有無も、それがアミロイドかどうかも分からなかった。その後、1980年代半ばに沈着物質が40アミノ酸ほどのアミロイドペプチドであることが解明され、さらにその元となる遺伝子がクローニングされた。これを受けて、1991年にJohn Hardy博士とDavid Allsop博士が、細胞外アミロイド沈着がアルツハイマー病の原因であるという仮説を提唱した(Hardy & Allsop, Trends Pharmacol Sci 12, 383–388, 1991)。
※2 アミロイドベータ
アルツハイマー病の病理像を特徴付ける分子であり、病理学的にアミロイドベータが脳内特に細胞外に沈着していること(老人斑)をもって、アルツハイマー病と診断している。細胞の膜タンパクであるアミロイド前駆体タンパク質が2つの酵素(ベータセクレターゼ、ガンマセクレターゼ)によって切断を受けて産生される40から42、3のアミノ酸からなるペプチドである。構造上、互いに会合しやすく凝集体を形成する。かつては、老人斑のような巨大な凝集体に毒性があると考えられていたが、オリゴマーと呼ばれる凝集前の状態にも毒性があることが分かっている。
※3 アミロイド抗体を用いた臨床試験
2019年10月22日に、アミロイド抗体医薬品(Aducanumab)が臨床試験フェーズ3において有効性が認められ、FDAへ2020年に申請予定であることが(https://www.eisai.co.jp/news/2019/news201979.html)、Biogen社・エーザイ株式会社の2社から発表されました。一方、これを除く、他の製薬企業が開発した多数のアミロイド抗体医薬品は全て、大規模国際臨床試験フェーズ3において確認できませんでした。
※4 ネクローシス、TRIAD (Transcriptional Repression-Induced Atypical neuronal Death)
細胞死には様々な形がある。このうち、代表的なものはアポトーシスとネクローシスである。アポトーシスはプログラム細胞死とも呼ばれ、細胞の内外の原因によって能動的に特定シグナル経路が活性化されることで生じる。これに対して、ネクローシスは強力な外的障害要因(熱、放射線、出血、化学物質など)で受動的に起こる細胞死と、かつては考えられてきた。形態学的には、アポトーシスは核クロマチン濃縮、核膜乖離など核の変化が優位である。細胞は全体に縮小していく。これに対して、ネクローシスは核よりも細胞質の変化が目立ち、ミトコンドリアなどの細胞内小器官の膨張、破裂などがみられ、細胞は膨張する。近年、ネクローシスにも特定のシグナル経路活性化により誘導されるものが知られるようになってきた。RIP1/3によるシグナル活性化で起きるネクローシスはネクロプトーシスと呼ばれる。これに対してTRIADは、RIP1/3の活性化はなく、YAPと呼ばれる生存因子の機能低下が原因であり、Hippoパスウェイ活性化とも関連する(Hoshino et al, JCB 2006; Mao et al, Hum Mol Genet 2016; Mao et al, Cell Death Dis 2016)。
※5 YAP (yes-associated protein)
YAPは、p73あるいはTEADと呼ばれる転写因子に結合する転写補助因子である。近年、ガン、発生など様々な現象に、Hippo pathwayと呼ばれるシグナル経路が重要な役割を果たすことが明らかになってきたが、YAPはHippo pathwayの最下流にあり、最終的な効果を具現化する分子である。岡澤グループは神経型アイソフォームであるYAPdeltaCを2006年に発見した(Hoshino et al., 2006)。3つのアイソフォーム (ins13, ins25, ins61)が存在し、YAP同様WWドメイン(タンパク質との結合部位で、特徴としてPPXYモチーフをもつ)はもつが、C末端のp73へのtransactivation domainが欠損している。多くの転写因子は単独ではなく、複数の転写因子などによる複合体形成が必要である。YAPは、これら転写因子の機能を補助する転写共役因子である。YAPと同様にYAPdeltaCは、TRIADに対して、ドミナントネガティブ様に細胞死を抑制する。YAPdeltaCは遺伝子の長さが短く、ウィルスベクターに組み込みやすいため、本研究で使用している。
※6 遺伝子治療
主にウイルスベクターを、疾患で顕著に影響を受ける臓器、あるいは全身的に投与して、目的の遺伝子を発現させる、あるいは目的の遺伝子の発現を抑える治療法のこと。アデノ随伴ウィルス(AAV)は今日最も遺伝子治療に用いられているベクターである。無毒化したウィルスゲノムに発現させたい標的遺伝子を組み込んで目的のタンパク質を高効率で発現させることができる。
アロア・アルツハイマー博士が1904年に初めて報告したアルツハイマー病は銀染色での病理所見に基づいており、この時は物質沈着の有無も、それがアミロイドかどうかも分からなかった。その後、1980年代半ばに沈着物質が40アミノ酸ほどのアミロイドペプチドであることが解明され、さらにその元となる遺伝子がクローニングされた。これを受けて、1991年にJohn Hardy博士とDavid Allsop博士が、細胞外アミロイド沈着がアルツハイマー病の原因であるという仮説を提唱した(Hardy & Allsop, Trends Pharmacol Sci 12, 383–388, 1991)。
※2 アミロイドベータ
アルツハイマー病の病理像を特徴付ける分子であり、病理学的にアミロイドベータが脳内特に細胞外に沈着していること(老人斑)をもって、アルツハイマー病と診断している。細胞の膜タンパクであるアミロイド前駆体タンパク質が2つの酵素(ベータセクレターゼ、ガンマセクレターゼ)によって切断を受けて産生される40から42、3のアミノ酸からなるペプチドである。構造上、互いに会合しやすく凝集体を形成する。かつては、老人斑のような巨大な凝集体に毒性があると考えられていたが、オリゴマーと呼ばれる凝集前の状態にも毒性があることが分かっている。
※3 アミロイド抗体を用いた臨床試験
2019年10月22日に、アミロイド抗体医薬品(Aducanumab)が臨床試験フェーズ3において有効性が認められ、FDAへ2020年に申請予定であることが(https://www.eisai.co.jp/news/2019/news201979.html)、Biogen社・エーザイ株式会社の2社から発表されました。一方、これを除く、他の製薬企業が開発した多数のアミロイド抗体医薬品は全て、大規模国際臨床試験フェーズ3において確認できませんでした。
※4 ネクローシス、TRIAD (Transcriptional Repression-Induced Atypical neuronal Death)
細胞死には様々な形がある。このうち、代表的なものはアポトーシスとネクローシスである。アポトーシスはプログラム細胞死とも呼ばれ、細胞の内外の原因によって能動的に特定シグナル経路が活性化されることで生じる。これに対して、ネクローシスは強力な外的障害要因(熱、放射線、出血、化学物質など)で受動的に起こる細胞死と、かつては考えられてきた。形態学的には、アポトーシスは核クロマチン濃縮、核膜乖離など核の変化が優位である。細胞は全体に縮小していく。これに対して、ネクローシスは核よりも細胞質の変化が目立ち、ミトコンドリアなどの細胞内小器官の膨張、破裂などがみられ、細胞は膨張する。近年、ネクローシスにも特定のシグナル経路活性化により誘導されるものが知られるようになってきた。RIP1/3によるシグナル活性化で起きるネクローシスはネクロプトーシスと呼ばれる。これに対してTRIADは、RIP1/3の活性化はなく、YAPと呼ばれる生存因子の機能低下が原因であり、Hippoパスウェイ活性化とも関連する(Hoshino et al, JCB 2006; Mao et al, Hum Mol Genet 2016; Mao et al, Cell Death Dis 2016)。
※5 YAP (yes-associated protein)
YAPは、p73あるいはTEADと呼ばれる転写因子に結合する転写補助因子である。近年、ガン、発生など様々な現象に、Hippo pathwayと呼ばれるシグナル経路が重要な役割を果たすことが明らかになってきたが、YAPはHippo pathwayの最下流にあり、最終的な効果を具現化する分子である。岡澤グループは神経型アイソフォームであるYAPdeltaCを2006年に発見した(Hoshino et al., 2006)。3つのアイソフォーム (ins13, ins25, ins61)が存在し、YAP同様WWドメイン(タンパク質との結合部位で、特徴としてPPXYモチーフをもつ)はもつが、C末端のp73へのtransactivation domainが欠損している。多くの転写因子は単独ではなく、複数の転写因子などによる複合体形成が必要である。YAPは、これら転写因子の機能を補助する転写共役因子である。YAPと同様にYAPdeltaCは、TRIADに対して、ドミナントネガティブ様に細胞死を抑制する。YAPdeltaCは遺伝子の長さが短く、ウィルスベクターに組み込みやすいため、本研究で使用している。
※6 遺伝子治療
主にウイルスベクターを、疾患で顕著に影響を受ける臓器、あるいは全身的に投与して、目的の遺伝子を発現させる、あるいは目的の遺伝子の発現を抑える治療法のこと。アデノ随伴ウィルス(AAV)は今日最も遺伝子治療に用いられているベクターである。無毒化したウィルスゲノムに発現させたい標的遺伝子を組み込んで目的のタンパク質を高効率で発現させることができる。
論文情報
掲載誌:Nature Communications
論文タイトル: YAP-dependent necrosis occurs in early stages of Alzheimer's disease and regulates mouse model pathology
DOI:https://doi.org/10.1038/s41467-020-14353-6
論文タイトル: YAP-dependent necrosis occurs in early stages of Alzheimer's disease and regulates mouse model pathology
DOI:https://doi.org/10.1038/s41467-020-14353-6
研究者プロフィール

岡澤 均(オカザワ ヒトシ) Hitoshi Okazawa
東京医科歯科大学難治疾患研究所/脳統合機能研究センター
神経病理学分野 教授、脳統合機能研究センター長
・研究領域
神経内科学、神経科学、神経病理学、分子生物学
東京医科歯科大学難治疾患研究所/脳統合機能研究センター
神経病理学分野 教授、脳統合機能研究センター長
・研究領域
神経内科学、神経科学、神経病理学、分子生物学

田中 ひかり(タナカ ヒカリ) Hikari Tanaka
東京医科歯科大学難治疾患研究所/脳統合機能研究センター
神経病理学分野 大学院生
・研究領域
神経科学、神経病理学
東京医科歯科大学難治疾患研究所/脳統合機能研究センター
神経病理学分野 大学院生
・研究領域
神経科学、神経病理学
問い合わせ先
<研究に関すること>
東京医科歯科大学難治疾患研究所/脳統合機能研究センター
神経病理学分野 氏名 岡澤 均(オカザワ ヒトシ)
TEL:03-5803-5847 FAX:03-5803-5847
E-mail: okazawa.npat@mri.tmd.ac.jp
<報道に関すること>
東京医科歯科大学 総務部総務秘書課広報係
〒113-8510 東京都文京区湯島1-5-45
TEL:03-5803-5833 FAX:03-5803-0272
E-mail:kouhou.adm@tmd.ac.jp
東京医科歯科大学難治疾患研究所/脳統合機能研究センター
神経病理学分野 氏名 岡澤 均(オカザワ ヒトシ)
TEL:03-5803-5847 FAX:03-5803-5847
E-mail: okazawa.npat@mri.tmd.ac.jp
<報道に関すること>
東京医科歯科大学 総務部総務秘書課広報係
〒113-8510 東京都文京区湯島1-5-45
TEL:03-5803-5833 FAX:03-5803-0272
E-mail:kouhou.adm@tmd.ac.jp

