「3D臓器形成遺伝子の同定に成功」【仁科博史 教授】

仁科 博史 教授 難治疾患研究所 発生再生生物学分野(右)
古谷—清木 誠 研究室長 英国バース大学再生医学研究所、本学非常勤講師(中)
浅岡 洋一 助教 難治疾患研究所 発生再生生物学分野(左)
― 扁平メダカの解析から判明した脊椎動物の新しい臓器形成機構 ―
ポイント
| ● | 細胞内で遺伝情報の読み取りを調節する分子YAPが、意外にも細胞の張力制御に必須の役割を果たすことを明らかにしました。 |
| ● | 本発見は日本で独自に開発されたモデル生物メダカの扁平な変異体により得られました。 |
| ● | 100年間謎であった重力下でつぶれない3次元臓器形成機構の一端を明らかにする成果です。 |
英国バース大学の古谷—清木 誠博士の研究グループとオーストリアISTのハイゼンベルグ博士、東京医科歯科大学難治疾患研究所発生再生生物学分野の仁科博史教授らは、大阪大学、慶応大学、広島大学、名古屋大学、オックスフォード大学、ウイスコンシン大学のグループとの共同研究で、脊椎動物が重力下で立体的な臓器および体を形成する機構の一端を明らかにしました(図1)。この研究は科学技術振興機構のERATOならびにSORST研究事業の支援の下で行われたもので、その研究成果は、国際科学誌Nature(ネイチャー)に、2015年3月17日午前1時(日本時間)にオンライン版で発表されました。
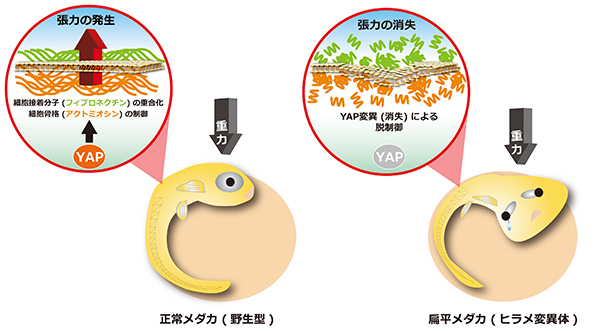
図1 大規模スクリーニングによって単離された扁平メダカ hirame(ヒラメ)変異体
研究の背景
約100年前に英国の物理・数学者D’Arcy Thompsonは、地球上の生物の形は重力に大きな影響を受けていると予言しました。しかし、生物がどのように重力に抵抗して体の形作りをするのかは謎です。また、様々な組織は整然と配置されることで機能する臓器を形成しますが、その形成メカニズムも不明です。例えば、ヒトの眼球はレンズがカップ型をした網膜の中心に配置されることで機能しますが、レンズや網膜組織が独自の3次元構造を取り、正しく配置するメカニズムについては不明です。
これら重要な課題を解決するためには、適切なモデル生物を用いて研究することが重要と考えられます。メダカは日本が世界に誇るモデル生物であり、基礎生物学のみならずヒト疾患研究にも用いられています。胚が透明であること、母体外で発生することから、脊椎動物の臓器形成のモデル生物として注目されています。
これら重要な課題を解決するためには、適切なモデル生物を用いて研究することが重要と考えられます。メダカは日本が世界に誇るモデル生物であり、基礎生物学のみならずヒト疾患研究にも用いられています。胚が透明であること、母体外で発生することから、脊椎動物の臓器形成のモデル生物として注目されています。
研究成果の概要
脊椎動物の臓器の形成を司る遺伝子を網羅的に同定する目的で、臓器形成に異常を示すメダカ変異体の大規模スクリーニングが行われました(ERATO近藤誘導分化プロジェクト:統括責任者 大阪大学 近藤寿人教授、グループリーダー 古谷—清木誠博士, 1998-2007)。東京医科歯科大学の仁科博史を含む国内外の約10の研究グループがこのプロジェクトに参加しました。本研究成果は、2004年に発生学の国際誌Mechanism of DevelopmentにSpecial Issue MEDAKA(メダカ変異体のカタログ集)として報告されました。
興味深いことに、体全体が扁平になるメダカ変異体が単離されました (図1)。そのユニークな形態から hirame(ヒラメ)と命名されました。hirame 変異体では、組織が3次元の形状を失うだけでなく、組織の配置も異常になります。hirame 変異体を解析した結果、遺伝子発現を制御する転写共役因子YAPの変異が原因であることが判明しました。YAPタンパク質が消失すると、細胞張力が低下し、重力に抵抗できなくなり、3次元構造をとる組織が崩壊することが明らかとなりました(イメージ図2)。細胞内で遺伝情報の読み取りを効果的に調節する転写共役因子であるYAPは、細胞骨格アクトミオシンネットワークの重合・脱重合を調節する遺伝子の発現コントロールを通じて細胞張力を制御するという新しい仕組みが存在することがわかりました(図3)。また、組織・臓器を正しく配置できない原因は、細胞張力の低下により、接着の働きをする細胞外基質フィブロネクチンに異常が生じるためであることも明らかとなりました。さらに、本細胞張力制御メカニズムは、ヒトでも保存されていることも明らかとなりました。脊椎動物の臓器形成に共通した基本的なメカニズムであると考えられます。
興味深いことに、体全体が扁平になるメダカ変異体が単離されました (図1)。そのユニークな形態から hirame(ヒラメ)と命名されました。hirame 変異体では、組織が3次元の形状を失うだけでなく、組織の配置も異常になります。hirame 変異体を解析した結果、遺伝子発現を制御する転写共役因子YAPの変異が原因であることが判明しました。YAPタンパク質が消失すると、細胞張力が低下し、重力に抵抗できなくなり、3次元構造をとる組織が崩壊することが明らかとなりました(イメージ図2)。細胞内で遺伝情報の読み取りを効果的に調節する転写共役因子であるYAPは、細胞骨格アクトミオシンネットワークの重合・脱重合を調節する遺伝子の発現コントロールを通じて細胞張力を制御するという新しい仕組みが存在することがわかりました(図3)。また、組織・臓器を正しく配置できない原因は、細胞張力の低下により、接着の働きをする細胞外基質フィブロネクチンに異常が生じるためであることも明らかとなりました。さらに、本細胞張力制御メカニズムは、ヒトでも保存されていることも明らかとなりました。脊椎動物の臓器形成に共通した基本的なメカニズムであると考えられます。
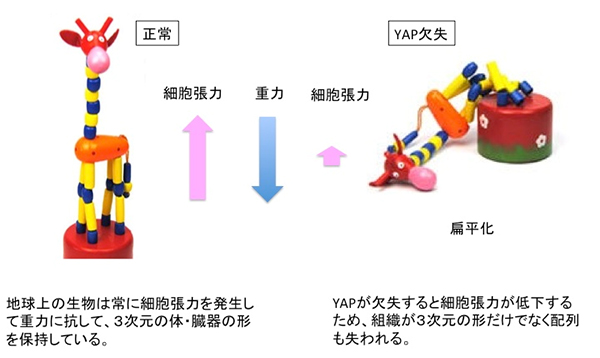
図2 YAP変異(消失)は細胞張力低下による体および臓器の扁平化を引き起こす(イメージ図)
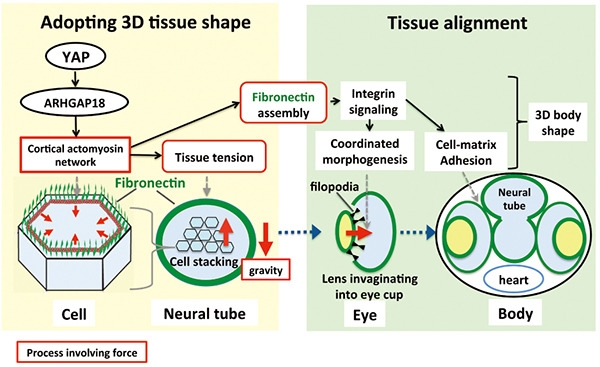
図3 YAPは細胞張力の調節を介して3次元臓器の形成を制御する
研究成果の意義
今回の研究成果から、脊椎動物の臓器が立体的な構造を作る仕組みの一端が明らかとなりました。重要でありながら長年不明であった生物学の重要課題の解明に道が拓けました。また、メダカが3次元臓器形成解明のための優れたモデル生物であることが示されました。現在、日本で発明されたiPS細胞を用いて、目的細胞を分化誘導する研究が盛んになされています。しかしながら、立体的な組織や臓器を作ることは未だ困難な状況です。本研究成果は細胞張力制御の観点からこの問題解決の糸口になることが期待されます。
註)本研究は、科学技術振興機構(JST)、英国Medical Research Council(MRC)によって助成を受けました。
註)本研究は、科学技術振興機構(JST)、英国Medical Research Council(MRC)によって助成を受けました。
問い合わせ先
<研究に関すること>
東京医科歯科大学難治疾患研究所 発生再生生物学分野
氏名 仁科 博史(ニシナ ヒロシ)
TEL:03-5803-4057 FAX:03-5803-4057
E-mail:nishina.dbio(ここに@を入れてください)mri.tmd.ac.jp
英国バース大学
氏名 古谷—清木 誠(フルタニセイキ マコト)
E-mail:mfs22(ここに@を入れてください)bath.ac.uk
京都産業大学総合生命科学部生命システム科
氏名 近藤 寿人(コンドウ ヒサト)
TEL:075-705-1722
E-mail: kondohh(ここに@を入れてください)cc.kyoto-su.ac.jp
<報道に関すること>
東京医科歯科大学 広報部広報課
〒113-8510 東京都文京区湯島1-5-45
TEL:03-5803-5833 FAX:03-5803-0272
E-mail:kouhou.adm(ここに@を入れてください)tmd.ac.jp
東京医科歯科大学難治疾患研究所 発生再生生物学分野
氏名 仁科 博史(ニシナ ヒロシ)
TEL:03-5803-4057 FAX:03-5803-4057
E-mail:nishina.dbio(ここに@を入れてください)mri.tmd.ac.jp
英国バース大学
氏名 古谷—清木 誠(フルタニセイキ マコト)
E-mail:mfs22(ここに@を入れてください)bath.ac.uk
京都産業大学総合生命科学部生命システム科
氏名 近藤 寿人(コンドウ ヒサト)
TEL:075-705-1722
E-mail: kondohh(ここに@を入れてください)cc.kyoto-su.ac.jp
<報道に関すること>
東京医科歯科大学 広報部広報課
〒113-8510 東京都文京区湯島1-5-45
TEL:03-5803-5833 FAX:03-5803-0272
E-mail:kouhou.adm(ここに@を入れてください)tmd.ac.jp

