「核小体の構造形成の仕組みを解明」【岡澤均 教授】

岡澤 均(オカザワ ヒトシ) 難治疾患研究所/脳統合機能研究センター 神経病理学分野 教授(左上)
田中 ひかり(タナカ ヒカリ) 難治疾患研究所 神経病理学分野 講師(右上)
金 キョウシン(キン キョウシン) 難治疾患研究所 神経病理学分野 大学院生(下)
―核小体を形作るための必須分子 “PQBP5” を発見! ―
ポイント
- 核小体はリボソームRNA(rRNA)を産生するなど、細胞が生きるために必須の細胞内部構造です。そして、がん、老化、神経変性疾患などあらゆる生命現象と深く関連しています。
- これまで、核小体がどのようにして形成されるか、また、維持されているかは、十分に解明されていませんでした。
- 岡澤教授らは、同研究グループ1998年に発見したポリグルタミン結合タンパク質5 (polyglutamine binding protein 5、 略称 PQBP5、別名NOL10)という分子が、正常時の核小体形成と細胞ストレス下の核小体構造維持・回復のために、必須であることを発見しました。
- さらに、神経変性疾患の原因の一部は、PQBP5を介する核小体病態である可能性を示しました。
研究の背景
岡澤教授の研究グループは、25年ほど前(1998年)に、複数のポリグルタミン病※1原因タンパク質に共通して含有されるポリグルタミン配列への結合蛋白質をyeast two hybrid法を用いて探索し、PQBP1, 2, 3, 4, 5という5つの新規分子を発見しました(Imafuku et al, BBRC 1998; Waragai et al, Hum Mol Genet 1999; Okazawa et al, Neuron 2002)。このうち、PQBP1※2については、岡澤グループに加えて多数の研究者が参入して、基本的な分子機能と、神経変性疾患、小頭症、発達障害、ウイルス感染症、免疫疾患などにおける病態機能が多数報告されています。また、PQBP1はヒトの知的障害の原因遺伝子であることから(Kalscheuer et al, Nature Genet 2003)、ヒト知能に関わる分子であることも確実になっています。一方、PQBP5を含む、PQBP1以外のPQBPsについては、この25年間にPQBP5などが核小体タンパク質であることが分かったものの(そのためPQBP5にNOL10という新しい名称がつけられた)、十分な知識は得られていませんでした。今回はPQBP5に焦点を当てた20年近い研究の末に、当初予測していなかった結論に至りました。
研究成果の概要
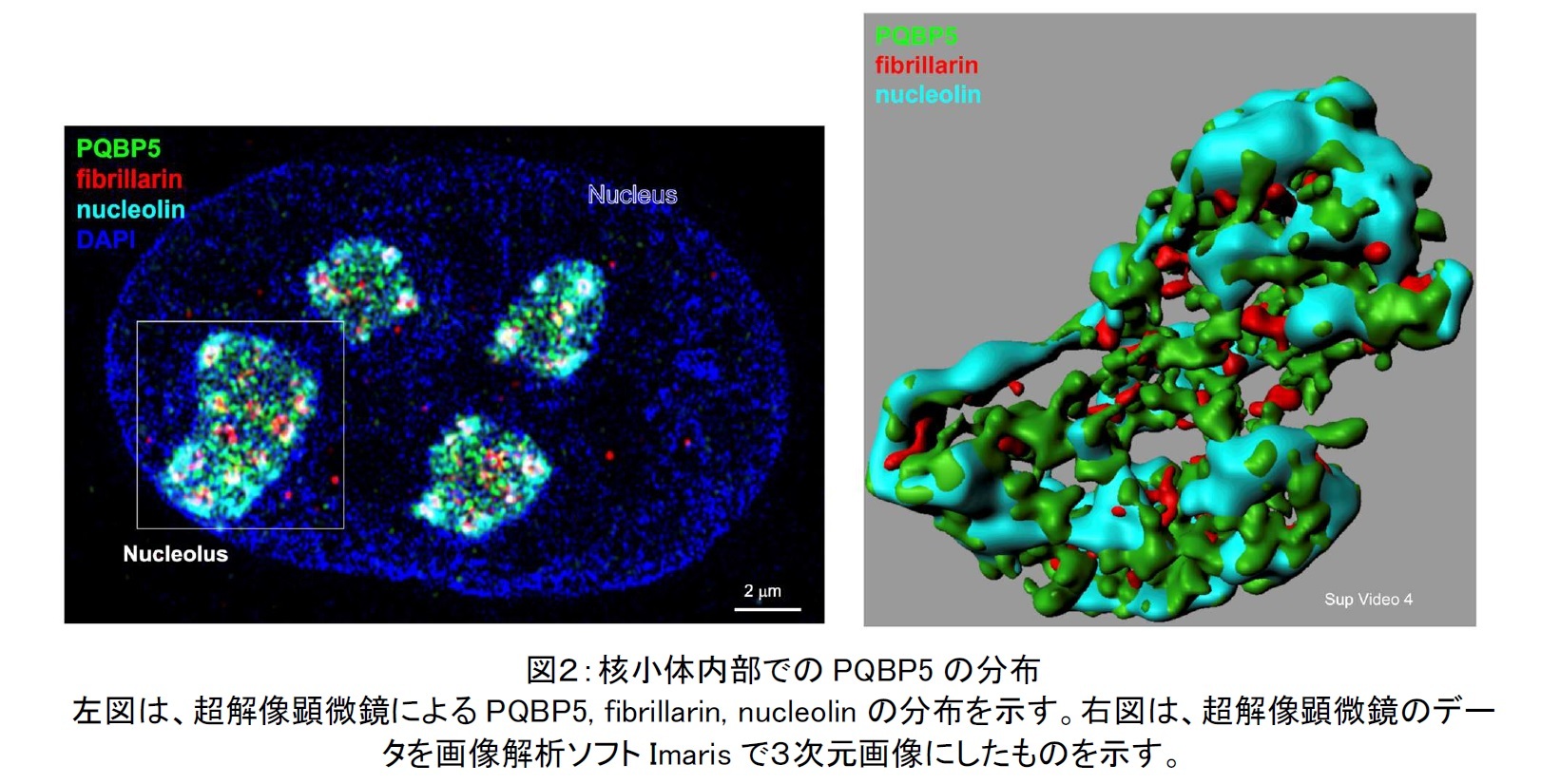
天然変性タンパク質には、「液液相分離(LLPS)」という、水と油のように互いの液相と液相が分離する性質があるために、それ以外のタンパク質から分離して液滴(液体状態での集合体)を形成します。核小体タンパク質に天然変性タンパク質が多いことが近年になって解明されたことから、膜を持たない核小体の形成は、このような液滴であり、LLPSの物理的エネルギー安定性が基盤にあるものと考えられるようになりました。岡澤教授の研究グループは、さらに、他の核小体タンパク質であるfibrillarin, nucleolinと生物物理学的性質を比較することで、PQBP5 が他の核小体タンパク質よりも安定した分子であり、PQBP5によってLLPSに基づく集合体(液滴)である核小体が浸透圧や熱などのストレスに強くなり、構造が安定化することを明らかにしました。
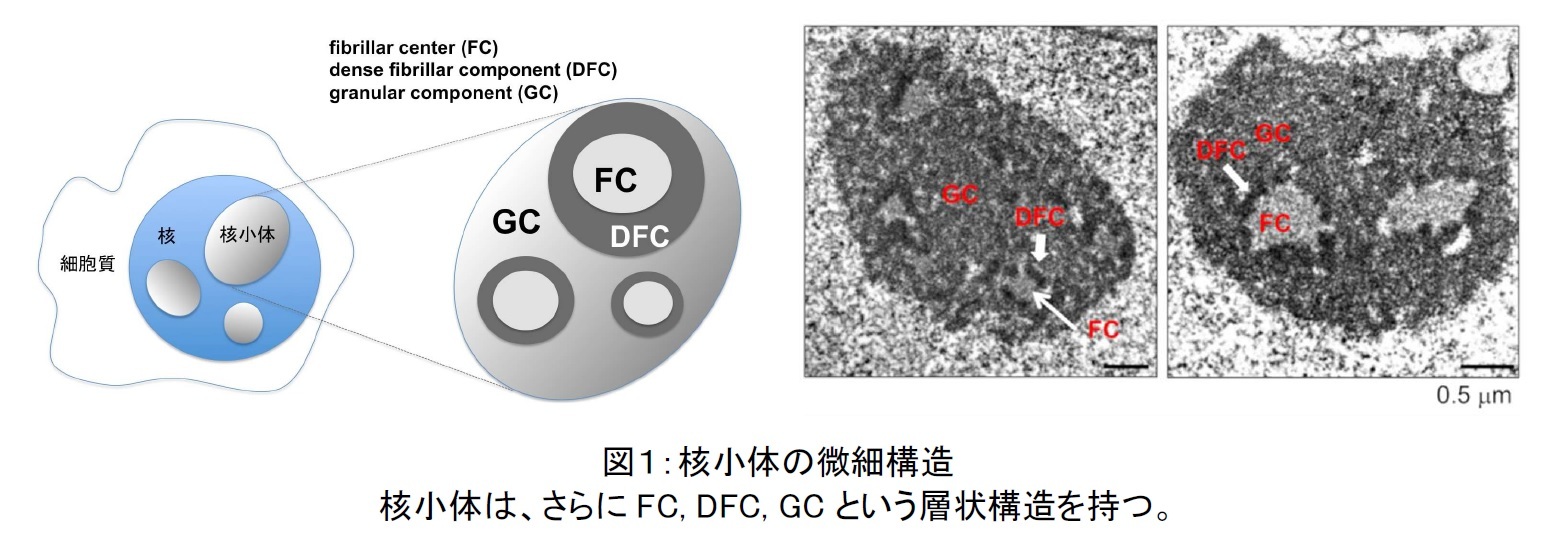
電子顕微鏡で核小体の細部構造を観察すると、核小体にはさらにFC, DFC, GCという細かな構造があることが、これまでに知られています(図1)。
さらに、25年前の疑問に戻って、PQBP5と神経変性疾患との関連についても検討しました。ハンチントン病の原因タンパク質であるハンチンチンと脊髄小脳失調症1型の原因タンパク質であるアタキシン1は、正常型と異常型は共にPQBP5と結合するものの、PQBP5は異常型の封入体に取り込まれて、核小体から不足することが示されました。これは、前述のPQBP5ノックダウンと同様な病態であり、実際、2つの疾患のモデルマウスにおいて、細胞のPQBP5ノックダウンと同様な核小体異常が検出されました。
研究成果の意義
核小体はribosomal DNAからribosomal RNAが産生される場所で形成されると考えられます。PQBP5のLLPS集合体形成もribosomal RNAによって促進することを今回確認しており、この考え方と合致した結果でした。一方、PQBP5ノックダウンはribosomal RNAを最終的に減少させますが、PQBP5タンパク質が減少し、ribosomal RNAが未だ減少していない時点で、すでに核小体構造が崩れていることから、ribosomal RNAが産生されても、PQBP5タンパク質がなければ、核小体は形成できない、と考えられます。
また、今回の研究では、4) 神経変性疾患の原因タンパク質が細胞内凝集体(封入体)を作る過程でPQBP5を巻き込んで(sequestration仮説※4 )、核小体におけるPQBP5を減少させるために、核小体そのものの構造異常を起こすことを示しました。今回の研究では、脊髄小脳失調症、ハンチントン病や球脊髄性筋萎縮症(Kennedy病)を含むポリグルタミン病と呼ばれる神経変性疾患グループにおいて、PQBP5の巻き込みによる核小体病態が実際に生じていることを示しました。
ポリグルタミン病以外に、どのような神経変性疾患において、同様にPQBP5を介した核小体病態が起きているのかは(例えば、アルツハイマー病やパーキンソン病でも同一病態が起きているかは)、PQBP5に結合しうる変性疾患原因タンパク質の種類が網羅的に確認されていないために、現時点では不明です。しかし、今後さらに研究を続けることができれば、種々の神経疾患における核小体病態の広がりを包括的に捉えることが可能になります。
さらに、PQBP5遺伝子は、がん、老化などにも影響を与えていることが予想されます。核小体の大きさ・数が、がん細胞の病理学的診断の根拠に使われているように、核小体は細胞増殖活性と関連しています。脳以外の全身臓器では細胞増殖が低下することをセネセンスと呼び、老化の現象の一つと考えられています。これまでに、がんとPQBP5の遺伝子変異や発現量が関係するという論文が複数発表されていますが、PQBP5が核小体を守る機能があること、すなわち細胞増殖能力や抗がん剤耐性へ影響しうること、と関係があるのではとも予想されます。今後、PQBP5の研究が進むことで、がんや老化の制御につながる可能性もあります。
用語解説
ハンチントン病、脊髄小脳失調症、球脊髄性筋萎縮症(Kennedy病)などの遺伝性神経変性疾患は、原因遺伝子はそれぞれ異なるものの、エクソンの中のCAG繰り返し配列の異常な伸張が原因であることが知られている。このため、ポリグルタミン(グルタミン繰り返し配列)が伸張した疾患遺伝子産物(原因タンパク質)が脳を含む全身臓器に作られており、このことからCAG伸張を伴った遺伝性神経変性疾患をポリグルタミン病という1群のグループとして考えられている。
※2 PQBP1
ポリグルタミン配列結合タンパク質1(Polyglutamine binding protein 1)。岡澤教授らがポリグルタミン配列をbaitとしてyeast two hybrid screening を行い初めて発見したタンパク質であり(Imafuku et al., Biochem. Biophys. Res. Commun 1998; Waragai et al., Hum Mol Genet 1999)、ポリグルタミン病タンパク質あるいは他の正常タンパク質に結合する(Okazawa et al., Neuron 2002)。まぎらわしい分子名として、QBP1という物がありますが、これは人工的に合成した短いペプチドであり、PQBP1とは全く関係のない別物である。
岡澤教授らおよび他グループの研究により、PQBP1は、アルツハイマー病、ハンチントン病、脊髄小脳失調症など複数の神経変性疾患に関わり治療標的となること(Waragai et al., Hum Mol Genet 1999; Okazawa et al., Neuron 2002; Tanaka et al., Mol Psychiatry 2018)、遺伝性知的障害の原因遺伝子であること(Kalsheuer et al., Nature Genet 2003; Ito et al., Mol Psychiatry 2015)が明らかになった。また、分子機能面では、RNAの転写とスプライシングに関与することが知られている(Waragai et al., BBRC 2000; Okazawa et al., Neuron 2002 ; Mizuguchi et al., Nature Commun2014)。
一方、免疫におけるPQBP1の働きについても多くの報告がある。米国のスクリプス研究所を中心とする研究グループは、PQBP1はエイズの原因ウイルスであるHIVウイルスに対するcGAS-STING系※5シグナル経路における細胞内受容体として自然免疫を制御すること、を初めて報告した(Yeo et al., Cell 2015, Yoh et al, Mol Cell 2022)。さらに昨年(2021年)には、岡澤教授の研究グループが、脳においてマクロファージに相当する機能を果たすミクログリア※6が、PQBP1を介してタウ蛋白質に対してcGAS-STING系を介する炎症反応を惹起することを示し、神経変性疾患タンパクとエイズなどの外来病原体へのPQBP1依存的免疫反応の共通性を初めて示した(Jin et al, Nature Commun 2021)。
※3 天然変性タンパク質
タンパク質は決まった形の3次元構造(高次構造)を保っているというのが古典的な考え方であった。しかし、かなりの割合のタンパク質の一部あるいは全体が、安定した高次構造を持たない状態(天然変性状態)にあることが明らかになってきた。高速原子間力顕微鏡を用いて天然変性タンパク質を観察すると、ひげ状あるいは動物の尾のように見える天然変性タンパクドメインが激しく形を変化させている。
※4 Sequestration仮説
神経変性疾患の大多数は、細胞の中に原因タンパク質が集まった封入体を形成する。原因タンパク質はタンパク質の高次構造が失われた変性タンパク質になりやすく、互いに結合し凝集して繊維化することが知られている。1990年代からの研究で、タンパク質分解系、シャペロン、あるいは核タンパク質が、このような凝集過程で封入体に巻き込まれてしまうことが明らかになっている。しかしながら、封入体と周辺の細胞環境の間では、タンパク質が溶けたり凝集したりという平衡状態が存在しているが、ポリグルタミン伸張の大きな疾患タンパク質では、巻き込まれたタンパク質が封入体から外に出て行きにくくなっていることも2000年代の研究によって明らかになっている。
※5 cGAS-STING系
自然免疫では、病原体に特有な構造を認識することに始まります。細胞膜にはToll-like receptor (TLR)などのパターン認識受容体が存在しますが、細胞内にもパターン認識受容体があることがわかってきた。cGAS(cyclic GMP-AMP synthase)-STING(stimulator of interferon genes)は細胞内パターン認識受容体の代表格です。この際に、ZCCHC3、G3BP1さらにPQBP1などのco-sensorがcGASと協力して、病原体の特有構造を認識する例が近年報告されている。PQBP1は、エイズウイルスなどの病原体が感染して、逆転写酵素により細胞内で作られるcDNAあるいはエイズウィルスのタンパク質そのものを、cGASとの共同作業で認識し、STINGを介した炎症遺伝子の発現誘導を起こすことが知られている。
※6 ミクログリア
脳組織を構成する細胞は大きく分けて、ニューロン(神経細胞)とグリア細胞である。ミクログリアは、グリア細胞の一種であり、発生学的には単核球・マクロファージと共通していると考えられ、全身組織のマクロファージや樹状細胞と同様に、脳において自然免疫の中心的役割を果たしている。
論文情報
掲載誌:Nature Communications
論文タイトル: PQBP5/NOL10 maintains and anchors the nucleolus under physiological and osmotic stress conditions
DOI:https://doi.org/10.1038/s41467-022-35602-w
研究者プロフィール

岡澤 均(オカザワ ヒトシ) Hitoshi Okazawa
東京医科歯科大学 難治疾患研究所/脳統合機能研究センター
神経病理学分野 教授、脳統合機能研究センター長
研究領域
神経内科学、神経科学、神経病理学、分子生物学

東京医科歯科大学 難治疾患研究所
神経病理学分野 大学院生
研究領域
神経科学、神経病理学、分子生物学

東京医科歯科大学 難治疾患研究所
神経病理学分野 講師
研究領域
神経科学、神経病理学、分子生物学
問い合わせ先
<研究に関すること>
東京医科歯科大学 難治疾患研究所/脳統合機能研究センター
神経病理学分野 岡澤 均(オカザワ ヒトシ)
E-mail:okazawa.npat[@]mri.tmd.ac.jp
<報道に関すること>
東京医科歯科大学 総務部総務秘書課広報係
〒113-8510 東京都文京区湯島1-5-45
E-mail:kouhou.adm[@]tmd.ac.jp
※E-mailは上記アドレス[@]の部分を@に変えてください。

