数理モデルを用いた白血病治療薬の効果の患者別早期予測手法の提案
発表のポイント
-
◆慢性骨髄性白血病の治療薬であるニロチニブの治療効果を、患者ごとにかつ早期に予測できる数理モデルを開発した。
-
◆ニロチニブは慢性骨髄性白血病患者の白血病細胞の量を劇的に低減するが、その有効性は個々の患者によって異なる。本研究では一般的な血液検査データのみを用いて、白血病細胞および正常な白血球細胞の末梢血中の量の時間変化を予測する数理モデルを開発し、ニロチニブの治療効果を患者ごとに早期に予測できることを示した。
-
◆本研究で開発した数理モデルは患者ごとに個人差があるニロチニブの治療効果を早期予測できることから、慢性骨髄性白血病における新たな個別化医療の実現に貢献すると考えられる。
-
発表概要
この成果は、2022年10月13日にSpringer Nature社の学術誌「npj Systems Biology and Applications」に掲載された。
本研究の一部は、日本学術振興会科学研究費助成事業(JSPS KAKENHI JP15H05707)、国立研究開発法人科学技術振興機構(JST PRESTO JPMJPR16E9)、ムーンショット型研究開発事業(JST Moonshot R&D JPMJMS2021)、日本医療研究開発機構(AMED JP22dm0307009)、東京大学Beyond AI研究推進機構の支援により実施された。また本研究で解析したデータはノバルティスファーマ株式会社の支援を受けて実施された臨床試験N-road study(UMIN臨床試験番号 UMIN000008565;注2)により取得された。
発表内容
慢性骨髄性白血病(chronic myeloid leukemia, CML)とは、白血球、赤血球、血小板などの基となる造血幹細胞の異常により発症する白血病です。この異常な造血幹細胞から分化してできる白血病細胞(以下、CML細胞)は二つの染色体間の相互転座によって形成されたBCR-ABL1融合遺伝子をもち、この遺伝子が作る酵素チロシンキナーゼの異常な活性化によりCML細胞の無秩序な増殖が起こります。現在はBCR-ABL1チロシンキナーゼ阻害剤(TKI;注3)と呼ばれる有望なCML治療薬があり、これがBCR-ABL1融合遺伝子によるチロシンキナーゼの活性化を抑制することでCML細胞を大幅に減少させることができます。実際にTKI は多くのCML患者の予後を改善しますが、一方でその効果には個人差があることも知られています。
CMLの治療効果には、国際標準(International Scale, IS)値(注4)と呼ばれる指標が用いられます。IS値はBCR-ABL1融合遺伝子の発現量を反映したもので、血液検査で測定することができます。CML治療によって、CML細胞の量が十分減少し、深い奏効(deep molecular response, DMR;注5)を得られると、IS値も十分小さくなります。CML治療の実際的な目標はTKIの導入によって深い奏効を達成することだといえます。
現在、新たに診断されたCML患者に投与されるTKIには、第一世代TKIであるイマチニブ、さらに第二世代TKIのダサチニブ、ニロチニブ、ボスチニブがあります。投与中のTKIの効果が乏しい場合は、別のTKIへの切り替えが治療選択肢となる可能性があります。したがって、TKI療法の効果を患者ごとに早期に予測できる数理モデルが求められています。
【研究内容】
我々は、短い時系列データからCML患者ごとのニロチニブの有効性を予測できる数理モデルを提案しました。具体的には、ニロチニブ投与開始時と開始後3、 6ヶ月目のIS値と末梢血中の総白血球細胞の量から、ニロチニブ投与開始後2年以内にCML患者が深い奏効を達成するかどうかを推定できる分類方法を構築しました。成功の鍵は、末梢血中のCML細胞の量の時間変化に焦点を当てたことです。
まず、CML細胞と正常な白血球の末梢血中の量の時間変化を四つのパラメータからなる、単純な常微分方程式モデルで表現しました。このパラメータを患者ごとに変えることで、患者ごとのCML細胞と正常な白血球の末梢血中の量の時間変化をシミュレーション可能にしました(図1a)。しかし、一般的な血液検査ではCML細胞と正常な白血球を区別して測定することはできません。そこで我々は、測定可能なIS値と総白血球細胞の末梢血中の量から、直接測定できないCML細胞と正常な白血球の末梢血中の量を推定する数理モデルを開発しました(図1b)。
次に、慢性骨髄性白血病患者を対象にした臨床試験N-road studyのデータを用いて、個々のCML患者のIS値と末梢血中の総白血球細胞の量の2年分の時系列データから、CML細胞の量に関する常微分方程式モデルのパラメータを患者ごとに推定しました。その結果、この推定パラメータに基づき、深い奏効を達成した患者と深い奏効を達成できなかった患者に分類できることが分かりました。さらに、患者を分類モデルの学習用グループと奏効予測用グループに分割しました。まず、学習用グループの患者の2年分の時系列データから推定された個々の患者のパラメータ値と深い奏効の達成の有無に基づき、分類境界を最適化して決定しました(図2a)。その後、予測用グループの患者の6ヶ月目までのデータから予測対象患者のパラメータ値を推定し、分類境界に基づく深い奏効の達成の有無を予測しました(図2b)。その結果、MR4.5と呼ばれる深い奏効の基準では、最適な分類境界決定法を用いた場合、約94%という高い正解率で深い奏効の達成の有無を予測することができました。
【社会的意義・今後の予定】
本研究で開発した数理モデルを用いることで、CMLの患者がTKIの内服を開始してから2年以内に深い奏効を達成できるかどうかを、6ヶ月という短期間で、また一般的な血液検査のデータを使うことだけで、患者ごとに予測できる可能性が拓かれました。これにより、ある患者がニロチニブでは効果に乏しいと予測された場合、ニロチニブ以外のTKIに切り替えるなど、深い奏効の達成に向けて患者ごとに治療法を最適化する個別化医療への展開が期待されます。
本手法の実用化にはいくつかの課題があります。一点目は被験者数の課題です。本研究ではN-road studyの被験者のうち基準に適合した患者32人のデータを使用していますが、今後、より大規模な臨床試験のデータを用いて本手法の有効性を検証することが必要です。二点目は、ニロチニブ以外のTKIへの適用可能性です。本研究はニロチニブのみで有効性を検証しているため、今後はニロチニブ以外のTKIへの有効性を確認することで、より包括的なCMLの個別化医療の実現が可能になると考えられます。
【謝辞】
本研究の一部は、日本学術振興会科学研究費助成事業(JSPS KAKENHI JP15H05707)、国立研究開発法人科学技術振興機構(JST PRESTO JPMJPR16E9)、ムーンショット型研究開発事業(JST Moonshot R&D JPMJMS2021)、日本医療研究開発機構(AMED JP22dm0307009)、東京大学Beyond AI研究推進機構、の支援により実施されました。また本研究で解析したデータはノバルティスファーマ株式会社の支援を受けて実施された臨床試験N-road study(UMIN臨床試験番号 UMIN000008565)により取得されました。
発表雑誌
論文タイトル:Early Dynamics of Chronic Myeloid Leukemia on Nilotinib Predicts Deep Molecular Response
著者:Yuji Okamoto, Mitsuhito Hirano, Kai Morino, Masashi K. Kajita*,
Shinji Nakaoka, Mayuko Tsuda, Kei-ji Sugimoto, Shigehisa Tamaki, Junichi Hisatake, Hisayuki Yokoyama, Tadahiko Igarashi, Atsushi Shinagawa, Takeaki Sugawara,
Satoru Hara, Kazuhisa Fujikawa, Seiichi Shimizu, Toshiaki Yujiri, Hisashi Wakita, Kaichi Nishiwaki, Arinobu Tojo, Kazuyuki Aihara*
DOI番号:10.1038/s41540-022-00248-3
アブストラクトURL:https://www.nature.com/articles/s41540-022-00248-3
本研究チーム:
-
岡本 有司(東京大学生産技術研究所 特任研究員(研究開始当時)/
京都大学医学研究科 特定助教) -
平野 光人(東京大学大学院医学系研究科 大学院生(研究開始当時)/
公益財団法人がん研究会有明病院血液腫瘍科 医員) -
森野 佳生(東京大学生産技術研究所 特任助教 (研究開始当時)/
九州大学大学院総合理工学研究院 准教授) -
梶田 真司(東京大学生産技術研究所 助教 (研究開始当時)/
福井大学学術研究院工学系部門 助教) -
中岡 慎治(東京大学生産技術研究所 派遣研究員(研究開始当時)/
北海道大学大学院先端生命科学研究院 准教授) -
東條 有伸(東京大学医科学研究所 教授(研究開始当時)/
東京医科歯科大学 理事・副学長) -
合原 一幸(東京大学生産技術研究所 教授(研究開始当時)/東京大学特別教授/
東京大学名誉教授/東京大学 国際高等研究所ニューロインテリジェンス国際研究機構(WPI-IRCN) 副機構長) -
注)研究開始後に研究者の異動などを経つつ継続的に研究開発を行ってきた経緯があるため、研究開始当時の所属も併記しています。
問い合わせ先
東京大学 国際高等研究所ニューロインテリジェンス国際研究機構(WPI-IRCN)
副機構長 合原 一幸(あいはら かずゆき)
〒113-0033 東京都文京区本郷7-3-1
E-mail:kaihara[@]g.ecc.u-tokyo.ac.jp
東京医科歯科大学 理事・副学長
統合イノベーション推進機構長
東條 有伸 (とうじょう ありのぶ)
〒113-8510 東京都文京区湯島1-5-45
E-mail:tojo.adm[@]tmd.ac.jp
福井大学 学術研究院工学系部門 生物応用化学講座
助教 梶田 真司(かじた まさし)
〒910-8507 福井県福井市文京3-9-1
E-mail:masashi[@]-fukui.ac.jp
※E-mailは上記アドレス[@]の部分を@に変えてください。
用語解説
慢性骨髄性白血病とは、全ての血液細胞(白血球,赤血球,血小板)の基となる造血幹細胞の異常によって発症する白血病です。この異常な造血幹細胞は二つの染色体間の相互転座により形成されたBCR-ABL1融合遺伝子をもっており、BCR-ABL1融合遺伝子のABL1チロシンキナーゼが恒常的に活性化されることで、骨髄系の細胞、特に成熟顆粒球が無秩序に増殖します。CMLは自覚症状が乏しい慢性期(chronic phase, CP)から移行期(accelerated phase, AP)を経て、急性白血病のような症状がみられる急性転化期(blast phase, BP)へと病気が進行します。診断や検査の技術が発達した近年では、CMLはCP期に診断されるのが一般的です。CML治療ではCML細胞の量を減らすことに加え、この病気進行を抑制することを目指します。
注2)N-road study
初発の慢性期慢性骨髄性白血病の患者に対して、ニロチニブの安全性と有効性を検討することを目的とした臨床試験です。正式な試験名は「初発の慢性期慢性骨髄性白血病(CML-CP)患者を対象とし、早期の分子遺伝学的完全寛解(Complete Molecular Response; CMR)到達を目標としたニロチニブの至適投与法を検討する多施設共同第Ⅱ相臨床試験《 N-road 》」です。N-road studyはUMIN臨床試験登録システムに試験ID UMIN000008565として登録されています。本研究で提案した数理モデルの有効性の検証にはN-road studyで取得されたデータの一部を使用しました。
注3)BCR-ABL1チロシンキナーゼ阻害剤(tyrosine kinase inhibitor, TKI)
BCR-ABL1チロシンキナーゼ阻害剤とは、CML細胞の増殖に必要なABL1チロシンキナーゼであるBCR-ABL1を選択的に阻害することで、CML細胞の増殖を阻害する効果がある白血病の治療薬です。特にCML細胞はその成長と生存をBCR-ABL1に大きく依存しているため、TKIはCML細胞の量を大幅に減少させることができます。現在、新たに診断されたCP期のCML患者に投与されるTKIには、第一世代TKIであるイマチニブに加え、第二世代TKIのダサチニブ、ニロチニブ、ボスチニブがあります。
注4)国際標準(International Scale, IS)値
日常診療において、CMLに対するTKIの治療反応の評価にはIS値と呼ばれる指標が用いられます。これは国際規模で標準化された末梢血中のBCR-ABL1 mRNAとABL1 mRNAの比率であり、末梢血中の総白血球細胞の量に対するCML細胞の量の割合に対応します。
注5)深い奏効(deep molecular response, DMR)
CMLにおけるTKIに対する最適反応の一つに深い奏効があります。これはIS値によって定義され、MR4.5と呼ばれるDMRの基準は、IS値が0.0032%以下と定められています。MR4.5は4.5log減少と表記される場合があります。
添付資料
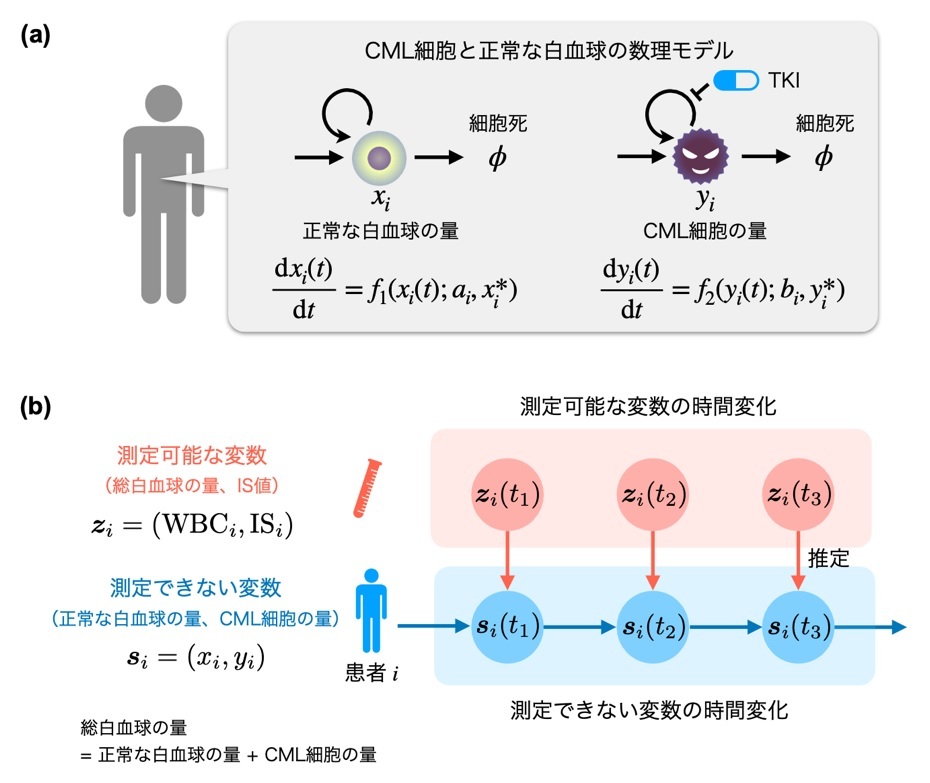
図1:(a)末梢血中の正常な白血球およびCML細胞の量の時間変化を表す常微分方程式モデルを構築しました。このモデルは、患者ごとに異なるパラメータをもちます。これにより、TKIに対する患者ごとの治療効果の違いを表現できます。(b)末梢血中の正常な白血球およびCML細胞の量は、通常直接測定できません。しかし、末梢血中の総白血球細胞の量とIS値は日常的な臨床検査項目であるため、どの病院でも血液検査によって比較的容易に測定できます。総白血球細胞には、正常な白血球とCML細胞が含まれます。そこで測定可能な変数である末梢血中の総白血球細胞の量とIS値から、直接測定できない末梢血中の正常な白血球とCML細胞の量の時間変化を推定する数理モデルを開発しました。
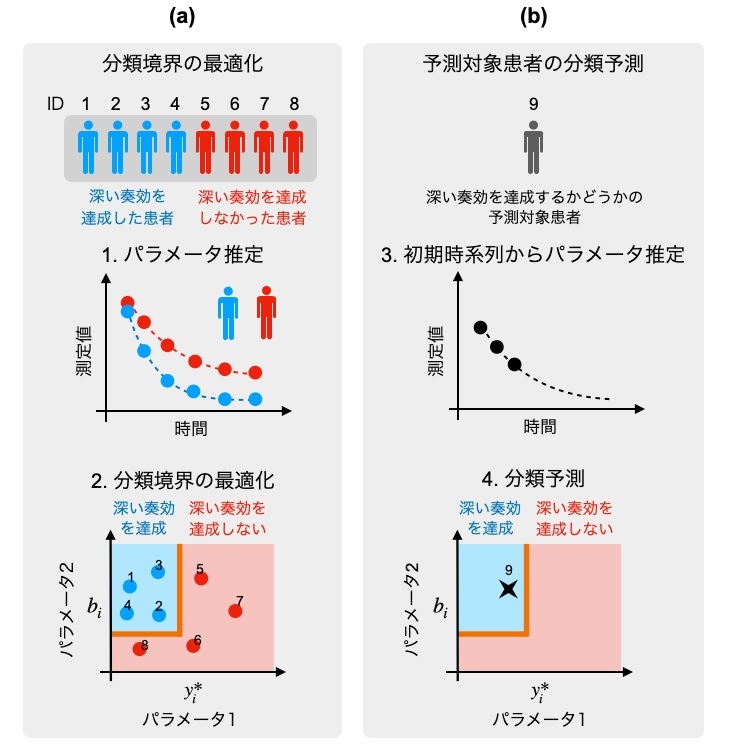
図2:本研究で提案する数理解析手法の四段階の流れ図。(a)時系列データと図1に示した数理モデルを用いて、患者ごとに固有のパラメータ値を推定します(手順1)。推定したパラメータ空間において、2年以内に深い奏効を得られた患者と深い奏効を得られなかった患者を分類する境界を最適化によって求めます。ここまでが学習段階です(手順2)。(b)2年以内に深い奏効を達成するかどうか予測する対象の患者のパラメータを、治療開始から6ヶ月目までの初期時系列データから推定します(手順3)。手順2で決定した分類境界に予測対象患者のパラメータをプロットし、青い領域に入れば2年以内に深い奏効を達成すると予測を決定づけます。上の図の例では、予測対象患者は深い奏効を達成すると予測されています(手順4)。
報道に関する問い合わせ
東京医科歯科大学 総務部 総務秘書課 広報係
E-mail: kouhou.adm[@]tmd.ac.jp
※E-mailは上記アドレス[@]の部分を@に変えてください。

