Factor Xa阻害薬リバーロキサバンに抗動脈硬化作用があることとその分子機序を解明【前嶋康浩 准教授】
公開日:2021.12.28
Factor Xa阻害薬リバーロキサバンに抗動脈硬化作用があることとその分子機序を解明
− 動脈硬化治療薬としての応用に期待 −
ポイント
- 活性型凝固第X因子(FXa)は血液凝固因子のひとつですが、近年の研究によりFXaには動脈硬化を促進する作用があることや、心房細動における塞栓症の予防や静脈血栓塞栓症の治療薬として広く用いられている直接型FXa阻害薬リバーロキサバンには冠動脈疾患の既往を有する患者さんの心血管イベントを減少させる効果もあることが示されていますが、そのメカニズムは明らかではありませんでした。
- 今回、私たちの研究グループは、FXaにはマクロファージにおけるオートファジー活性を抑制することでインフラマソームの形成を増強させてアテローム性プラークの進展を促進させる作用があることを見出すとともに、リバーロキサバンはこの経路を阻害することで動脈硬化の進展を抑制している可能性があることを発見いたしました。
- 本研究成果は、今後FXaを標的とした動脈硬化治療薬を開発することに寄与することが期待されます。
東京医科歯科大学 大学院医歯学総合研究科 循環制御内科学分野の前嶋康浩准教授、笹野哲郎教授の研究グループは、直接型FXa阻害薬リバーロキサバンがマクロファージにおけるオートファジーを活性化させることで炎症を抑制し、抗動脈硬化作用を発揮するという新たな作用機序をつきとめました。この研究はバイエル薬品株式会社と東京医科歯科大学の共同研究(医師主導非臨床研究)として、また、文部科学省科学研究費補助金の支援のもとでおこなわれたもので、その研究成果は国際科学誌JACC: Basic to Translational Scienceに、2021年12月27日にオンライン版で発表されました。
研究の背景
FXaはトロンビン活性化を介して血液凝固を促進する作用を有しますが、そのほかにprotease-activated receptor-2(PAR-2)という細胞膜受容体の活性化を介した細胞内シグナルの活性化作用も有しています。この細胞内シグナルは平滑筋細胞の増殖・遊走、サイトカイン分泌の促進、NF-κBの活性化などをもたらし、動脈硬化の進展に重要な役割を果たすと考えられています。また、FXa阻害薬リバーロキサバンを動脈硬化症マウスモデルに投与するとアテローム性動脈硬化の進展が著明に抑制されることが、これまでの研究により示唆されています。
オートファジーは細胞内において自己を貪食するシステムですが、マクロファージにおけるオートファジーを抑制すると、自然免疫をになう分子複合体であるインフラマソームが活性化して動脈硬化が促進されることも明らかにされております。しかしながら、動脈硬化発症のメカニズムにおいてFXaとオートファジーやインフラマソームのシステムが連携しているのかどうかについては不明のままでした。
今回、私たちの研究グループは「FXaがPAR-2経路を介したオートファジーおよび自然免疫系を介した炎症反応を制御することで、アテローム性動脈硬化の進展に関わっているのではないか?」という仮説を立て、このことについて検証するための一連の実験を行いました。その上で、リバーロキサバンがFXa-PAR-2経路を介する一連の機序に対してどのように作用するかについても検討を行いました。
オートファジーは細胞内において自己を貪食するシステムですが、マクロファージにおけるオートファジーを抑制すると、自然免疫をになう分子複合体であるインフラマソームが活性化して動脈硬化が促進されることも明らかにされております。しかしながら、動脈硬化発症のメカニズムにおいてFXaとオートファジーやインフラマソームのシステムが連携しているのかどうかについては不明のままでした。
今回、私たちの研究グループは「FXaがPAR-2経路を介したオートファジーおよび自然免疫系を介した炎症反応を制御することで、アテローム性動脈硬化の進展に関わっているのではないか?」という仮説を立て、このことについて検証するための一連の実験を行いました。その上で、リバーロキサバンがFXa-PAR-2経路を介する一連の機序に対してどのように作用するかについても検討を行いました。
研究成果の概要
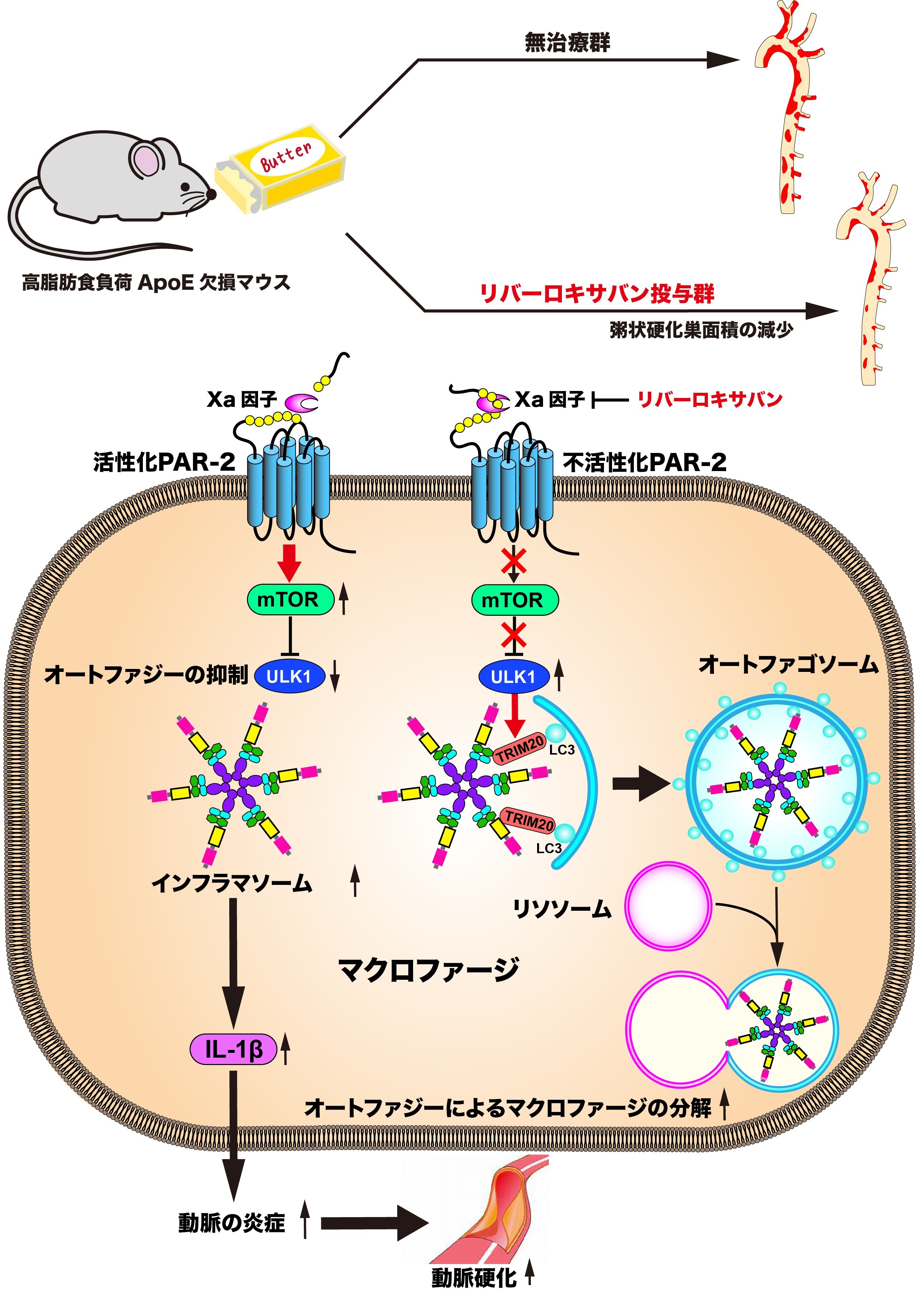
ApoE欠損マウスに高脂肪食負荷を行うと大動脈における粥状動脈硬化巣が著明に形成されますが、血漿FXa活性も有意に上昇することが確認できました。マウスにおいて効果的にFXa活性を抑制することのできるリバーロキサバン投与量120mg/kg/dayをこのモデルに投与したところ、血漿FXa活性は有意に低下し、粥状動脈硬化巣も有意に縮小しました。次に、粥状動脈硬化巣に存在するマクロファージ内のオートファジー活性を検討しました。マクロファージ内のオートファゴソーム数を評価したところ、リバーロキサバンを投与した高脂肪食負荷ApoE欠損マウス群では非投与群と比較してオートファゴソーム数が有意に増加していました。また、培養マクロファージ(=RAW 264.7細胞)に粥状硬化誘導物質7-ketocholesterol(7KC)を添加するとマクロファージにおけるオートファジーが活性化されましたが、FXaを添加するとmTORのリン酸化が促進され、オートファジー活性が抑制されました。さらにリバーロキサバンを追加すると、FXaによるmTORのリン酸化は抑制され、オートファジー活性が回復しました。私たちの研究グループは、さらに高脂肪食負荷ApoE欠損マウス内の粥状動脈硬化巣に発現しているインフラマソームの主要構成タンパクNLRP3の発現量がリバーロキサバン投与によって著明に減少することを見出しました。そして、7KC処理した培養マクロファージにFXaを添加するとNLRP3タンパク量ならびにインフラマソームの活性化で放出されるIL-1β発現量が亢進し、ここにリバーロキサバンを投与すると、これらの発現は抑制されることも見出しました。ここまで見てきたFXaとオートファジーやインフラマソームの活性化の関わりにPAR-2が関与しているのかどうかを検討するため、PAR-2欠損マクロファージを用いた検討を行いました。7KC処理を行うと野生型マクロファージと同様にオートファジーの活性化が生じたものの、FXaを添加してもmTORのリン酸化、オートファジー活性の抑制、インフラマソーム活性の亢進は起こりませんでした。PAR-2の関与については動物実験でも検討を行いました。その結果、高脂肪食を負荷したApoEとPAR-2遺伝子の二重欠損マウスの大動脈における粥状動脈硬化巣の面積は高脂肪食負荷ApoE欠損マウスと比較して有意に低下していましたが、リバーロキサバンを投与した高脂肪食負荷ApoE欠損マウスほどは低下しておらず、FXaを介した動脈硬化促進作用はPAR-2を介した経路にとどまらないことを示唆する結果となりました。また、高脂肪食を負荷したApoEとPAR-2遺伝子の二重欠損マウスにオートファジー阻害物質であるクロロキンを投与したところ、非投与の場合と比較して大動脈における粥状動脈硬化巣の面積が増大し、PAR-2を介した動脈硬化促進作用はオートファジー抑制作用が関与していることが示される結果となりました。
研究成果の意義
本研究を通して、動脈硬化の進展がFXaにより促進されることを動脈硬化マウスモデルにリバーロキサバンを投与することで証明し、またFXaによる動脈硬化促進作用はPAR-2を介したmTORの活性化によるオートファジー活性の抑制がインフラマソームを活性化することにより惹起されていることを示すことができました。
今回の研究成果は、リバーロキサバンには抗凝固作用だけでなく抗動脈硬化作用がある可能性を示した大規模臨床試験ATLAS ACS TIMI 51試験(Mega JL. NEJM 2012;366:9)、COMPASS試験(Eikelboom JW. NEJM 2017;377:1319)、AFIRE試験(Yasuda S. NEJM 2019;381:1103)の結果を分子生物学的見地から支持する知見であると考えられます。また、オートファジーやインフラマソームといった細胞内メカニズムが動脈硬化症の発症や進展に深く関与していることを改めて浮き彫りにする結果となっており、今後、動脈硬化症に対する分子標的薬の開発など新規治療法の開発の進展に寄与することが期待されます。
今回の研究成果は、リバーロキサバンには抗凝固作用だけでなく抗動脈硬化作用がある可能性を示した大規模臨床試験ATLAS ACS TIMI 51試験(Mega JL. NEJM 2012;366:9)、COMPASS試験(Eikelboom JW. NEJM 2017;377:1319)、AFIRE試験(Yasuda S. NEJM 2019;381:1103)の結果を分子生物学的見地から支持する知見であると考えられます。また、オートファジーやインフラマソームといった細胞内メカニズムが動脈硬化症の発症や進展に深く関与していることを改めて浮き彫りにする結果となっており、今後、動脈硬化症に対する分子標的薬の開発など新規治療法の開発の進展に寄与することが期待されます。
論文情報
掲載誌:JACC: Basic to Translational Science
論文タイトル: Rivaroxaban, a Direct Oral Factor Xa Inhibitor, Attenuates Atherosclerosis by Alleviating Factor Xa-PAR2-Mediated Autophagy Suppression
DOI:https://doi.org/10.1016/j.jacbts.2021.09.010
研究者プロフィール

前嶋 康浩(マエジマ ヤスヒロ) Maejima Yasuhiro
東京医科歯科大学 大学院医歯学総合研究科
循環制御内科学分野 准教授
・研究領域
循環器疾患(心不全、心筋症、動脈硬化症、大型血管炎)の基礎/臨床研究

伊藤 祐輔(イトウ ユウスケ) Ito Yusuke
国家公務員共済組合連合会 東京共済病院
循環器科 医長
・研究領域
循環器疾患(虚血性心疾患、動脈硬化症、心不全)の基礎/臨床研究
国家公務員共済組合連合会 東京共済病院
循環器科 医長
・研究領域
循環器疾患(虚血性心疾患、動脈硬化症、心不全)の基礎/臨床研究
問い合わせ先
<研究に関すること>
東京医科歯科大学 大学院医歯学総合研究科
循環制御内科学分野 氏名 前嶋 康浩(マエジマ ヤスヒロ)
E-mail:ymaeji.cvm[@]tmd.ac.jp
<報道に関すること>
東京医科歯科大学 総務部総務秘書課広報係
〒113-8510 東京都文京区湯島1-5-45
E-mail:kouhou.adm[@]tmd.ac.jp

