「スパコンを駆使したビッグデータ解析による アルツハイマー病と前頭側頭葉変性症に共通する病態の解明 (2021)
社会の高齢化が進む日本において、神経変性に起因する認知症はより大きな問題となっている。既に高齢者のほぼ5人に1人が認知症に罹患していると言われ、その半分以上は、神経変性による認知症の代表格であるアルツハイマー病が原因である。さらに、レビー小体型認知症、前頭側頭葉変性症などの変性性認知症も増えている。また、極めて稀な認知症の原因として、ハンチントン病なども知られている。 我々はこれまでに、損傷DNAに対する修復機能低下が神経変性共通病態であることを、前頭側頭葉変性症、ハンチントン病など複数の神経変性疾患において、世界に先駆けて報告してきた(Qi et al. Nature Cell Biol 2007; Enokido et al. J Cell Biol 2010; Fujita et al. Nature Commun 2013; Ito et al. EMBO Mol Med 2015; Taniguchi et al. Hum Mol Genet 2016; Homma et al, Life Sci Alliance 2021)。また、我々は、最近、アルツハイマー病、前頭側頭葉変性症、ハンチントン病などの病態では共通して、従来考えられてきたより遥かに早くTRIADネクローシスという神経細胞死(Apoptosis and Beyond, Chapter 20, 2018)が生じていることを報告してきた(Tanaka et al, Nature Commun 2020; Homma et al, Life Sci Alliance 2021; Mao et al, Hum Mol Genet 2016)。
最近、アミロイド抗体がFDAで優先承認され、大きな期待を集めている。一方、アルツハイマー病の研究領域の国際的な意見集約は、アミロイド凝集に毒性はあるものの、病態全体における役割は限定的(あるいは、「全てではない」)という考え方である。実際、FDAも今回、アミロイド抗体には明確な細胞外アミロイド凝集除去作用があるので、社会的緊急性を認めて優先承認をしたが、認知症状への臨床効果の確認は十分ではない為、承認後の臨床試験が必要である、としている(https://www.fda.gov/drugs/postmarket-drug-safetyinformation-patients-and-providers/aducanumab-marketed-aduhelm-information)。また公表された、Nature、Science、Reuter通信などの記事は、欧米の多くの科学者のアミロイド抗体承認への困惑を伝え、アミロイド以外の治療標的の開発を進める必要にも触れている(https://www.nature.com/articles/d41586-021-01546-2)(https://www.sciencemag.org/news/2021/06/alzheimer-s-drug-approved-despite-doubts-about-effectiveness)(https://jp.reuters.com/article/health-alzheimer-fda-idJPKCN2DL2RX)。 その理由として、認知症患者の脳の中では、1)疾患タンパク質の凝集に先駆けて分子的変化が生じていること(細胞外凝集する前の細胞内アミロイドにも毒性があることなど)、2)単一の疾患原因タンパク質が変化しているのではなく、複数の疾患原因タンパク質が変化していること、などが挙げられている。例えば、アルツハイマー病の生前診断で亡くなった患者の死後脳の病理検査では、アルツハイマー病の特徴であるアミロイドの沈着のみならず、死後脳の4−7割近くにTDP43という前頭側頭葉変性症の特徴とされてきた疾患原因タンパク質の沈着が見られることが報告されている(Amador-Ortiz et al, Ann Neurol 2007; Arai et al, Acta Neuropathol 2009; Higashi et al, Brain Res 2007; Jellinger Neurodegener Dis 2008; Lippa et al, Arch Neurol 2009; Uryu et al, J. Neuropathol. Exp. Neurol. 2008)。また、レビー小体型認知症の特徴とされるアルファ・シヌクレインタンパク質の沈着もしばしば認められる(Lippa et al, Am J Pathol 1998; Hmilton et al, Brain Pathol 2000; Arai et al, Brain Res 2001)。これらの病態には、凝集後アミロイドにフォーカスしたアミロイド抗体は十分な効果を持たないため、凝集前の超早期病態や、複数の認知症原因に対応できる共通病態を解明し、より早期に治療を開発することが、次の段階で、重要なストラテジーと考えられている。もちろん、アミロイド抗体の承認が、このような幅広い開発機運を高めるであろうことは、患者のために非常に喜ばしいことである。
最近、アミロイド抗体がFDAで優先承認され、大きな期待を集めている。一方、アルツハイマー病の研究領域の国際的な意見集約は、アミロイド凝集に毒性はあるものの、病態全体における役割は限定的(あるいは、「全てではない」)という考え方である。実際、FDAも今回、アミロイド抗体には明確な細胞外アミロイド凝集除去作用があるので、社会的緊急性を認めて優先承認をしたが、認知症状への臨床効果の確認は十分ではない為、承認後の臨床試験が必要である、としている(https://www.fda.gov/drugs/postmarket-drug-safetyinformation-patients-and-providers/aducanumab-marketed-aduhelm-information)。また公表された、Nature、Science、Reuter通信などの記事は、欧米の多くの科学者のアミロイド抗体承認への困惑を伝え、アミロイド以外の治療標的の開発を進める必要にも触れている(https://www.nature.com/articles/d41586-021-01546-2)(https://www.sciencemag.org/news/2021/06/alzheimer-s-drug-approved-despite-doubts-about-effectiveness)(https://jp.reuters.com/article/health-alzheimer-fda-idJPKCN2DL2RX)。 その理由として、認知症患者の脳の中では、1)疾患タンパク質の凝集に先駆けて分子的変化が生じていること(細胞外凝集する前の細胞内アミロイドにも毒性があることなど)、2)単一の疾患原因タンパク質が変化しているのではなく、複数の疾患原因タンパク質が変化していること、などが挙げられている。例えば、アルツハイマー病の生前診断で亡くなった患者の死後脳の病理検査では、アルツハイマー病の特徴であるアミロイドの沈着のみならず、死後脳の4−7割近くにTDP43という前頭側頭葉変性症の特徴とされてきた疾患原因タンパク質の沈着が見られることが報告されている(Amador-Ortiz et al, Ann Neurol 2007; Arai et al, Acta Neuropathol 2009; Higashi et al, Brain Res 2007; Jellinger Neurodegener Dis 2008; Lippa et al, Arch Neurol 2009; Uryu et al, J. Neuropathol. Exp. Neurol. 2008)。また、レビー小体型認知症の特徴とされるアルファ・シヌクレインタンパク質の沈着もしばしば認められる(Lippa et al, Am J Pathol 1998; Hmilton et al, Brain Pathol 2000; Arai et al, Brain Res 2001)。これらの病態には、凝集後アミロイドにフォーカスしたアミロイド抗体は十分な効果を持たないため、凝集前の超早期病態や、複数の認知症原因に対応できる共通病態を解明し、より早期に治療を開発することが、次の段階で、重要なストラテジーと考えられている。もちろん、アミロイド抗体の承認が、このような幅広い開発機運を高めるであろうことは、患者のために非常に喜ばしいことである。
我々は、平成22年度~平成26年度・文部科学省『脳科学研究戦略推進プログラム課題E』において、東京大学ヒトゲノム解析センターの宮野悟教授(現・東京医科歯科大学)と共同研究を行い、世界に先駆けて、神経変性疾患を対象にスパコンによる分子ネットワーク解析を導入・開発してきた(Tagawa et al, Hum Mol Genet 2014; Ito et al, Mol Psychiatry 2015; Fujita et al, Nature Commun 2018)。今回の研究では、この技術を発展させ、『多次元ベクトル法』と名付けた新しい手法を考案して、スパコンを駆使したビッグデータ解析により、アルツハイマー病と前頭側頭葉型変性症の共通病態を解明した。
今回の研究では、アルツハイマー病モデルマウス5種類(1種類のノックイン(KI)マウスと4種類のトランスジェニックマウス)、前頭側頭葉変性症のモデルマウス4種類(すべてKIマウス)を用いて、その新生児期から成体(大人のマウス)に至る経過で脳組織をサンプリングして、網羅的プロテオーム解析によりタンパク質の変化を詳細に調べた。得られたビッグデータから、検出された全てのタンパク質がどのような相互関係(分子ネットワーク)を形成して発症につながるのかを、スパコンを駆使した解析によって調べ、アルツハイマー病と前頭側頭葉型認知症の共通性を抽出した。 この際、従来の分子ネットワーク解析法では、単一のタイムポイント(年齢・月齢)での相互関係(分子ネットワーク)しか調べられなかったため、多数のタイムポイント(年齢・月齢)で、前のタイムポイントでのタンパク質変化が次のタイムポイントのタンパク質変化に及ぼす因果関係を反映する新しい分子ネットワーク解析法『多次元ベクトル解析法』を創出した。
今回の研究では、アルツハイマー病モデルマウス5種類(1種類のノックイン(KI)マウスと4種類のトランスジェニックマウス)、前頭側頭葉変性症のモデルマウス4種類(すべてKIマウス)を用いて、その新生児期から成体(大人のマウス)に至る経過で脳組織をサンプリングして、網羅的プロテオーム解析によりタンパク質の変化を詳細に調べた。得られたビッグデータから、検出された全てのタンパク質がどのような相互関係(分子ネットワーク)を形成して発症につながるのかを、スパコンを駆使した解析によって調べ、アルツハイマー病と前頭側頭葉型認知症の共通性を抽出した。 この際、従来の分子ネットワーク解析法では、単一のタイムポイント(年齢・月齢)での相互関係(分子ネットワーク)しか調べられなかったため、多数のタイムポイント(年齢・月齢)で、前のタイムポイントでのタンパク質変化が次のタイムポイントのタンパク質変化に及ぼす因果関係を反映する新しい分子ネットワーク解析法『多次元ベクトル解析法』を創出した。
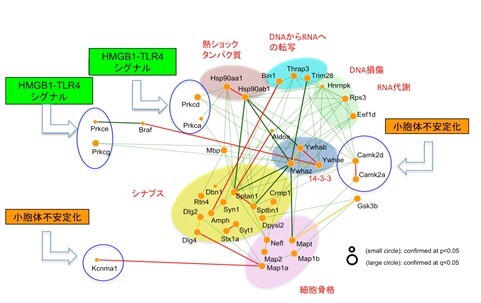
スパコン計算が導き出した、アルツハイマー病と前頭側頭葉変性症の共通分子ネットワーク
本研究によって得られた結果の多くは、これまでに我々が、2つの認知症(アルツハイマー病と前頭側頭葉型認知症)に関して、数々の基礎研究、ゲノム研究、臨床研究で報告してきた複数の分子経路を、さらに支持するものであった。すなわち、シナプス、細胞骨格、熱ショック、転写、RNA代謝、DNA損傷修復に関連する機能を共通病態として予測した。加えて今回の研究成果は、HMGB1-TLRシグナル伝達経路、小胞体安定性が、2つの認知症の共通病態のトリガー(引き金)として重要であることを予測した。 この結果は、研究グループが報告してきたHMGB1-TLRシグナル伝達経路と小胞体安定性に深く関連するネクローシスの1種である、アルツハイマー病の超早期細胞死TRIAD(Tanaka et al, Nature Commun 2020)、髄液・血液でのHMGB1およびSer46リン酸化MARCKSの増加(Fujita et al, Sci Rep 2016; Tanaka et al, Nature Commun 2020; Homma et al, Life Sci Alliance 2021)、HMGB1 に対するモノクローナル抗体による認知症治療(Fujita et al, Sci Rep 2016; Jin et al, Commun Biol 2021)の正当性を強く支持するものであった。仮説を排したビッグデータの数理解析によって、病態、バイオマーカー、抗体医薬の面で、超早期病態および共通病態が支持されたことから、この方向を目指した認知症研究および治療法実用化がさらに加速するものと考えられる。また、認知症の治療は、がんの治療と同様に、多剤併用療法や、さらには複数の異なるモダリティの治療法を組み合わせた形に発展することが予想されている。今回の成果は、そのような複合的治療や、それぞれの患者さんに適した治療薬を選ぶ個別治療につながっていくことが期待される。
発表論文
Jin, M., Jin, X., Homma, H., Fujita, K., Tanaka, H., Murayama, S., Akatsu, H., Tagawa, K. & Okazawa, H. (2021)
Prediction and verification of the AD-FTLD common pathomechanism based on dynamic molecular network analysis.
Commun. Biol. 4 12 August 2021 (1), 961. doi: 10.1038/s42003-021-02475-6
Prediction and verification of the AD-FTLD common pathomechanism based on dynamic molecular network analysis.
Commun. Biol. 4 12 August 2021 (1), 961. doi: 10.1038/s42003-021-02475-6

