アルツハイマー病の超早期細胞死の解明と新たな治療標的を発見 (2020)
アルツハイマー病をはじめとする神経変性疾患は、細胞の内外に異常タンパク質が蓄積することが病理学的な特徴である。アルツハイマー病では、細胞外にアミロイドベータ(以後、アミロイドと略称)と呼ばれる異常ペプチドが沈着する老人斑と、細胞内にタウタンパク質が凝集する神経原線維変化の2つが起こることが知られている。これまで数々の治療法が試みられてきたが、十分な有効性を示すものは得られていない。特に、約15年前からアミロイドに対する抗体医薬品の臨床試験が国際的な規模で行われてきたが、脳内のアミロイド除去に成功したものの、患者の症状は改善が見られないことも予想外の知見として得られた。このため、発症後から治療を開始するのでは既に遅く、発症前にアミロイド抗体療法を開始する、あるいは、脳内の細胞外アミロイド凝集が起きる以前の超早期(Phase 0)に生じる脳内分子変化を解明して、新たな分子標的に対する治療を開発する必要があると考えられるようになってきた。
本研究グループは先行研究において、脳内細胞外アミロイド凝集前にリン酸化の異常変動を示すタンパク質MARCKSを同定し(Tagawa et al, Hum Mol Genet 2015)、リン酸化MARCKS(pSer46MARCKS)が細胞外アミロイドの周囲にある変性神経突起に存在することを報告した(Fujita et al, Sci Rep 2016)。また、pSer46MARCKSの上流シグナルがHMGB1であることを示し、MARCKSのリン酸化を誘導する細胞外分子HMGB1を標的とする抗体治療法がアルツハイマー病の発症を予防することを報告してきた(Fujita et al, Sci Rep 2016)。
本研究グループは先行研究において、脳内細胞外アミロイド凝集前にリン酸化の異常変動を示すタンパク質MARCKSを同定し(Tagawa et al, Hum Mol Genet 2015)、リン酸化MARCKS(pSer46MARCKS)が細胞外アミロイドの周囲にある変性神経突起に存在することを報告した(Fujita et al, Sci Rep 2016)。また、pSer46MARCKSの上流シグナルがHMGB1であることを示し、MARCKSのリン酸化を誘導する細胞外分子HMGB1を標的とする抗体治療法がアルツハイマー病の発症を予防することを報告してきた(Fujita et al, Sci Rep 2016)。
HMGB1はネクローシスというタイプの細胞死を起こした時に放出されることが知られている(Scaffidi et al, Nature 2002)。そこで、患者さんの髄液中のHMGB1を測定したところ、アルツハイマー病として診断される時期の髄液よりも、軽度認知障害(MCI)の時期の患者さんの髄液の方が、HMGB1がより高値であることを見出した。このことは発症前にすでに細胞死が活発に起きていることを示唆している。そこで、アルツハイマー病の2種類のモデルマウスを用いて、本研究で開発したpSer46MARCKS抗体で進行中の神経細胞ネクローシスを検出する技術によって、現在進行形のネクローシスを定量したところ、認知機能障害を起こすより前に、なおかつ、細胞外アミロイド蓄積が見られる前から、ネクローシスが盛んに起きていることが明らかになった。そして、現在進行形ネクローシスは、発症前にピークがあるものの、発症後にも続いているということも示された(下図)。
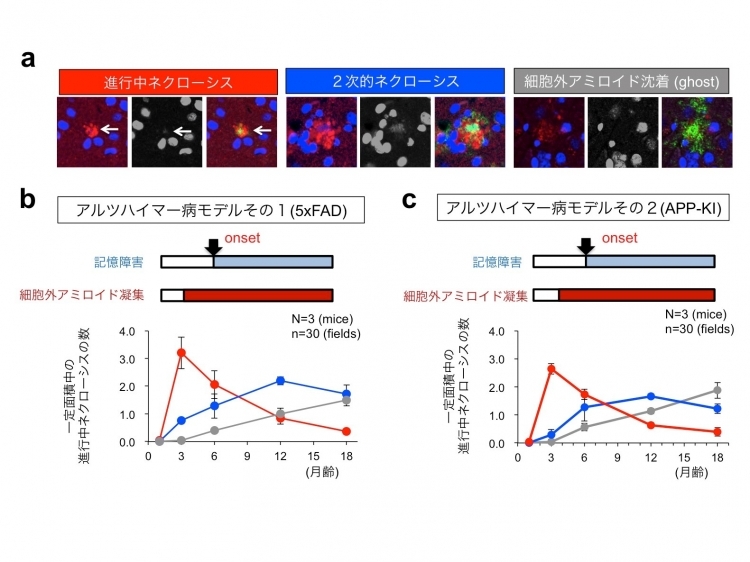
また、ゲノム編集技術を用いてアルツハイマー病遺伝子変異を導入したヒトiPS細胞から分化作成したヒト・アルツハイマー病ニューロンの詳細な観察から、このようなネクローシスは細胞内アミロイドがYAPと呼ばれるタンパク質を巻き込んで、YAPの細胞生存維持作用が奪われるために生じる新しいタイプのネクローシス(TRIAD)であることが分かった。
さらに、本研究ではネクローシスを引き起こすYAP機能障害を正常化する目的で、遺伝子治療によるYAP補充をアルツハイマー病モデルマウスに対して行った。その結果、TRIADネクローシスの抑制、認知機能改善、そして、細胞外アミロイド蓄積の抑制が観察された。
さらに、本研究ではネクローシスを引き起こすYAP機能障害を正常化する目的で、遺伝子治療によるYAP補充をアルツハイマー病モデルマウスに対して行った。その結果、TRIADネクローシスの抑制、認知機能改善、そして、細胞外アミロイド蓄積の抑制が観察された。
本研究を通じて、細胞外アミロイド凝集を最上流の原因と考えるアミロイド仮説を訂正する必要性が強く示唆された。 代わりに、
1)細胞内アミロイド蓄積に始まるネクローシスの結果として細胞外アミロイド凝集がおきること、
2)(a)細胞内アミロイド蓄積に起因するネクローシス過程および(b)ネクローシスを起こした細胞の周辺神経細胞が起こす二次的細胞死過程が神経機能障害を引き起こしていること、
3)細胞内アミロイド蓄積がトリガーするネクローシスはYAP機能低下に起因するTRIADであること、
4)YAP機能回復を基盤とする遺伝子治療等の治療開発が今後可能であること
を示した(下図)。また、
5)髄液HMGB1量がアルツハイマー病の発症前分子マーカーとして開発しうる可能性
を示した。
1)細胞内アミロイド蓄積に始まるネクローシスの結果として細胞外アミロイド凝集がおきること、
2)(a)細胞内アミロイド蓄積に起因するネクローシス過程および(b)ネクローシスを起こした細胞の周辺神経細胞が起こす二次的細胞死過程が神経機能障害を引き起こしていること、
3)細胞内アミロイド蓄積がトリガーするネクローシスはYAP機能低下に起因するTRIADであること、
4)YAP機能回復を基盤とする遺伝子治療等の治療開発が今後可能であること
を示した(下図)。また、
5)髄液HMGB1量がアルツハイマー病の発症前分子マーカーとして開発しうる可能性
を示した。

発表論文
Tanaka, H., Homma, H., Fujita, K., Kondo, K., Yamada, S., Jin, X., Waragai, M., Ohtomo, G., Iwata, A., Tagawa, K., Atsuta, N., Katsuno, M., Tomita, N., Furukawa, K., Saito, Y., Saito, T., Ichise, A., Shibata, S., Arai, H., Saido, T., Sudol, M., Muramatsu, S., Okano, H., Mufson, E. J., Sobue, G., Murayama, S. & Okazawa, H.
YAP-dependent necrosis occurs in early stages of Alzheimer’s disease and regulates mouse model pathology.
Nat. Commun. 11. doi: 10.1038/s41467-020-14353-6
YAP-dependent necrosis occurs in early stages of Alzheimer’s disease and regulates mouse model pathology.
Nat. Commun. 11. doi: 10.1038/s41467-020-14353-6

