飢餓により誘導されるオートファジーに伴う”細胞内”アミロイドの増加を発見(2015)
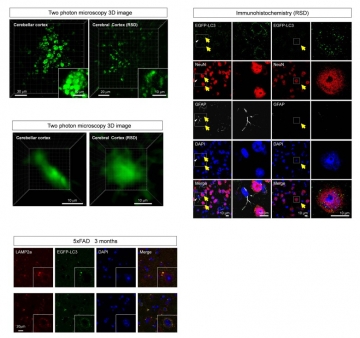
アルツハイマー病をはじめとする神経変性疾患は、細胞の内外に異常たんぱく質が蓄積することが病理学的な特徴である。アルツハイマー病では、細胞外にベータアミロイドと呼ばれる異常タンパク質が沈着する老人斑と、細胞内にタウタンパク質が凝集する神経原線維変化の2つが起こる。一方、異常タンパク質を除去する細胞機構として、ユビキチン・プロテアソーム系とオートファジー系の2つの分解系が知られ、さらに、オートファジーには、常に一定レベルで働いている基礎的オートファジー(basal autophagy)とカロリー制限などで活性化する誘導性オートファジー(induced autophagy)があることが知られている。これまで、誘導性オートファジーが脳以外の組織においては大きな役割を果たすことは知られていたが、脳組織での誘導性オートファジーの存在が認められていないという報告(Mizushima et al, Mol Biol Cell 2004; etc)がある一方で、カロリー制限等による誘導性オートファジーが神経変性疾患における異常タンパク質の凝集を除き、症状を改善するとの結果が多数報告されており(Ravikumar et al, Nat Genet 2004; etc)、神経細胞における誘導性オートファジーの有無は決着していなかった。また、高等動物における誘導性オートファジーには、インスリン受容体からmTOR(mammalian target of rapamycin)を介するシグナル経路が重要と考えられているため、糖尿病や高カロリーがリスクファクターといわれるアルツハイマー病の病態理解の上でも、この決着は重要であった。そこで本研究では『神経細胞における誘導性オートファジーの有無』を明らかにすることを第一の目標とした。マクロオートファジーを特徴付けるオートファゴゾームのマーカー分子であるLC3から作成した融合蛍光タンパク質(LC3-EGFP)を脳内に発現させて、生きたマウスの脳内部でダイナミックに変化するオートファゴゾームを2光子顕微鏡で観察する方法を開発し、脳における飢餓誘導性オートファジーが、神経細胞において実際に存在することを証明した。さらに、マウス脳の同じ場所を継続的に観察することにより、脳内のオートファゴゾーム形成に概日リズム(circadian rhythm)があることを発見した。
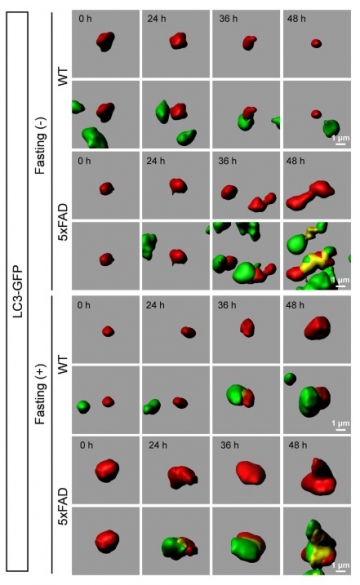
次に、アルツハイマー病では、オートファジーが病態を抑制するのかそれとも進行させるのか、という特異的な問題点があった。オートファジーは細胞内の異常たんぱく質を除去するシステムであることから、病態を抑制すると思われる。実際、変性疾患の一つであるポリグルタミン病のモデルマウスでは誘導性オートファジーが症状を改善するとの報告がある(Ravikumar et al, Nat Genet 2004; etc)。一方で、アルツハイマー病においては、オートファジー系の膜はベータアミロイド産生の場であり、オートファジーを活性化すると細胞外アミロイドが増加すること(Yu et al, J Cell Biol 2005; Nixon et al, J Neuropathol Exp Neurol, 2005)、アルツハイマー病モデルマウスにおいてオートファジーに必須の遺伝子Atg7を欠損させると細胞外ベータアミロイドが減少するという結果(Nillson et al, Cell Rep 2013)が報告されていた。これらの研究結果は、オートファジーがアルツハイマー病態を進行させることを示唆している。そこで本研究では『アルツハイマー病におけるオートファジーの功罪』を明確にすることを第二の目的とした。結果として、アルツハイマー病態では飢餓による誘導性オートファジーが亢進しているものの、エンドサイトーシス亢進によって細胞外から取り込んだベータアミロイドを十分に分解処理出来ず、細胞内にベータアミロイドを溜め込むこと、さらにはこの細胞内アミロイドの増加はアルツハイマー病で侵されやすい脳内の重要部位で起こることが明らかになった。また、細胞内にベータアミロイドが増加した神経細胞を詳細に観察すると、一部は細胞が膨張して破裂し、ベータアミロイドを周辺にまき散らす像も得られた。これらの結果は、アルツハイマー病態に飢餓状態が重なることによって引き起こされる細胞内のベータアミロイドの増加が細胞死につながり、病態の悪化を加速する可能性を示している。
本研究により、脳神経細胞においても飢餓誘導性オートファジーが存在し、さらにマクロオートファジーの活動性には日内変動があることを示した。さらに本研究成果は、アルツハイマー病態におけるオートファジーの活性化が細胞外から細胞内へのベータアミロイドの取り込み促進に働くものの、細胞内部でのベータアミロイドの分解処理には不十分であり、むしろ細胞内にベータアミロイドが蓄積して細胞膨張を伴う細胞死につながる可能性を強く示唆している。今日では、過度なカロリー摂取などの生活習慣がアルツハイマー病進行を早める要素であることが広く認められている。しかし、脳内で細胞外のベータアミロイド濃度がある程度高まった後では、むしろ、カロリー制限によってオートファジーを過度に活性化することがアルツハイマー病態を悪化させるリスクとなることが、本研究成果から想定される。これは、食習慣を通じた認知症予防・治療を今後進める際に重要なポイントと考えられる。また、アルツハイマー病のゲノムワイド関連遺伝子解析(GWAS)においてオートファジー関連遺伝子が有意な相関を示していることから(Lipinski et al, Proc Natl Acad Sci USA, 2010)、アルツハイマー病においてオートファジーが機能不全に陥っている可能性も疑われる。この点も、カロリー制限による過度なオートファジー促進がアルツハイマー病の増悪因子となりうることを示唆している。
発表論文
Chen, X., Kondo, k., Motoki, k., Homma, H., Okazawa, H.
Fasting activates macroautophagy in neurons of Alzheimer’s disease mouse model but is insufficient to degrade amyloid-beta.
Scientific Reports. 5, Article number: 12115. doi: 10.1038/srep12115 Epub date: 14 July 2015
Fasting activates macroautophagy in neurons of Alzheimer’s disease mouse model but is insufficient to degrade amyloid-beta.
Scientific Reports. 5, Article number: 12115. doi: 10.1038/srep12115 Epub date: 14 July 2015

