unc-60遺伝子の筋特異的選択的プロセシング
PLoS Genetics (2012), Worm (2013)
線虫のアクチン脱重合化因子(ADF)/コフィリン遺伝子の選択的プロセシングパターンの筋特異的な切り替えの制御機構について紹介します.
線虫のアクチン脱重合化因子(ADF)/コフィリン遺伝子の選択的プロセシングパターンの筋特異的な切り替えの制御機構について紹介します.
この研究成果は、米国Emory大学斧正一郎博士との共同研究によるものです.
線虫ADF/コフィリン遺伝子unc-60
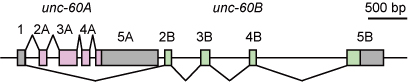
unc-60遺伝子の構造の模式図(Worm, 2013より)
アクチン脱重合化因子(ADF, Actin Depolymerising Factor)/コフィリンは、アクチン繊維に結合して切断したり脱重合を促したりしてアクチン線維の動態を制御し、アクチン細胞骨格の再構成を促進する因子です[1].
哺乳類ではADF、コフィリン-1、コフィリン-2の3種類のタンパク質ファミリーに対応する3つの遺伝子が存在し、非筋組織ではコフィリン-1が、筋組織ではコフィリン-2が主に発現しています[2].
線虫ではunc-60遺伝子がADF/コフィリンをコードする唯一の遺伝子ですが、選択的プロセシングにより、非筋組織特異的なUNC-60Aと筋特異的なUNC-60Bの2つの成熟mRNAが産生されます(右図)[3,4,5].
UNC-60AとUNC-60Bの2つのmRNAアイソフォームはエクソン1のみを共有し、UNC-60Aではエクソン2Aから5Aが、UNC-60Bではそのさらに下流にあるエクソン2Bから5Bが使われます.
UNC-60AとUNC-60Bの2つのタンパク質が共有するのは最初のメチオニンコドンだけですが、全体としてアミノ酸配列の相同性が高いもののアクチン線維に対する生化学的な特性が異なる2種類のADF/コフィリンタンパク質が産生されます[5,6,7].
哺乳類ではADF、コフィリン-1、コフィリン-2の3種類のタンパク質ファミリーに対応する3つの遺伝子が存在し、非筋組織ではコフィリン-1が、筋組織ではコフィリン-2が主に発現しています[2].
線虫ではunc-60遺伝子がADF/コフィリンをコードする唯一の遺伝子ですが、選択的プロセシングにより、非筋組織特異的なUNC-60Aと筋特異的なUNC-60Bの2つの成熟mRNAが産生されます(右図)[3,4,5].
UNC-60AとUNC-60Bの2つのmRNAアイソフォームはエクソン1のみを共有し、UNC-60Aではエクソン2Aから5Aが、UNC-60Bではそのさらに下流にあるエクソン2Bから5Bが使われます.
UNC-60AとUNC-60Bの2つのタンパク質が共有するのは最初のメチオニンコドンだけですが、全体としてアミノ酸配列の相同性が高いもののアクチン線維に対する生化学的な特性が異なる2種類のADF/コフィリンタンパク質が産生されます[5,6,7].
unc-60選択的プロセシングレポーター
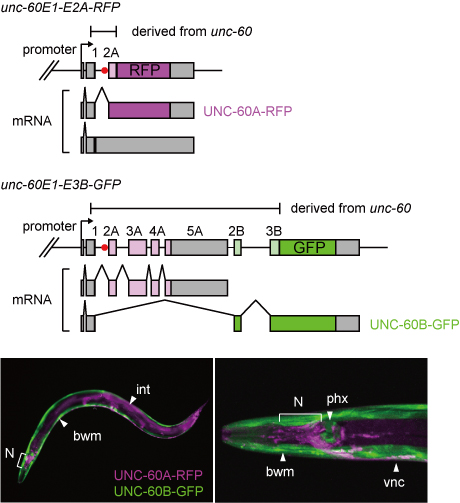
unc-60レポーターミニ遺伝子とレポーター線虫(Worm, 2013より)
unc-60遺伝子の複雑な選択的プロセシングパターンを生体で可視化するために、右図上のように、非対称的な2つのレポーターミニ遺伝子を作製しました.
unc-60E1-E2A-RFPミニ遺伝子は、エクソン1とエクソン2Aの間のイントロン(イントロン1Aと呼ぶことにします)がスプライシングにより除去された時のみ赤色蛍光タンパク質(RFP)を発現します.
一方、unc-60E1-E3B-GFPミニ遺伝子はUNC-60B型のプロセシングを受けたときに緑色蛍光タンパク質(GFP)を発現します.
このミニ遺伝子ペアを発現させたところ、右図下のように体壁筋と咽頭筋はUNC-60B型(GFP)を発現し、神経系や腸など他の組織はUNC-60A型(RFP)を発現するレポーター線虫が得られました.
このことは、作製したunc-60選択的プロセシングレポーターが内在性unc-60遺伝子の筋特異的な選択的プロセシングパターンの切替えを再現していることを示しています.すなわち、短いunc-60E1-E2A-RFPミニ遺伝子にも、unc-60遺伝子の筋特異的選択的プロセシングパターンを決定するのに必要なシスエレメントが存在することを意味しています.
unc-60E1-E2A-RFPミニ遺伝子は、エクソン1とエクソン2Aの間のイントロン(イントロン1Aと呼ぶことにします)がスプライシングにより除去された時のみ赤色蛍光タンパク質(RFP)を発現します.
一方、unc-60E1-E3B-GFPミニ遺伝子はUNC-60B型のプロセシングを受けたときに緑色蛍光タンパク質(GFP)を発現します.
このミニ遺伝子ペアを発現させたところ、右図下のように体壁筋と咽頭筋はUNC-60B型(GFP)を発現し、神経系や腸など他の組織はUNC-60A型(RFP)を発現するレポーター線虫が得られました.
このことは、作製したunc-60選択的プロセシングレポーターが内在性unc-60遺伝子の筋特異的な選択的プロセシングパターンの切替えを再現していることを示しています.すなわち、短いunc-60E1-E2A-RFPミニ遺伝子にも、unc-60遺伝子の筋特異的選択的プロセシングパターンを決定するのに必要なシスエレメントが存在することを意味しています.
筋特異的プロセシングパターンの制御因子
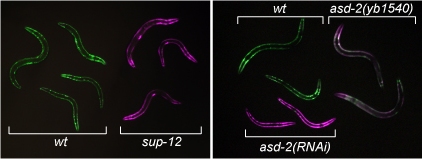
sup-12変異体とasd-2変異体における体壁筋でのunc-60レポーターの発現
(PLoS Genetics, 2012より)
上記のunc-60選択的プロセシングレポーターは、体壁筋特異的に発現させるとUNC-60B型(GFP)のみを発現し緑色ですが、当研究室が同定した筋特異的選択的スプライシング制御因子SUP-12の変異体やASD-2の変異体背景ではUNC-60A型(RFP)を発現し赤色に変化しました(図).
また、これらの変異体では、体壁筋が内在性のUNC60Bの代わりにUNC-60Aを発現していることも分かりました.
このことは、SUP-12とASD-2が筋組織においてunc-60遺伝子の選択的プロセシングパターンをUNC-60A型からUNC60B型に切り替えるのに必須の機能を果たしていることを示しています.
また、これらの変異体では、体壁筋が内在性のUNC60Bの代わりにUNC-60Aを発現していることも分かりました.
このことは、SUP-12とASD-2が筋組織においてunc-60遺伝子の選択的プロセシングパターンをUNC-60A型からUNC60B型に切り替えるのに必須の機能を果たしていることを示しています.
シスエレメントの同定
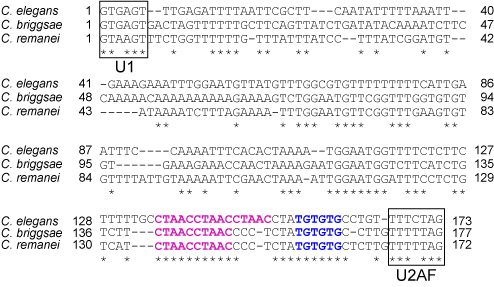
3種の線虫のunc-60遺伝子イントロン1Aの配列(PLoS Genetics, 2012より)
2つのミニ遺伝子に共通して存在するイントロン1Aに、同属の線虫でよく保存されているCUAACの繰り返し配列とUGUGUG配列があります(図).
両ミニ遺伝子のこれらの配列にそれぞれ変異を導入すると、体壁筋でもUNC-60B型(GFP)の代わりにUNC-60A型(RFP)が発現するようになりました.
このことは、これらの配列が共にunc-60ミニ遺伝子の選択的プロセシングパターンをUNC-60A型からUNC60B型に切り替えるのに必須のシスエレメントであることを示しています.
さらに、ASD-2がこのCUAACの繰り返し配列にSUP-12がUGUGUG配列にそれぞれ特異的にかつ協働的に結合することを試験管内の結合実験で確認しました.
両ミニ遺伝子のこれらの配列にそれぞれ変異を導入すると、体壁筋でもUNC-60B型(GFP)の代わりにUNC-60A型(RFP)が発現するようになりました.
このことは、これらの配列が共にunc-60ミニ遺伝子の選択的プロセシングパターンをUNC-60A型からUNC60B型に切り替えるのに必須のシスエレメントであることを示しています.
さらに、ASD-2がこのCUAACの繰り返し配列にSUP-12がUGUGUG配列にそれぞれ特異的にかつ協働的に結合することを試験管内の結合実験で確認しました.
制御のモデルと研究成果の意義
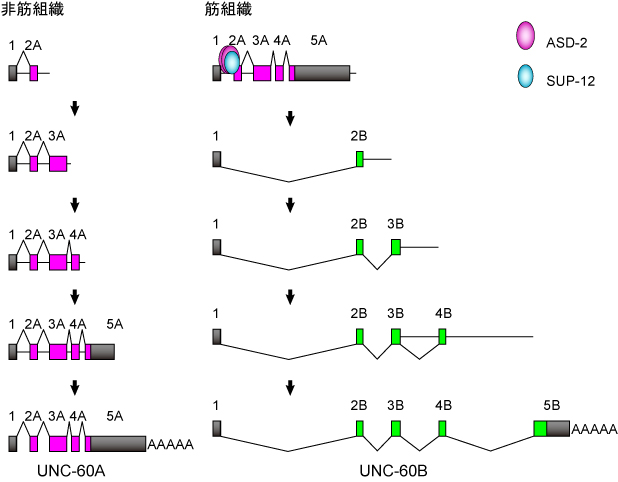
unc-60遺伝子の組織特異的選択的プロセシング制御のモデル(PLoS Genetics 2012より)
非筋組織では、エクソン1から2A以下のA型のエクソンがスプライシングされ、ポリAが付加されてUNC-60A mRNAが産生されます(図左).
一方、筋組織では、筋特異的選択的スプライシング制御因子ASD-2とSUP-12が協働的にイントロン1Aのシスエレメントに結合してエクソン2Aへのスプライシングを抑制し、結果としてエクソン1からエクソン2Bへスプライシングされ、UNC-60B mRNAが産生されます(図右).興味深いことに、筋組織でもA型のエクソン同士のスプライシングは抑制されていないようです.
この研究は、2つのスプライシング制御因子が協同してひとつのスプライス部位を抑制することで、複雑に見えた遺伝子全体の選択的プロセシングパターンをスイッチのように切り替えられることを明らかにしました.
一方、筋組織では、筋特異的選択的スプライシング制御因子ASD-2とSUP-12が協働的にイントロン1Aのシスエレメントに結合してエクソン2Aへのスプライシングを抑制し、結果としてエクソン1からエクソン2Bへスプライシングされ、UNC-60B mRNAが産生されます(図右).興味深いことに、筋組織でもA型のエクソン同士のスプライシングは抑制されていないようです.
この研究は、2つのスプライシング制御因子が協同してひとつのスプライス部位を抑制することで、複雑に見えた遺伝子全体の選択的プロセシングパターンをスイッチのように切り替えられることを明らかにしました.
文献
1. Ono S (2007) Mechanism of depolymerization and severing of actin filaments and its significance in cytoskeletal dynamics. Int Rev Cytol 258: 1-82.
2. Bernstein BW, Bamburg JR (2010) ADF/cofilin: a functional node in cell biology. Trends Cell Biol 20: 187-195.
3. McKim KS, Matheson C, Marra MA, Wakarchuk MF, Baillie DL (1994) The Caenorhabditis elegans unc-60 gene encodes proteins homologous to a family of actin-binding proteins. Mol Gen Genet 242: 346-357.
4. Ono K, Parast M, Alberico C, Benian GM, Ono S (2003) Specific requirement for two ADF/cofilin isoforms in distinct actin-dependent processes in Caenorhabditis elegans. J Cell Sci 116: 2073-2085.
5. Ono S, Benian GM (1998) Two Caenorhabditis elegans actin depolymerizing factor/cofilin proteins, encoded by the unc-60 gene, differentially regulate actin filament dynamics. J Biol Chem 273: 3778-3783.
6. Yamashiro S, Mohri K, Ono S (2005) The two Caenorhabditis elegans actin-depolymerizing factor/cofilin proteins differently enhance actin filament severing and depolymerization. Biochemistry 44: 14238-14247.
7. Ono K, Yamashiro S, Ono S (2008) Essential role of ADF/cofilin for assembly of contractile actin networks in the C. elegans somatic gonad. J Cell Sci 121: 2662-2670.
2. Bernstein BW, Bamburg JR (2010) ADF/cofilin: a functional node in cell biology. Trends Cell Biol 20: 187-195.
3. McKim KS, Matheson C, Marra MA, Wakarchuk MF, Baillie DL (1994) The Caenorhabditis elegans unc-60 gene encodes proteins homologous to a family of actin-binding proteins. Mol Gen Genet 242: 346-357.
4. Ono K, Parast M, Alberico C, Benian GM, Ono S (2003) Specific requirement for two ADF/cofilin isoforms in distinct actin-dependent processes in Caenorhabditis elegans. J Cell Sci 116: 2073-2085.
5. Ono S, Benian GM (1998) Two Caenorhabditis elegans actin depolymerizing factor/cofilin proteins, encoded by the unc-60 gene, differentially regulate actin filament dynamics. J Biol Chem 273: 3778-3783.
6. Yamashiro S, Mohri K, Ono S (2005) The two Caenorhabditis elegans actin-depolymerizing factor/cofilin proteins differently enhance actin filament severing and depolymerization. Biochemistry 44: 14238-14247.
7. Ono K, Yamashiro S, Ono S (2008) Essential role of ADF/cofilin for assembly of contractile actin networks in the C. elegans somatic gonad. J Cell Sci 121: 2662-2670.

