EBVの研究
EBV感染モデルマウスの開発と応用
EBV持続感染を再現できる実験動物系はなく、潜伏感染の実態解明や抗EBV剤開発の支障になっている。免疫不全マウスNOG(NOD/SCID/γcnullマウス)にヒト造血幹細胞を移植したマウス(ヒト化マウス)に接種ウイルス量を変えてEBV感染することにより、EBV陽性B細胞リンパの発症や無症候性のEBV持続感染を自在に誘導することが可能になった。一方、EBV潜伏感染細胞にはEBVにコードされるチミジンキナーゼ(EBV-TK)が発現していることを見出し、さらにEBV-TKにより特異的にリン酸化され細胞毒性を発揮する薬剤を同定した。新規抗EBV剤の開発を目指し、今後EBV感染モデルマウスを使用した前臨床試験を行っていく計画である。
鼻性T/NKリンパ腫の研究
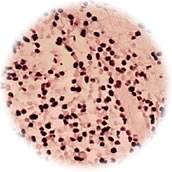
進行性鼻壊疽は、鼻腔および口蓋に発生するリンパ増殖性疾患である。組織は壊死像が強いため診断が難しく、また進行性に経過し様々な部位に転移するため末期になって確定診断がつき手遅れになることもしばしば経験される予後不良の疾患である。ほとんど全ての症例で病変部においてEBV感染細胞のモノクローナルな増殖が証明されるため、EBV陽性リンパ腫と考えられている。
進行性鼻壊疽の病理組織標本を免疫染色するとCD3が検出されるため当初はT細胞リンパ腫であると考えられていた。しかし、免疫染色では細胞質CD3がNK細胞でも陽性となるため本来NKリンパ腫とすべきものが誤認されていた可能性が高く、さらにT細胞リセプターの再構成も検出できないためNKリンパ腫と考えるのが妥当とする研究者が増加している。
一方、検索したほとんどの症例でT細胞リセプターの再構成が確認できるためやはり進行性鼻壊疽はT細胞リンパ腫であるとの研究結果も報告されており、原因細胞の詳細については議論が続いていた。病変組織の壊死像が強いことと病変部から細胞株が樹立されていないことが研究を行うための障害となっており、病気の本態がいまだ確定していない要因となっている。したがって、病変部から細胞株を樹立しその細胞を詳しく解析することが可能になれば進行性鼻壊疽の本態に関する研究は大きく進展するものと考えられる。
過去、病変部から細胞株を樹立する試みが行われていたが成功例の報告はなかった。その理由として、壊死性の病変部から微生物を繁殖させることなく細胞を培養することが難しいことと、NK細胞由来細胞株の報告はこれまでごく少数であることから分かるようにNK細胞由来の細胞株を樹立すること自体が非常に難しいことがあげられる。我々は、最近、進行性鼻壊疽患者末梢血からEBV陽性細胞株を樹立することに成功した。今回この経験を踏まえ患者病変部から細胞株を樹立し、病気の本態解明の研究に供することを目的として研究を行った。
進行性鼻壊疽と診断された2人の患者から得た鼻腔病変部由来生検材料を細切後メッシュを通しリンパ性細胞を採取した。得られた細胞を増殖培地(RPMI1640培地+10%ヒト血清+700U/ml IL-2 )中で培養したところ、いずれの場合もリンパ系細胞の急速な増殖が認められた。増殖した細胞の表面抗原を染色後フローサイトメーターで解析したろころ、1例目の患者由来の細胞(SNK-6)はCD3、CD19陰性、CD56陽性でありNK細胞由来と考えられた。SNK-6はEBV潜伏感染細胞であり、EBVの末端繰返し配列の解析より、モノクローナルな細胞であることが明らかとなった。また、2例目の患者由来の細胞(SNK-8)もモノクローナルなEBV潜伏感染細胞でありCD56陽性、CD19陰性だったが、SNK-6と相違してCD3が陽性でT細胞由来と考えられた。さらに詳しく解析したところ、SNK-8は細胞表面にγδ型T細胞リセプターを発現していることが明かとなり、γδ型T細胞由来と考えられた。またサザンブロット法によりT細胞リセプター再構成の有無を検討したところ、SNK-6は再構成が確認できなかったが、SNK-8はJ-δ3領域の再構成が認められた。
以上の結果より、SNK-6はNK細胞由来、SNK-8はγδ型T細胞由来のモノクローナルなEBV感染細胞と考えられた。細胞株を分離した2人の進行性鼻壊疽患者は臨床的、病理学的には差がなく、典型的な進行性鼻壊疽患者であった。したがって、本研究により少なくともNK細胞リンパ腫による進行性鼻壊疽とγδT細胞リンパ腫による進行性鼻壊疽の2種類が存在することが明かとなった。
従来より、進行性鼻壊疽を例外なくNKリンパ腫とする報告と例外なくγδT細胞リンパ腫とする報告があり対立点となっていたが、今回我々が得た結果より、臨床的、病理学的に進行性鼻壊疽として分類される病気にはNK細胞リンパ腫とγδT細胞リンパ腫の2種類が存在することが明かとなった。さらに、今回得られた細胞株はEBV陽性NK細胞としては3例目、EBV陽性γδT細胞としては初めて樹立された細胞株であり、NK細胞、γδT細胞とEBVの関連を研究する上で貴重な系となるだろう。
進行性鼻壊疽の病理組織標本を免疫染色するとCD3が検出されるため当初はT細胞リンパ腫であると考えられていた。しかし、免疫染色では細胞質CD3がNK細胞でも陽性となるため本来NKリンパ腫とすべきものが誤認されていた可能性が高く、さらにT細胞リセプターの再構成も検出できないためNKリンパ腫と考えるのが妥当とする研究者が増加している。
一方、検索したほとんどの症例でT細胞リセプターの再構成が確認できるためやはり進行性鼻壊疽はT細胞リンパ腫であるとの研究結果も報告されており、原因細胞の詳細については議論が続いていた。病変組織の壊死像が強いことと病変部から細胞株が樹立されていないことが研究を行うための障害となっており、病気の本態がいまだ確定していない要因となっている。したがって、病変部から細胞株を樹立しその細胞を詳しく解析することが可能になれば進行性鼻壊疽の本態に関する研究は大きく進展するものと考えられる。
過去、病変部から細胞株を樹立する試みが行われていたが成功例の報告はなかった。その理由として、壊死性の病変部から微生物を繁殖させることなく細胞を培養することが難しいことと、NK細胞由来細胞株の報告はこれまでごく少数であることから分かるようにNK細胞由来の細胞株を樹立すること自体が非常に難しいことがあげられる。我々は、最近、進行性鼻壊疽患者末梢血からEBV陽性細胞株を樹立することに成功した。今回この経験を踏まえ患者病変部から細胞株を樹立し、病気の本態解明の研究に供することを目的として研究を行った。
進行性鼻壊疽と診断された2人の患者から得た鼻腔病変部由来生検材料を細切後メッシュを通しリンパ性細胞を採取した。得られた細胞を増殖培地(RPMI1640培地+10%ヒト血清+700U/ml IL-2 )中で培養したところ、いずれの場合もリンパ系細胞の急速な増殖が認められた。増殖した細胞の表面抗原を染色後フローサイトメーターで解析したろころ、1例目の患者由来の細胞(SNK-6)はCD3、CD19陰性、CD56陽性でありNK細胞由来と考えられた。SNK-6はEBV潜伏感染細胞であり、EBVの末端繰返し配列の解析より、モノクローナルな細胞であることが明らかとなった。また、2例目の患者由来の細胞(SNK-8)もモノクローナルなEBV潜伏感染細胞でありCD56陽性、CD19陰性だったが、SNK-6と相違してCD3が陽性でT細胞由来と考えられた。さらに詳しく解析したところ、SNK-8は細胞表面にγδ型T細胞リセプターを発現していることが明かとなり、γδ型T細胞由来と考えられた。またサザンブロット法によりT細胞リセプター再構成の有無を検討したところ、SNK-6は再構成が確認できなかったが、SNK-8はJ-δ3領域の再構成が認められた。
以上の結果より、SNK-6はNK細胞由来、SNK-8はγδ型T細胞由来のモノクローナルなEBV感染細胞と考えられた。細胞株を分離した2人の進行性鼻壊疽患者は臨床的、病理学的には差がなく、典型的な進行性鼻壊疽患者であった。したがって、本研究により少なくともNK細胞リンパ腫による進行性鼻壊疽とγδT細胞リンパ腫による進行性鼻壊疽の2種類が存在することが明かとなった。
従来より、進行性鼻壊疽を例外なくNKリンパ腫とする報告と例外なくγδT細胞リンパ腫とする報告があり対立点となっていたが、今回我々が得た結果より、臨床的、病理学的に進行性鼻壊疽として分類される病気にはNK細胞リンパ腫とγδT細胞リンパ腫の2種類が存在することが明かとなった。さらに、今回得られた細胞株はEBV陽性NK細胞としては3例目、EBV陽性γδT細胞としては初めて樹立された細胞株であり、NK細胞、γδT細胞とEBVの関連を研究する上で貴重な系となるだろう。
EBV陽性鼻性T/NK リンパ腫の発生・再発のメカニズム解析
我々は、鼻性T/NKリンパ腫症例より採取した腫瘍細胞を長期培養する技術を確立し、詳細な解析を可能とした。
今回、臨床的に再発と考えられた鼻性T/NKリンパ腫2症例(症例1:44歳男性、症例2:48歳女性)を経験した。それらの症例の初発、再発時に採取した腫瘍細胞を培養により純化し、解析することによりリンパ腫発生、再発のメカニズムを検討した。
患者の腫瘍部、末梢血より腫瘍細胞を採取、長期培養し、細胞表面抗原、染色体、T細胞受容体(TCR)の再構成、感染EBVのクローナリティーを解析した。その結果、初発・再発ともに症例1はNK細胞、症例2はγδT細胞由来の腫瘍であった。何れの症例も再発時に認められた腫瘍細胞の染色体異常の数が初発時より少なく、また症例2では初発と再発の腫瘍細胞のTCR再構成パターンが異なっていた。これらの結果より、再発時の腫瘍細胞は、治療効果が及ばずに残存した初発時の腫瘍細胞より時系列的に生じたものではなく、独立に発生した可能性が示唆された。しかし、初発・再発時で腫瘍細胞に感染しているEBVのクローナリティーは同一であったため、腫瘍発生の源には、治療抵抗性のEBV感染不死化NKあるいはγδT細胞が存在し、再発の温床となっている可能性が示唆された。
本検討より、鼻性T/NKリンパ腫の治療には、このような細胞を標的とした治療法を組み合わせることが必要と考えられた。
今回、臨床的に再発と考えられた鼻性T/NKリンパ腫2症例(症例1:44歳男性、症例2:48歳女性)を経験した。それらの症例の初発、再発時に採取した腫瘍細胞を培養により純化し、解析することによりリンパ腫発生、再発のメカニズムを検討した。
患者の腫瘍部、末梢血より腫瘍細胞を採取、長期培養し、細胞表面抗原、染色体、T細胞受容体(TCR)の再構成、感染EBVのクローナリティーを解析した。その結果、初発・再発ともに症例1はNK細胞、症例2はγδT細胞由来の腫瘍であった。何れの症例も再発時に認められた腫瘍細胞の染色体異常の数が初発時より少なく、また症例2では初発と再発の腫瘍細胞のTCR再構成パターンが異なっていた。これらの結果より、再発時の腫瘍細胞は、治療効果が及ばずに残存した初発時の腫瘍細胞より時系列的に生じたものではなく、独立に発生した可能性が示唆された。しかし、初発・再発時で腫瘍細胞に感染しているEBVのクローナリティーは同一であったため、腫瘍発生の源には、治療抵抗性のEBV感染不死化NKあるいはγδT細胞が存在し、再発の温床となっている可能性が示唆された。
本検討より、鼻性T/NKリンパ腫の治療には、このような細胞を標的とした治療法を組み合わせることが必要と考えられた。
EBV陽性gdT細胞株の解析
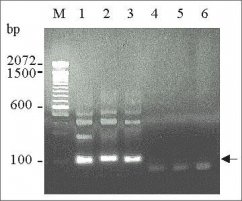
近年、EBVはバーキットリンパ腫、ホジキン病、鼻性T/NKリンパ腫、そして慢性活動性EBV感染症などさまざまなリンパ増殖性疾患の発生に強く関与していると考えられている。しかし、EBVのT/NK細胞への感染機構やそれらの疾病におけるEBVの役割はほとんどわかっていない。本研究ではgdT細胞とEBVの相互作用を明かにすることを目的とし、EBV陽性gdT細胞の培養と解析を行った。EBV陽性gdT細胞株として、鼻性T/NKリンパ腫由来の細胞株SNT8(Blood,97:708-713, 2001)と新たに得た2種の慢性活動性EBV感染症(CAEBV)患者末梢血由来の細胞株、SNT13、SNT15を用いた。細胞表面抗原はフローサイトメーターにより解析した。T細胞リセプター(TCR)遺伝子再構成をPCRにより解析した。EBV陰性gdT細胞株としてMolt-14、Peer、Loucyを用いた。
3種のEBV陽性gdT細胞株において、EBVはTRの解析よりモノクローナルであった。TCRV領域の発現をフローサイトメトリーにより解析したところ、全てのEBV陽性gdT細胞株は抗Vg9および抗Vd2モノクローナル抗体に対して陽性であったが、EBV陰性gdT細胞株ではこれらのTCR発現は陰性だった。TCR遺伝子のPCRによる解析では、全てのSNT細胞株においてVd2-Jd3の再構成を示した。
3種のEBV陽性gdT細胞株において、EBVはTRの解析よりモノクローナルであった。TCRV領域の発現をフローサイトメトリーにより解析したところ、全てのEBV陽性gdT細胞株は抗Vg9および抗Vd2モノクローナル抗体に対して陽性であったが、EBV陰性gdT細胞株ではこれらのTCR発現は陰性だった。TCR遺伝子のPCRによる解析では、全てのSNT細胞株においてVd2-Jd3の再構成を示した。
これらの結果より、EBV陽性gdT細胞のTCR発現パターンとTCR遺伝子再構成パターンには高い共通性があることが示唆された。この共通性はEBV陽性gdT細胞に特有で、EBV陰性gdT細胞には全く認められなかった。現在TCR遺伝子の再構成パターンをサザンブロッティングによる詳細な解析を行っている

