「免疫グロブリンAの欠損により回腸特異的に炎症が自然発症することを発見」【安達貴弘 准教授、永石宇司 准教授】
「免疫グロブリンAの欠損により回腸特異的に炎症が自然発症することを発見」
― 炎症性腸疾患の病因・病態解明や治療法開発に期待 ―
― 炎症性腸疾患の病因・病態解明や治療法開発に期待 ―

ポイント
・小腸粘膜の恒常性維持にIgAが実際に必要であるなど、これまで明確でなかったその臨床的重要性が初めて証明されました。
・IgAの欠損によって小腸の細菌叢が歪む結果、回腸に限定された炎症が起こること、またIgAがクローン病の新たな治療標的になり得ることを見出しました。
・本研究において回腸炎モデルが開発されたことで、これまで限界があった小腸粘膜の免疫制御機構の研究に新たな道が切り拓かれました。
・本研究で確立された解析法、動物モデルや見出された上記の事実は、炎症性腸疾患の病態解明や新規診断・治療法開発に大きく貢献すると期待されます。
東京医科歯科大学難治疾患研究所未病制御学の安達貴弘准教授と同大学院医歯学総合研究科消化管先端治療学講座の永石宇司准教授の研究グループは、高等研究院の渡辺守特別栄誉教授、烏山一特別栄誉教授、東京医科歯科大学難治疾患研究所分子神経科学分野およびエピジェネティクス分野、同大学院医歯学総合研究科免疫アレルギー学分野、東京大学、独立行政法人製品評価技術基盤機構(NITE)、イチビキ株式会社、ハーバード大学との共同研究で、免疫グロブリンA(IgA)の変異マウスを作製し、IgA欠損により回腸炎が自然発症することをつきとめました。この研究は文部科学省科学研究費補助金ならびに厚生労働科学研究特定疾患対策研究事業「難治性炎症性腸管障害に関する調査研究」班、難治疾患研究所共同研究拠点共同研究、土田直樹研究助成、ニッポンハム食の未来財団などの支援のもとでおこなわれたもので、その研究成果は、国際科学誌Gut(ガット)に、2021年5月7日にオンライン版で発表されました。
・IgAの欠損によって小腸の細菌叢が歪む結果、回腸に限定された炎症が起こること、またIgAがクローン病の新たな治療標的になり得ることを見出しました。
・本研究において回腸炎モデルが開発されたことで、これまで限界があった小腸粘膜の免疫制御機構の研究に新たな道が切り拓かれました。
・本研究で確立された解析法、動物モデルや見出された上記の事実は、炎症性腸疾患の病態解明や新規診断・治療法開発に大きく貢献すると期待されます。
東京医科歯科大学難治疾患研究所未病制御学の安達貴弘准教授と同大学院医歯学総合研究科消化管先端治療学講座の永石宇司准教授の研究グループは、高等研究院の渡辺守特別栄誉教授、烏山一特別栄誉教授、東京医科歯科大学難治疾患研究所分子神経科学分野およびエピジェネティクス分野、同大学院医歯学総合研究科免疫アレルギー学分野、東京大学、独立行政法人製品評価技術基盤機構(NITE)、イチビキ株式会社、ハーバード大学との共同研究で、免疫グロブリンA(IgA)の変異マウスを作製し、IgA欠損により回腸炎が自然発症することをつきとめました。この研究は文部科学省科学研究費補助金ならびに厚生労働科学研究特定疾患対策研究事業「難治性炎症性腸管障害に関する調査研究」班、難治疾患研究所共同研究拠点共同研究、土田直樹研究助成、ニッポンハム食の未来財団などの支援のもとでおこなわれたもので、その研究成果は、国際科学誌Gut(ガット)に、2021年5月7日にオンライン版で発表されました。
研究の背景
炎症性腸疾患(IBD)※1は本邦をはじめ世界中で患者数が急増しており、若年者に多く発症すること、再燃寛解を繰り返すこと、生涯に亘ってステロイドや免疫調節薬、あるいは生物学的製剤など高額な治療を余儀なくされること、発がんのリスクが高まることなどから、社会的あるいは医療経済的にも問題となっています。そのためIBDは厚生労働省によって難病に指定されており、その病態解明や新規治療法の開発は急務となっています。なかでもIBDの1つであるクローン病※2は全消化管に発症し、とくに回腸※3をはじめとした小腸に好発することから、患者の日常生活に大きく影響します。しかし大腸炎の動物モデルはこれまで多く開発されてきたものの、小腸炎のモデルは皆無に等しく、また小腸粘膜における免疫応答メカニズムの詳細も未だベールに隠されているため、クローン病の研究は現在も大きく停滞しています。
一方、免疫グロブリンA(IgA)※4は生体内で最も多く産生される抗体であり、腸管粘液、唾液、涙、乳汁などに分泌されています。なかでも腸管では最も多く発現し、粘膜の最前線で微生物と対峙する粘膜バリアの構成要素の1つであることが知られています。ヒトの免疫不全症としてはこのIgAの欠損症が最も頻度の高い疾患で、アレルギー、自己免疫疾患、自閉症との相関も指摘されていますが、無症状の人が比較的多いという報告もあり、生体内におけるその重要性はこれまで明らかになっていません。また腸管のIgAは病原微生物の排除に重要であることが知られており、IBDにおいても指摘されておりますが、健常者にも共生している腸内細菌叢との関連については、これまで詳細が知られていませんでした。
一方、免疫グロブリンA(IgA)※4は生体内で最も多く産生される抗体であり、腸管粘液、唾液、涙、乳汁などに分泌されています。なかでも腸管では最も多く発現し、粘膜の最前線で微生物と対峙する粘膜バリアの構成要素の1つであることが知られています。ヒトの免疫不全症としてはこのIgAの欠損症が最も頻度の高い疾患で、アレルギー、自己免疫疾患、自閉症との相関も指摘されていますが、無症状の人が比較的多いという報告もあり、生体内におけるその重要性はこれまで明らかになっていません。また腸管のIgAは病原微生物の排除に重要であることが知られており、IBDにおいても指摘されておりますが、健常者にも共生している腸内細菌叢との関連については、これまで詳細が知られていませんでした。
研究成果の概要
IgAは腸管粘膜の最前線におけるバリア機構の構成要素の1つであるといわれるものの、それが実際に生体内でどれほど重要であるのか、とくに普段から我々と共生している腸内細菌に対する影響に関しては、これまでその意義や機能が明確ではありませんでした。そこで研究グループは腸管粘膜の恒常性※5維持におけるIgAの影響を解明することを目的として、CRISPR/Cas9ゲノム編集技術を応用してIgA遺伝子座の様々な変異マウスを複数系統(種類)作製し、これらの中からIgAの細胞内領域の遺伝子部位に欠失を持つマウス(IgAtm/tm)とIgHa鎖の全定常領域を欠いたIgA欠損マウス(IgA-/-)の2系統について解析を進めました。
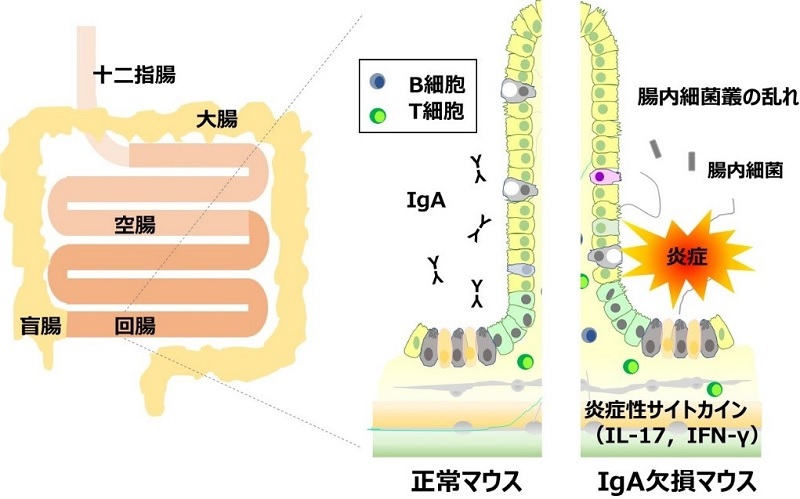
図1. IgA欠損による回腸での炎症誘発
小腸は十二指腸、空腸、および回腸で構成される(左)。IgAの欠損によってとくに回腸における腸内細菌叢の歪みが起き、それに応答して増殖したT細胞から炎症をさらに惹起するサイトカインが分泌され、回腸組織が損傷を受ける(右)。
小腸は十二指腸、空腸、および回腸で構成される(左)。IgAの欠損によってとくに回腸における腸内細菌叢の歪みが起き、それに応答して増殖したT細胞から炎症をさらに惹起するサイトカインが分泌され、回腸組織が損傷を受ける(右)。
とくに腸管粘膜の恒常性は果たして破綻しているのか否かに焦点が当てられ、全消化管の病理組織学的な解析、腸内細菌叢や粘膜内の免疫細胞(リンパ球※6)の解析、またそれらリンパ球のサイトカイン※7産生および活性度が評価されました。その結果、病理解析では消化管のほとんどの部位で正常マウスとIgA欠損マウスに差がみられなかったものの、IgA欠損マウスの回腸粘膜では週齢が若い段階から炎症が自然に誘発されていることが見出されました。大腸や空腸に比べてこの回腸では、セグメント細菌の増加をはじめ腸内細菌叢の組成が最も歪んでおり、ヒトの自閉症との相関が指摘される腸内細菌も増加していました(近年、血清中のIgAの濃度は自閉症とも関連すると報告されています)。回腸の粘膜内ではCD4+ T細胞※8が有意に増加しており、インターフェロン-gおよびインターロイキン-17といった炎症を惹起するサイトカインの産生が亢進していました(図1を参照)。 さらに安達准教授によって独自に構築された細胞内Ca2+シグナリングを可視化できるCa2+バイオセンサーYellow Cameleon3.60 (YC3.60) ※9を用いた生体内イメージング解析では、IgA-/-マウスの小腸粘膜内パイエル板※10のB細胞※11におけるCa2+濃度が亢進していることが観察され、このことから回腸粘膜における細胞レベルの免疫反応が増強していることが示唆されました(図2)。一方、IgAtm/tmマウスはいずれの解析でもほぼ正常であったことから、IgGやIgEでは細胞内領域の重要性が明らかになっておりましたが、IgAのその配列はIgAの機能に必ずしも重要ではないと考えられました。
以上の知見から、病原微生物ばかりでなく腸内細菌叢の制御にもIgAは深く関わり、とくに回腸粘膜における免疫恒常性の維持に重要な役割を果たしていたことが明らかにされました。
以上の知見から、病原微生物ばかりでなく腸内細菌叢の制御にもIgAは深く関わり、とくに回腸粘膜における免疫恒常性の維持に重要な役割を果たしていたことが明らかにされました。
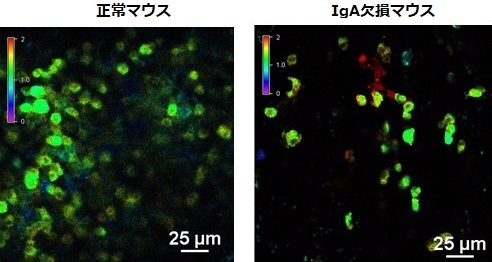
図2. IgA欠損マウスの回腸パイエル板におけるB細胞の活性化
細胞内のCa2+濃度に応じて蛍光の変化するCa2+) バイオセンサーYC3.60を発現するマウスの生体イメージングにより、細胞内のCa2+濃度を可視化した。回腸にあるパイエル板を観察すると、正常マウス(左)に比べIgA欠損マウス(右)では過剰な活性化とともに細胞内Ca2+濃度が上昇したB細胞(赤色)が増加している。
細胞内のCa2+濃度に応じて蛍光の変化するCa2+) バイオセンサーYC3.60を発現するマウスの生体イメージングにより、細胞内のCa2+濃度を可視化した。回腸にあるパイエル板を観察すると、正常マウス(左)に比べIgA欠損マウス(右)では過剰な活性化とともに細胞内Ca2+濃度が上昇したB細胞(赤色)が増加している。
研究成果の意義
ヒトのIgA欠損症の病態は不明な点が多く、その臨床的な重要性はこれまで明確でありませんでした。しかし本研究で樹立された動物モデルの解析を通じて、小腸粘膜の恒常性維持においてIgAに重要な働きがあり、その欠損によって回腸に限定された炎症が実際に誘導されることが世界に先駆けて明らかにされました。この事実は、IgAの欠損がクローン病をはじめとするIBDのリスク要因になり得ること、そして新規の治療標的になり得ることを示唆しています。
また本研究では、これまでほぼ皆無であった小腸炎(回腸炎)のモデルが確立されたこと自体にも免疫学的、そして消化器病学的に大きな意義があります。すなわち第一に、これまで腸管粘膜における免疫応答の解析は大腸に限定されていましたが、本研究で確立された解析手段や回腸炎モデルを通じて、今後は小腸独特の免疫反応を詳細に解析することが可能となったことにあります。そして第二に、これまで難解であったクローン病をはじめとするIBDの病態解析が本研究成果によって今後は飛躍的に発展し、新規の診断・治療法の開発に大きく貢献できることが期待されます。
さらに本研究における腸内細菌叢の解析結果はIBDにとどまらず、アレルギー、自己免疫疾患、自閉症などのIgA関連疾患の病因・病態解明の糸口ともなることが期待されます。
また本研究では、これまでほぼ皆無であった小腸炎(回腸炎)のモデルが確立されたこと自体にも免疫学的、そして消化器病学的に大きな意義があります。すなわち第一に、これまで腸管粘膜における免疫応答の解析は大腸に限定されていましたが、本研究で確立された解析手段や回腸炎モデルを通じて、今後は小腸独特の免疫反応を詳細に解析することが可能となったことにあります。そして第二に、これまで難解であったクローン病をはじめとするIBDの病態解析が本研究成果によって今後は飛躍的に発展し、新規の診断・治療法の開発に大きく貢献できることが期待されます。
さらに本研究における腸内細菌叢の解析結果はIBDにとどまらず、アレルギー、自己免疫疾患、自閉症などのIgA関連疾患の病因・病態解明の糸口ともなることが期待されます。
用語解説
※1炎症性腸疾患 (IBD)
狭義はクローン病と潰瘍性大腸炎の2疾患の総称。両者とも特異な病原体によるものではなく、腸内細菌や食餌由来の抗原に対し過剰な免疫反応が誘導されて発症すると考えられている。
※2クローン病
IBDの1疾患。全消化管に発症し得るが、小腸、とくに回腸末端部に好発する。
※3回腸
小腸のうちの肛門側の部位。小腸は胃から続く十二指腸、空腸、そして回腸の3部で構成され、回腸の末端部から回盲弁を経て大腸につながる。
※4免疫グロブリンA (IgA)
免疫グロブリンの1つのクラス。生体内で生産される最も多い免疫グロブリンであり、腸管粘液、唾液、乳汁、涙などに分泌され、生体のバリア機能の一端を担っている。
※5恒常性
内部や外部の環境因子の変化にかかわらず、生物の生理状態が一定に保たれるよう調節される性質や状態。
※6リンパ球
おもにリンパ組織や末梢血、末梢臓器などに存在する白血球の1種。リンパ組織ではT細胞とB細胞がその構成細胞の大半を占める。
※7サイトカイン
おもにリンパ球などの免疫細胞より分泌され、それら自身や上皮細胞など他種の細胞の生理機能に働く液性因子の総称。
※8 T細胞
胸腺で成熟するリンパ球の1種。細胞表面に抗原特異的な受容体を持ち、他の細胞と協調して獲得免疫応答を活性化あるいは制御する。ウイルスに感染した細胞などを攻撃する細胞傷害性のCD8陽性T細胞やサイトカインの産生が主な機能であるCD4陽性T細胞などがある。
※9 Ca2+バイオセンサーYellow Cameleon3.60 (YC3.60)
黄色蛍光タンパク質(YFP)とシアン蛍光タンパク質(CFP)の間にカルモジュリンのCa2+結合部位とミオシン軽鎖キナーゼのM13ペプチドを一分子内に持ち、Ca2+の結合に依存して構造変化し、CFPとYFPが隣接することによりCFPからYFPへのエネルギー移動(FRET)が起こり、蛍光がシアンから黄色に変化する。この蛍光色の変化を測定することにより細胞内Ca2+濃度の変化をモニターすることができるタンパク質性の蛍光プローブ。
※10 パイエル板
小腸粘膜内に散在する腸管粘膜関連リンパ組織の1つ。リンパ節に類似したT細胞領域とB細胞領域からなる構造をもつ。主に腸内細菌、食物など消化管の免疫応答の制御に関わっている。
※11 B細胞
骨髄内で成熟するリンパ球の1種。体液性免疫において重要な役割を担い、抗原特異的な抗体を産生する細胞に分化する。
狭義はクローン病と潰瘍性大腸炎の2疾患の総称。両者とも特異な病原体によるものではなく、腸内細菌や食餌由来の抗原に対し過剰な免疫反応が誘導されて発症すると考えられている。
※2クローン病
IBDの1疾患。全消化管に発症し得るが、小腸、とくに回腸末端部に好発する。
※3回腸
小腸のうちの肛門側の部位。小腸は胃から続く十二指腸、空腸、そして回腸の3部で構成され、回腸の末端部から回盲弁を経て大腸につながる。
※4免疫グロブリンA (IgA)
免疫グロブリンの1つのクラス。生体内で生産される最も多い免疫グロブリンであり、腸管粘液、唾液、乳汁、涙などに分泌され、生体のバリア機能の一端を担っている。
※5恒常性
内部や外部の環境因子の変化にかかわらず、生物の生理状態が一定に保たれるよう調節される性質や状態。
※6リンパ球
おもにリンパ組織や末梢血、末梢臓器などに存在する白血球の1種。リンパ組織ではT細胞とB細胞がその構成細胞の大半を占める。
※7サイトカイン
おもにリンパ球などの免疫細胞より分泌され、それら自身や上皮細胞など他種の細胞の生理機能に働く液性因子の総称。
※8 T細胞
胸腺で成熟するリンパ球の1種。細胞表面に抗原特異的な受容体を持ち、他の細胞と協調して獲得免疫応答を活性化あるいは制御する。ウイルスに感染した細胞などを攻撃する細胞傷害性のCD8陽性T細胞やサイトカインの産生が主な機能であるCD4陽性T細胞などがある。
※9 Ca2+バイオセンサーYellow Cameleon3.60 (YC3.60)
黄色蛍光タンパク質(YFP)とシアン蛍光タンパク質(CFP)の間にカルモジュリンのCa2+結合部位とミオシン軽鎖キナーゼのM13ペプチドを一分子内に持ち、Ca2+の結合に依存して構造変化し、CFPとYFPが隣接することによりCFPからYFPへのエネルギー移動(FRET)が起こり、蛍光がシアンから黄色に変化する。この蛍光色の変化を測定することにより細胞内Ca2+濃度の変化をモニターすることができるタンパク質性の蛍光プローブ。
※10 パイエル板
小腸粘膜内に散在する腸管粘膜関連リンパ組織の1つ。リンパ節に類似したT細胞領域とB細胞領域からなる構造をもつ。主に腸内細菌、食物など消化管の免疫応答の制御に関わっている。
※11 B細胞
骨髄内で成熟するリンパ球の1種。体液性免疫において重要な役割を担い、抗原特異的な抗体を産生する細胞に分化する。
論文情報
掲載誌:Gut
論文タイトル:Immunoglobulin A-specific deficiency induces spontaneous inflammation specifically in the ileum
DOI:http://dx.doi.org/10.1136/gutjnl-2020-322873
論文タイトル:Immunoglobulin A-specific deficiency induces spontaneous inflammation specifically in the ileum
DOI:http://dx.doi.org/10.1136/gutjnl-2020-322873
研究者プロフィール

安達 貴弘 (アダチ タカヒロ) Takahiro Adachi
東京医科歯科大学 難治疾患研究所
未病制御学 准教授
・研究領域
・免疫学、食品免疫学、ロバストネス
東京医科歯科大学 難治疾患研究所
未病制御学 准教授
・研究領域
・免疫学、食品免疫学、ロバストネス

永石 宇司 (ナガイシ タカシ) Takashi Nagaishi
東京医科歯科大学 大学院医歯学総合研究科
消化管先端治療学 准教授
・研究領域
消化器病学、炎症性腸疾患、粘膜免疫学
東京医科歯科大学 大学院医歯学総合研究科
消化管先端治療学 准教授
・研究領域
消化器病学、炎症性腸疾患、粘膜免疫学

渡辺 守 (ワタナベ マモル) Mamoru Watanabe
東京医科歯科大学 副学長
高等研究院 特別栄誉教授
・研究領域
消化器病学、炎症性腸疾患
東京医科歯科大学 副学長
高等研究院 特別栄誉教授
・研究領域
消化器病学、炎症性腸疾患
問い合わせ先
<研究に関すること>
東京医科歯科大学難治疾患研究所
未病制御学 安達 貴弘(アダチ タカヒロ)
TEL:03-5280-8070 FAX:03-5280-8070
E-mail:tadachi.imm@mri.tmd.ac.jp
東京医科歯科大学大学院医歯学総合研究科
消化管先端治療学 永石 宇司 (ナガイシ タカシ)
TEL:03-5803- 5877 FAX:03-5803- 0268
E-mail:tnagaishi.gast@ tmd.ac.jp
<報道に関すること>
東京医科歯科大学 総務部総務秘書課広報係
〒113-8510 東京都文京区湯島1-5-45
TEL:03-5803-5833 FAX:03-5803-0272
E-mail:kouhou.adm@tmd.ac.jp
東京医科歯科大学難治疾患研究所
未病制御学 安達 貴弘(アダチ タカヒロ)
TEL:03-5280-8070 FAX:03-5280-8070
E-mail:tadachi.imm@mri.tmd.ac.jp
東京医科歯科大学大学院医歯学総合研究科
消化管先端治療学 永石 宇司 (ナガイシ タカシ)
TEL:03-5803- 5877 FAX:03-5803- 0268
E-mail:tnagaishi.gast@ tmd.ac.jp
<報道に関すること>
東京医科歯科大学 総務部総務秘書課広報係
〒113-8510 東京都文京区湯島1-5-45
TEL:03-5803-5833 FAX:03-5803-0272
E-mail:kouhou.adm@tmd.ac.jp

