東京医科歯科大学は、2024年10月に東京工業大学と統合し、東京科学大学(Science Tokyo)となりました。本サイトの情報は、順次、Science Tokyoのサイトに移行していきます。公開されているページは東京科学大学の情報として有効なものです。
「FGF18がマクロファージを介して骨修復を増強するメカニズムを発見」【井関祥子 教授】
「FGF18がマクロファージを介して骨修復を増強するメカニズムを発見」
― 骨欠損の治療への応用に期待 ―
ポイント
- FGF18※1のBMP2※2による骨修復促進作用が、M2マクロファージに依存することをつきとめました。
- FGF18は骨髄間質細胞に働きかけて、間接的にM2マクロファージを誘導することが分かりました。
- FGF18を用いた頭蓋骨欠損における新規治療法開発への応用が期待できます。
東京医科歯科大学 大学院医歯学総合研究科 分子発生学分野のNAMANGKALAKUL Worachat(ナマンカラクル ウォラチャット)大学院生(研究当時)、JIN Chengxue大学院生、吉本由紀講師、井関祥子教授らの研究グループは、分子免疫学分野の永井重徳准教授、分子細胞機能学分野の中濵健一准教授、分子情報伝達学分野の中島友紀教授、東京理科大学、京都大学、順天堂大学との共同研究で、FGF18の新たな機能として、間葉系細胞のケモカインCCL2産生を促してM2マクロファージを誘導することで、骨修復を促進することをつきとめました。この研究は文部科学省科学研究費補助金の支援のもとでおこなわれたもので、その研究成果は、国際科学誌Journal of Tissue Engineeringに、2023年7月26日にオンライン版で発表されました。
研究の背景
WntやNotchを初めとし、線維芽細胞増殖因子(FGF)や骨形成タンパク質(BMP)は、骨の発生やリモデリング、骨修復の過程で協調して機能します。特にBMP2は米国などで骨修復のためのゴールドスタンダードとされ、骨修復や骨増生における骨誘導因子として欠かせません。しかし、BMP2だけで治療するには高容量を必要とし、また術後炎症などの副作用を引き起こす心配があるため、他の因子を組み合わせるなどの必要性が考えられます。その候補として、FGFファミリーに属し、骨形成の正の制御因子として同定されたFGF18があります。研究グループはこれまでに、FGF18がBMP2の骨修復作用を増強することを示しましたが(Biomaterials 2012)、その詳細なメカニズムは、未だにわかっていませんでした。
近年、炎症およびマクロファージ活性化の制御におけるFGFシグナル伝達経路の関与が明らかになりつつあります。マクロファージは、病原体を駆除し、組織の治癒を促進するために炎症の様々な局面に関与する免疫細胞です。さらには、骨を含む多くの組織において、組織修復、組織再生、恒常性の維持、免疫監視にもかかわっています。マクロファージには、極性を持たないM0マクロファージのほか、機能面から大きくM1マクロファージとM2マクロファージに大別されますが、特にM2マクロファージは炎症反応を抑える以外に、治癒を促進したり、修復を促したりする性質があることから、FGF18の骨修復作用がM2マクロファージを介する可能性があると考えました。
研究成果の概要
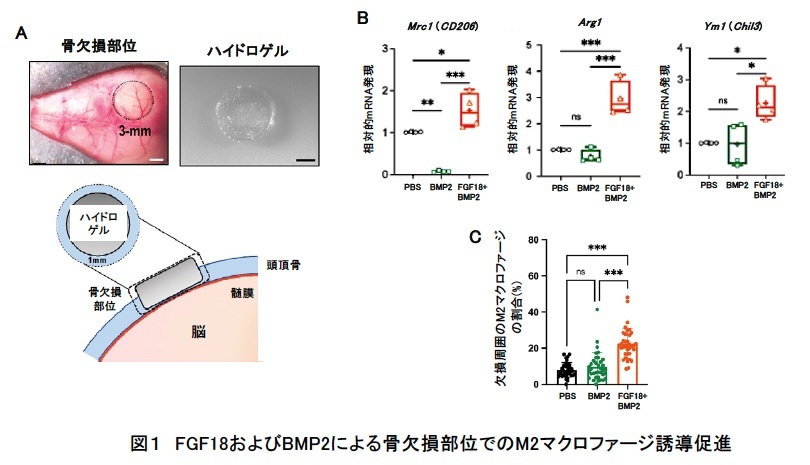
臨界サイズのマウス頭蓋冠欠損モデルで、BMP2依存性の骨修復において、FGF18がBMP2の機能を増強するかを調べるため、これらの因子を含んだコレステリル基とアクリロイル基を有するプルラン(CHPOA)ナノ架橋(NanoClik)ハイドロゲル※3を4週齢のマウスの骨欠損部に埋め込みました(図1A)。手術5日後に欠損部の骨縁と硬膜を回収して遺伝子発現を調べたところ、M2マクロファージ関連遺伝子(CD206,Arg1,Ym1など)の発現が、FGF18+BMP2群のみで上昇していました(図1B)。実際に、術後7日目の組織において、FGF18+BMP2群でM2マクロファージの浸潤が、他の群に比べて有意に増加していました(図1C)。
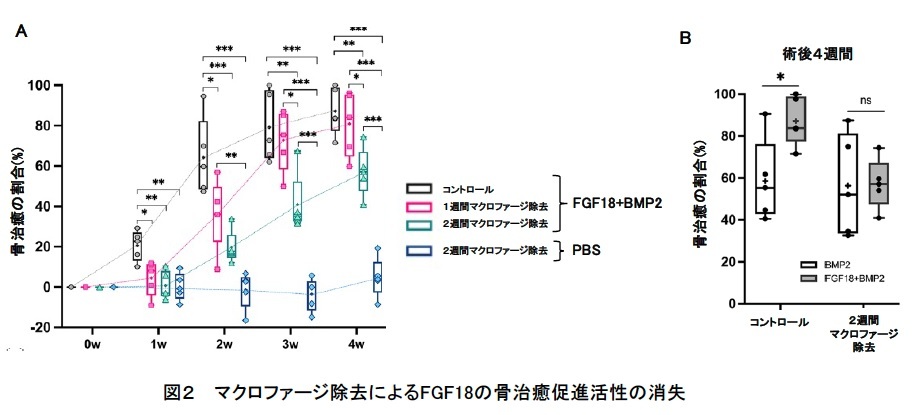
次に、本当にマクロファージが関与しているかを確かめるために、クロドロン酸リポソーム※4を投与して、1週間あるいは2週間マウス体内のマクロファージを除去し、頭蓋冠欠損モデルで骨修復の度合いを比較したところ、マクロファージ除去期間が長いほど、FGF18+BMP2群での骨修復が抑制されました(図2A)。また、術後4週間後において、BMP2群とFGF18+BMP2群の差がなくなったことから(図2B)、FGF18による骨修復には、M2マクロファージが関与している可能性が示されました。
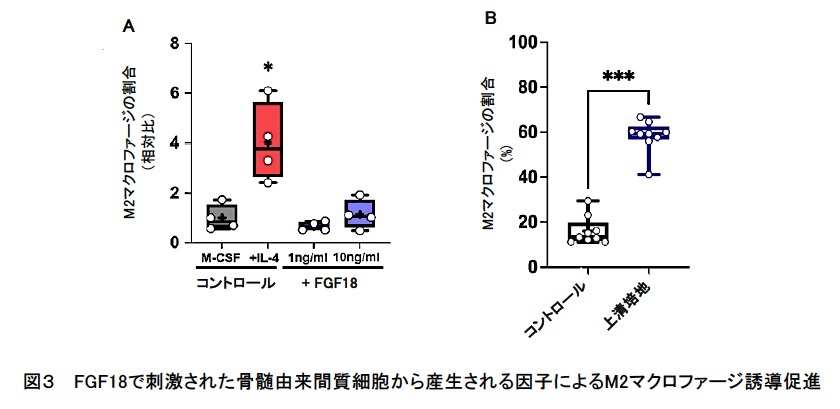
そこで、M2マクロファージ誘導へのFGF18の関与について骨髄細胞を用いて検討しました。骨髄細胞は、白血球(免疫系細胞)とそれらを支持する間葉系の骨髄間質細胞 (bone marrow stroma cell; BMSC) から構成されます。マウス骨髄細胞を取り出し、免疫系細胞を分離してM-CSF含有培地で7日間培養すると、マクロファージの元となる細胞(前駆細胞)からM0マクロファージに分化しますが、この時IL-4を添加すると極性が変化してM2マクロファージが誘導されます。そこでIL-4の代わりにFGF18を添加しましたが、M2マクロファージは誘導されず、FGF18は直接M2マクロファージを誘導しないことがわかりました(図3A)。一方、取り出した骨髄細胞を、FGF18を添加して培養するとM2マクロファージが誘導されました。そこで、骨髄細胞からBMSCを分離して、FGF18を添加して72時間培養し、上清培地 (BM-CM) を得ました。このBM-CMでM0マクロファージを培養したところ、M2マクロファージ関連遺伝子発現の上昇とともに、M2マクロファージが誘導されました(図3B)。すなわち、FGF18がBMSCに作用して発現する因子が、間接的にM2マクロファージへの誘導を促進することがわかりました。
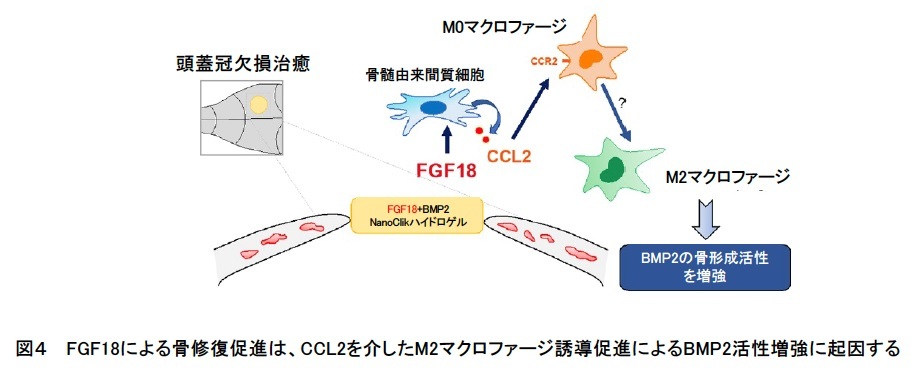
このBMSCから分泌される因子を同定するために、FGF18処理したBMSCからRNAを抽出して、マイクロアレイ法によって網羅的に遺伝子発現を解析し、発現上昇した遺伝子群から候補因子を探索しました。その中で、マクロファージの活性化や骨形成、骨修復時の炎症に関わるCCケモカインリガンド2 (CC chemokine ligand 2; CCL2) に着目しました。M0マクロファージの培養にCCL2を添加すると、M2マクロファージ関連遺伝子の発現が上昇しました。逆に、抗CCL2中和抗体で前処理してBM-CM中のCCL2の活性をなくすと、BM-CMによるM2マクロファージ関連遺伝子の発現が低下することから、CCL2がFGF18によるM2マクロファージ誘導に関与することが示されました。
最後に、骨修復にCCL2が実際に関わっているかをマウスで確かめるため、CCL2の受容体であるCCR2 (CC chemokine receptor 2; CCR2) を欠損するマウスで、頭蓋冠欠損修復実験を行いました。すると、FGF18+BMP2群において、野生型マウスに比べて治癒率が低かったことから、 FGF18による骨修復促進作用の一部は、CCL2/CCR2シグナルを介していることが示されました(図4)。
研究成果の意義
研究グループは、FGF18によるBMSCの刺激が、CCL2を含むケモカインの発現上昇を引き起こし、M2マクロファージへの誘導過程に寄与することを明らかにしました。FGF18添加による骨修復は、質と量ともにBMP2単独投与よりも利点があることが以前の研究で示されており、これがマクロファージ活性化の制御によるものであることが示唆されました。したがって、今回得られた知見は、骨組織工学においてFGF18の補助的利用の可能性を広げるものです。これは、頭蓋顔面骨欠損の治療として、臨床における新規戦略の開発に有望であると考えられます。
用語解説
※1Fibroblast Growth Factor 18 (FGF18)
線維芽細胞増殖因子(FGF)ファミリーに属し、骨や軟骨組織の発生・分化に関わる因子。
※2Bone Morphogenic Protein 2 (BMP2)
トランスフォーミング増殖因子ベータ(Transforming growth factor ß; TGFß)ファミリーに属し、骨形成誘導活性を有する骨形成因子。
※3ハイドロゲル
架橋結合された高分子による固体が水分を吸い込んで膨潤し、流動性がない形態(ゲル)となった物質の総称。
※4クロドロン酸リポソーム
骨粗しょう症の治療に用いられるクロドロン酸をリポソーム化した製剤で、主に動物モデルでのマクロファージ枯渇実験に用いられる。生体に投与するとマクロファージによって貪食され、細胞内のATP代謝を阻害してマクロファージの細胞死を誘導する。
論文情報
掲 載 誌:Journal of Tissue Engineering
研究者プロフィール
問い合わせ先
<研究に関すること>
東京医科歯科大学大学院医歯学総合研究科
分子発生学分野 井関 祥子(イセキ サチコ
E-mail:s.iseki.emb[@]tmd.ac.jp
<報道に関すること>
東京医科歯科大学 総務部総務秘書課広報係
〒113-8510 東京都文京区湯島1-5-45
E-mail:kouhou.adm[@]tmd.ac.jp
※E-mailは上記アドレス[@]の部分を@に変えてください。
関連リンク
プレス通知資料PDF
「FGF18がマクロファージを介して骨修復を増強するメカニズムを発見」