臨床検体中のコロナウイルスタンパク質を蛍光抗体で迅速定量することに成功
東京工業大学
東京医科歯科大学
蛍光抗体で迅速定量することに成功
-蛍光検出の速度向上法としても期待-
要点
- 新型コロナウイルス抗原に結合すると光る抗体断片Q-bodyを構築し、抗原の簡便な検出に成功
- 反応液に高分子を加えることで反応を加速し、検出感度が向上
- 臨床サンプル中の新型コロナウイルス検出が確認でき、感染の有無を判定
概要
これまで研究グループでは、抗体断片(用語3)に蛍光色素を化学修飾(用語4)したクエンチ抗体(Q-body)を構築してきた。Q-bodyは、励起光を照射したときの蛍光強度の変化を見ることで、ウイルスを構成する物質の有無や量を検出できる。
今回研究グループでは、まず新型コロナウイルスの構成成分のうちスパイク(S1)タンパク質を検出するQ-bodyを開発し、疑似ウイルス粒子の高感度検出に成功した。さらに、ヌクレオカプシド(N)タンパク質の検出においては、反応条件を最適化することで、東京医科歯科大学病院で採取した臨床サンプル中にある新型コロナウイルス検出ならびに感染有無を判定することに成功した。
また、反応液にポリエチレングリコールなどの高分子を適量添加することで、反応を加速し高感度化できることを明らかにした。
この方法を発展させれば、唾液や鼻咽喉ぬぐい液などから目的病原体を簡便迅速に定量検出でき、将来効果的な診断法につながると期待される。
これらの成果は、英国時間9月15日に科学誌「Scientific Reports(サイエンティフィックレポーツ)」、9月30日に英国化学誌「Analyst(アナリスト)」にオンライン掲載され、特に後者はHot Article(注目論文)と掲載号のBack Cover(裏表紙)に選ばれた。
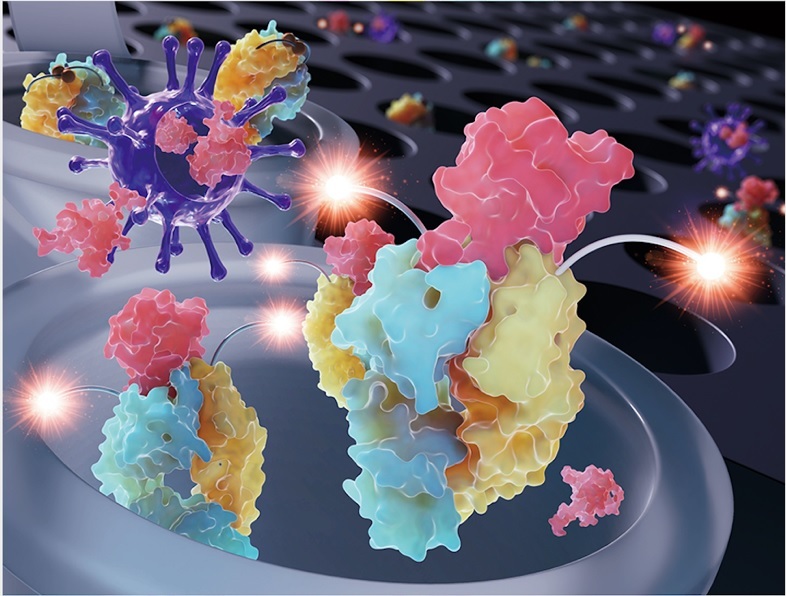
図1. Q-bodyによる新型コロナウィルスタンパク検出の模式図。
AnalystのBack Cover(裏表紙)に選出された。
背景
Q-bodyに結合している蛍光色素は、抗原となる物質が存在しない状態では、発光しない(消光:クエンチ)状態にある。これは、主に抗体内のアミノ酸残基からの光誘起電子移動(用語6)あるいは色素間相互作用(用語7)の作用によるものである。そこに抗原を加えると、抗原が抗体断片と結合し、それに伴い蛍光色素が抗体分子から脱離・放出される。それによって、蛍光色素が蛍光を呈するようになる。その蛍光強度を測定することで、さまざまな抗原の存在と濃度の判別が可能になる。例えばこれまでに、Q-bodyを用いることで、インフルエンザウイルスのHAタンパク質(用語8)やアミロイドβタンパク質などを、簡便に検出することに成功している。
本研究では、新型コロナウイルス抗原に対する抗体を用いて高感度なQ-bodyを構築した。そしてこれらをセンサーとして用いることで、現在最低15分程度かかる通常の抗原検査よりも迅速な抗原検査を開発し、より簡便な感染の判定に利用することを目指した。
研究の手法と成果
【①スパイク(S1)タンパク質を標的としたウイルス検出法の開発】
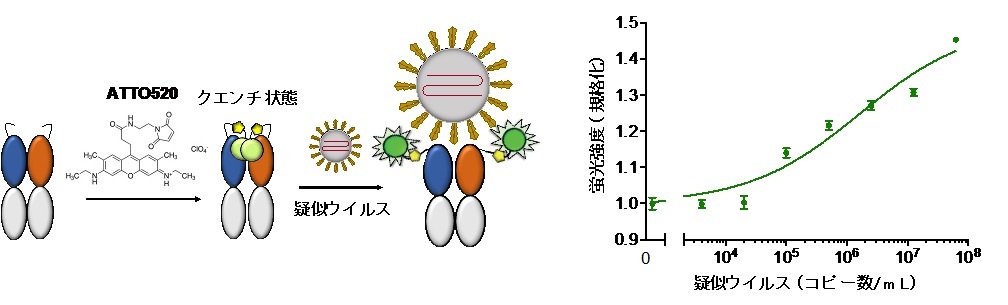
図2.(左)S1タンパク検出用Q-bodyの構築法と利用法。抗体A7のFab断片アミノ末端に付加した2箇所のシステイン残基にATTO520蛍光色素を反応させてQ-bodyとし、これに疑似新型コロナウィルス(Pseudovirus)を2分間反応させた。(右)左記Q-bodyによるPseudovirusの蛍光検出結果。
【②RNA結合(N)タンパク質を標的としたウイルス検出法の開発】
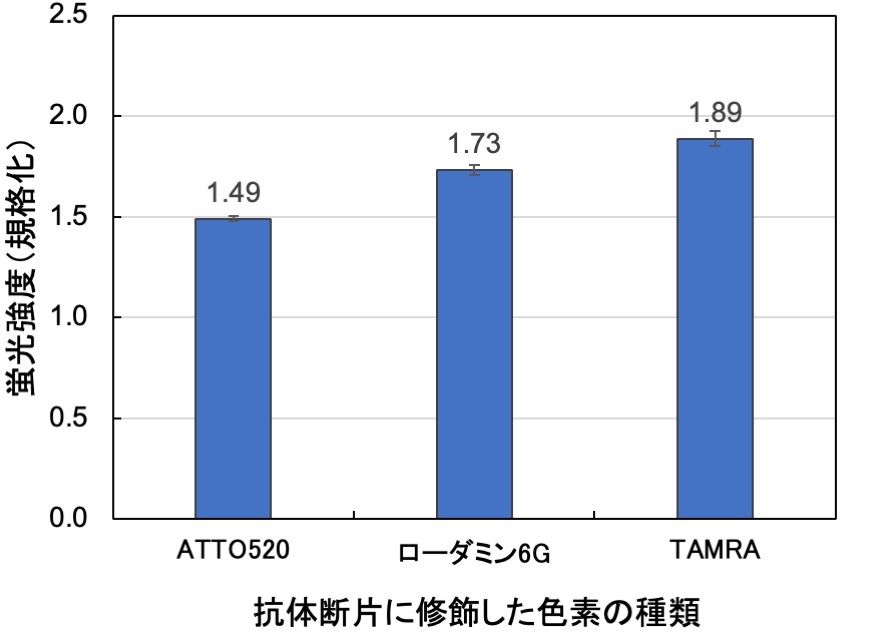
図3. 3種のNタンパク検出用Q-bodyの蛍光応答。ATTO520、ローダミン6G、TAMRAをそれぞれ2か所修飾したFab型Q-bodyに、50 nMのNタンパク質を加えた場合の混合直後の蛍光応答。
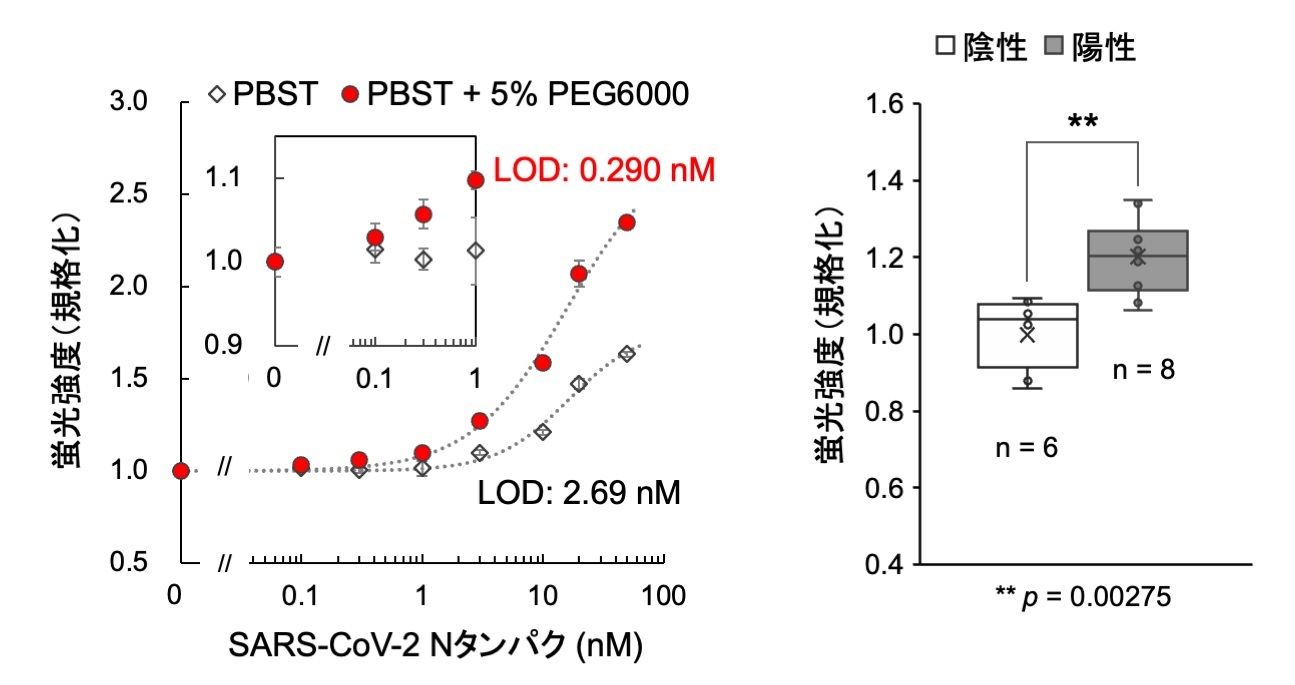
図4. (左)微量の界面活性剤(0.1% Tween20)を含むリン酸緩衝液(PBST)およびこれに5% ポリエチレングリコール6000(PEG6000)を加えてTAMRA修飾Q-bodyで抗原検出を行った場合の検量線。低濃度領域とその検出限界(LOD)を内側に示す。なお、反応時間は5分とした。(右)ポータブル蛍光測定装置を用いて行った、東京医科歯科大学病院での測定結果。99.7%以上の確度で陽性・陰性サンプルが判定できた。
社会的インパクト
今後の展開
付記
用語解説
-
(1)Q-body(Quench body、クエンチ抗体):抗体の断片を、部位特異的に蛍光色素で化学修飾した抗体。蛍光色素が抗体内のアミノ酸により消光(Quench)される現象を利用して、蛍光強度の変化によって抗原を検出できる。
-
(2)バイオセンサー:生体分子が持っている機能を、化学物質の存在や濃度を測定するために活用する化学センサー。
-
(3)抗体断片:通常抗体の、抗原結合部位を含む断片のこと。蛍光修飾のためのリンカーなどを加えたものを、遺伝子組換え法により大腸菌で発現させて比較的容易に構築することができる。
-
(4)化学修飾:生体高分子に含まれる、化合物の特性を決める特定原子団の性質を化学的に変化させ、反応などの機能を変化させること。
-
(5)抗原抗体反応:抗原と、その特定の抗原に対応する抗体が結合して起こるさまざまな現象。免疫反応やアレルギー反応、アナフィラキシー反応などがあたる。
-
(6)光誘起電子移動:光吸収によって励起状態となった蛍光団と、その近傍に存在する原子団(この場合Trp)との間に生じる電子移動。励起された電子は元の軌道に戻れず、蛍光団由来の蛍光がみられなくなる。
-
(7)色素間相互作用:ローダミン類などで複数の色素が近接すると、H-dimerと呼ばれる2量体構造を形成し、その蛍光がクエンチする現象。
-
(8)HAタンパク質:インフルエンザウイルスの主要構成タンパク質であり、感染に必要なヘムアグルチニン酵素。ウイルスの分類にも用いられる。
-
(9)ファージライブラリ : 多くの種類のヒト型抗体の遺伝子を内部に持ち,それがコードするタンパク質を外皮タンパク質に付加する形で発現するファージの集団。固定化抗原に結合するファージを選択することで,特異的抗体の遺伝子を得ることができる。今回は、2018年にタンパク質の分子進化技術開発でノーベル賞を受賞したGregory Winter博士グループ由来のものを使用した
論文情報
-
掲載誌:Scientific Reports 12, 15496 (2022)
-
論文タイトル:Isolation of a Human SARS-CoV-2 Neutralizing Antibody from a Synthetic Phage Library and its Conversion to Fluorescent Biosensors
-
著者:Haimei Li#, Bo Zhu#, Baowei Li, Limei Chen, Xuerao Ning, Hang Dong, Jingru Liang, Xueying Yang, Jinhua Dong* and Hiroshi Ueda* (#Equal contributions)
-
DOI:10.1038/s41598-022-19699-z
-
掲載誌:Analyst 147, 4971-4979 (2022)
-
論文タイトル:Rapid and sensitive SARS-CoV-2 detection using a homogeneous fluorescent immunosensor Quenchbody with crowding agents
-
著者:Bo Zhu#, Nobuyuki Nosaka#, Shuji Kanamaru, Jinhua Dong, Yancen Dai, Akihito Inoue, Yinghui Yang, Kaori Kobayashi, Tetsuya Kitaguchi, Hiroshi Iwasaki, Ryuji Koike, Kenji Wakabayashi and Hiroshi Ueda* (#Equal contributions)
-
DOI:10.1039/D2AN01051H
-
問い合わせ先
【研究に関するお問い合わせ】
東京工業大学 科学技術創成研究院 化学生命科学研究所 教授
上田 宏
Email: ueda[@]res.titech.ac.jp
【取材申し込み先】
東京工業大学 総務部 広報課
Email : media[@]jim.titech.ac.jp
東京医科歯科大学 総務部総務秘書課広報係
〒113-8510 東京都文京区湯島1-5-45
E-mail:kouhou.adm[@]tmd.ac.jp
※E-mailは上記アドレス[@]の部分を@に変えてください。

