「小頭症モデル動物の人為的脳サイズ回復に成功」【岡澤均 教授】

岡澤 均 (オカザワ ヒトシ)
難治疾患研究所 神経病理学分野 教授
脳統合機能研究センター長
― 小頭症・知的障害の遺伝子治療に道筋 ―
ポイント
| ● | 脳の大きさを調節する新しい分子メカニズムを解明しました。 |
| ● | PQBP1遺伝子異常症における小頭症の分子機序を明らかにしました。 |
| ● | 知的障害と小頭症の遺伝子治療の可能性を示しました。 |
私たちが進化の上で獲得した大きな脳は、ヒトがヒトたる上での基盤です。東京医科歯科大学・難治疾患研究所/脳統合機能研究センター・神経病理学分野の岡澤 均教授の研究グループは、マックスプランク研究所、ハーバード大学などとの国際共同研究で、脳サイズ縮小を来す遺伝性疾患(小頭症)の新規病態メカニズムを解明し、ウィルスベクターによる人為的な脳サイズ調節にも成功しました。この研究は文部科学省の新学術領域研究ならびに科学技術振興機構CRESTの支援のもと、また脳科学研究戦略推進プログラムの一環としておこなわれたもので、その研究成果は、国際科学誌Molecular Psychiatry(モレキュラー・サイキアトリー)に、2014年7月29日午前4時(米国東部夏時間)にオンライン版で発表されました。
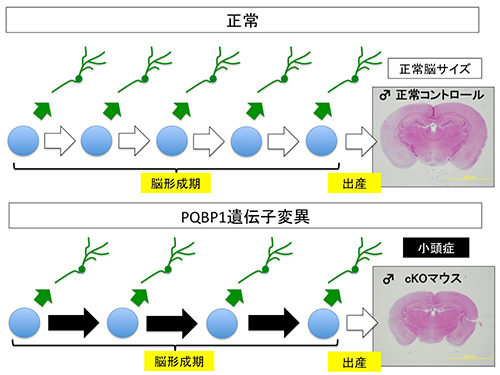
【図1】PQBP1遺伝子変異による小頭症のメカニズム
研究の背景
脳サイズは動物間あるいはヒト個人の間で異なりますが、知能、感情を初めとする様々な脳活動の違いを生み出す根本的な要素と考えられています。脳サイズ調節の分子メカニズムを解明する糸口として期待されて来たのが、小頭症と呼ばれる脳サイズの縮小を来す疾患です。近年、その原因遺伝子が相次いで明らかになりましたが、その一つにPQBP1があります。PQBP1は変性疾患ポリグルタミン病において中間病態を担うタンパクとして岡澤教授らが15年前に発見した分子ですが(Waragai et al., Hum Mol Genet 1999、Okazawa et al., Neuron 2002)、その後、欧米の大規模研究からPQBP1遺伝子変異がX染色体連鎖知的障害/精神遅滞家系(XLID/XLMR)で高頻度に見つかり、PQBP1が知的障害の主要な原因遺伝子であることが示されました(Kalscheuer et al., Nature Genetics 2003など)。細胞レベルの機能として、岡澤教授あるいはハーバード大学のSilver教授のグループは、PQBP1がRNAのスプライシングに関わることを報告してきましたが (BBRC 2000; Neuron 2002; Cell 2010; Genes Develp 2013; Nat Commun 2014)、小頭症あるいは知的障害が具体的にどのような病態メカニズムで生じるのか、またPQBP1異常症の治療をどのようにしたら良いかなど、重要な問題が残っていました。
研究成果の概要
これらの問題点に対して、今回の研究では、1)従来知られていなかった新たな脳サイズ調節機構、2)PQBP1異常症における小頭症の発症メカニズム、3)PQBP1異常症の遺伝子治療の道筋、を明らかにしました。
小頭症は従来、神経幹細胞の分化効率が上昇する(このために幹細胞が枯渇する)、神経幹細胞の細胞死が亢進する、分化ニューロンの細胞移動が障害されるという3つのメカニズムが重要な役割を果たすと考えられてきました。ところが、私たちの作成した神経幹細胞内のPQBP1を欠損するモデルマウス、PQBP1 Nestin-Cre-conditional KO(PQBP1-cKO)は、小頭症は再現するものの、これらの何れのメカニズムにも当てはまらず、その代わりに胎児の脳形成期における細胞周期時間が異常に延長していることが分かりました(図1)。この延長こそが神経幹細胞の分裂回数を減らし、結果としてニューロン産生を減らしているものと考えました。
小頭症は従来、神経幹細胞の分化効率が上昇する(このために幹細胞が枯渇する)、神経幹細胞の細胞死が亢進する、分化ニューロンの細胞移動が障害されるという3つのメカニズムが重要な役割を果たすと考えられてきました。ところが、私たちの作成した神経幹細胞内のPQBP1を欠損するモデルマウス、PQBP1 Nestin-Cre-conditional KO(PQBP1-cKO)は、小頭症は再現するものの、これらの何れのメカニズムにも当てはまらず、その代わりに胎児の脳形成期における細胞周期時間が異常に延長していることが分かりました(図1)。この延長こそが神経幹細胞の分裂回数を減らし、結果としてニューロン産生を減らしているものと考えました。
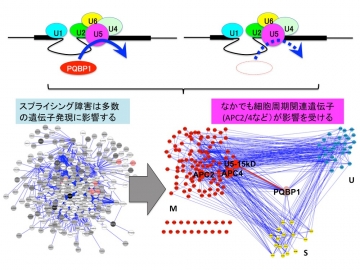
【図2】PQBP1異常は多くの遺伝子発現に影響する
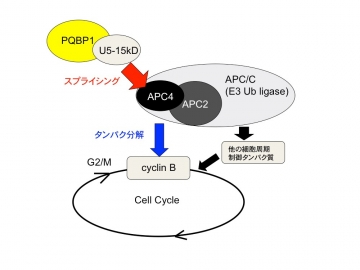
【図3】スプライシング異常が細胞周期延長を起こす
さらに、PQBP1-cKOマウスとコントロールマウスを比較すると、PQBP1のスプライシング障害により、数百個のM期、S期などの細胞周期調節タンパク質やユビキチンプロテアソーム関連タンパク質が影響を受けていることがわかりました(図2)。特にPQBP1は、間接的に結合しているであるAPC4(ユビキチンリガーゼ複合体サブユニット)の減少により細胞周期延長に貢献していることも判明しました(図3)。
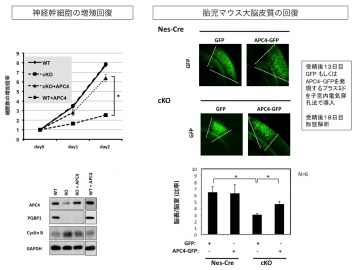
【図4】APC4がPQBP1機能低下を補完する
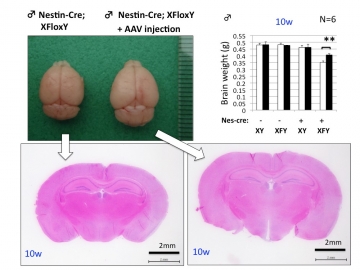
【図5】PQBP1ウィルスベクターによる小頭症遺伝子治療
また、PQBP1欠損による神経幹細胞の細胞増殖抑制は、APC4を補うことにより回復し、胎生期のPQBP1-cKOマウスにAPC4を補うことにより、大脳皮質形成が回復しました(図4)。
最後に、今回の研究では小頭症の治療を主眼として、PQBP1-cKOを対象に胎児期遺伝子治療を試みました。PQBP1欠損による機能低下を妊娠中の母マウスへAAVベクターを腹腔注射してPQBP1を補充すると、生まれたあとの小頭症モデルマウスの脳サイズが部分的に回復し、行動解析でも学習能力など知的障害関連の症状が改善しました(図5)。
最後に、今回の研究では小頭症の治療を主眼として、PQBP1-cKOを対象に胎児期遺伝子治療を試みました。PQBP1欠損による機能低下を妊娠中の母マウスへAAVベクターを腹腔注射してPQBP1を補充すると、生まれたあとの小頭症モデルマウスの脳サイズが部分的に回復し、行動解析でも学習能力など知的障害関連の症状が改善しました(図5)。
研究成果の意義
本研究成果は、人為的に脳サイズを調節することが可能であることを証明し、遺伝的な脳サイズ・知能の障害を改善しうる治療法への道筋を示したものです。これらの治療困難な疾患に遺伝子治療を行うべきか、倫理的課題でもあり今後慎重な検討が必要ですが、必要性が高いと判断された場合には将来治療に向けた取組がなされる可能性があります。また、PQBP1は複数の変性疾患の原因タンパク質と結合して機能低下を来すことが既に知られており、本研究で示した遺伝子治療を成人期に用いることが変性疾患に対しても有効である可能性があります。さらに、将来的にはヒト知能を高めることが可能か?という問題にもつながる可能性のある発見です。
用語説明
<PQBP1>
ポリグルタミン配列結合タンパク質1(Polyglutamine binding protein 1)。岡澤教授らが、ポリグルタミン配列をbaitとしてyeast two hybrid screening を行った結果得られた新規タンパク質である(Imafuku et al., Biochem. Biophys. Res. Commun 1998; Waragai et al., Hum Mol Genet 1999)。変性疾患において病態中間段階を担うタンパク質であるが(Okazawa et al., Neuron 2002)、同時に知的障害原因遺伝子でもある。PQBP1遺伝子異常症は、歴史的にRenpenning症候群、Sutherland-Haan症候群, Hamel症候群, Porteous症候群、Golabi-Ito-Hall症候群などという多数の名前で呼ばれて来た。これらは、臨床症状として知的障害に加えて高頻度に小頭症を合併することが特徴であり、遺伝性知的障害のなかでは頻度が非常に高いことが近年明らかになってきた。分子機能面では、岡澤教授らがRNAの転写とスプライシングに関与することを報告してきたが (Waragai et al., BBRC 2000; Okazawa et al., Neuron 2002 など)、最終的に構造解析を行ってスプライシング因子との複合体形成を示したことにより確定した(Mizuguchi et al., Nat Commun2014)。
<小頭症>
頭蓋周囲の長さが年齢の平均値より標準偏差の2倍以上短い場合に小頭症と呼ぶ。原因は多様であるが、脳構造の異常を伴うもの、異常を伴わないものに分けられる。後者はprimary microcephaly と呼ばれ常染色体劣性のことが多い。PQBP1異常症は primary microcephaly に病理形態学的に非常に近いと考えられる。Primary microcephalyには少なくとも12個の原因遺伝子が知られており、その多くは細胞分裂やその際のDNA修復に関わる機能を持っている。なかでも、Microcephalinはその遺伝子変異が37000年前に現れ、世界に急速に広がったとの説がある(Evans et al., Science 2005)。同様にこれらの遺伝子が複合的にヒト脳のサイズを決定している可能性があるが、詳細は不明である。Primary microcephalyは、神経幹細胞の分化効率が上昇する(このために幹細胞が枯渇する)、神経幹細胞の細胞死が亢進する、分化ニューロンの細胞異動が障害される、などのメカニズムで説明されて来たが、PQBP1異常症は異なるメカニズムを持っていた。
<知的障害>
知的障害は一般的にはIQが70未満である場合をさすことが多い。この定義からは、人口の1-3%が知的障害と考えられる。その原因は様々だが、遺伝性のものではX染色体上の遺伝子が原因であることが多い。PQBP1もX染色体上の遺伝子である。発達障害は各種の症状を合併することが多く、例えば、自閉症、知的障害、学習障害、注意欠陥多動性障害(ADHD)なども互いに合併しやすい。各種の対症療法に有効性が認められるものの、小頭症と同様に、これらの知的障害関連の症状に対する根本的治療は現状ではかなり難しいとされている。
ポリグルタミン配列結合タンパク質1(Polyglutamine binding protein 1)。岡澤教授らが、ポリグルタミン配列をbaitとしてyeast two hybrid screening を行った結果得られた新規タンパク質である(Imafuku et al., Biochem. Biophys. Res. Commun 1998; Waragai et al., Hum Mol Genet 1999)。変性疾患において病態中間段階を担うタンパク質であるが(Okazawa et al., Neuron 2002)、同時に知的障害原因遺伝子でもある。PQBP1遺伝子異常症は、歴史的にRenpenning症候群、Sutherland-Haan症候群, Hamel症候群, Porteous症候群、Golabi-Ito-Hall症候群などという多数の名前で呼ばれて来た。これらは、臨床症状として知的障害に加えて高頻度に小頭症を合併することが特徴であり、遺伝性知的障害のなかでは頻度が非常に高いことが近年明らかになってきた。分子機能面では、岡澤教授らがRNAの転写とスプライシングに関与することを報告してきたが (Waragai et al., BBRC 2000; Okazawa et al., Neuron 2002 など)、最終的に構造解析を行ってスプライシング因子との複合体形成を示したことにより確定した(Mizuguchi et al., Nat Commun2014)。
<小頭症>
頭蓋周囲の長さが年齢の平均値より標準偏差の2倍以上短い場合に小頭症と呼ぶ。原因は多様であるが、脳構造の異常を伴うもの、異常を伴わないものに分けられる。後者はprimary microcephaly と呼ばれ常染色体劣性のことが多い。PQBP1異常症は primary microcephaly に病理形態学的に非常に近いと考えられる。Primary microcephalyには少なくとも12個の原因遺伝子が知られており、その多くは細胞分裂やその際のDNA修復に関わる機能を持っている。なかでも、Microcephalinはその遺伝子変異が37000年前に現れ、世界に急速に広がったとの説がある(Evans et al., Science 2005)。同様にこれらの遺伝子が複合的にヒト脳のサイズを決定している可能性があるが、詳細は不明である。Primary microcephalyは、神経幹細胞の分化効率が上昇する(このために幹細胞が枯渇する)、神経幹細胞の細胞死が亢進する、分化ニューロンの細胞異動が障害される、などのメカニズムで説明されて来たが、PQBP1異常症は異なるメカニズムを持っていた。
<知的障害>
知的障害は一般的にはIQが70未満である場合をさすことが多い。この定義からは、人口の1-3%が知的障害と考えられる。その原因は様々だが、遺伝性のものではX染色体上の遺伝子が原因であることが多い。PQBP1もX染色体上の遺伝子である。発達障害は各種の症状を合併することが多く、例えば、自閉症、知的障害、学習障害、注意欠陥多動性障害(ADHD)なども互いに合併しやすい。各種の対症療法に有効性が認められるものの、小頭症と同様に、これらの知的障害関連の症状に対する根本的治療は現状ではかなり難しいとされている。
問い合わせ先
<研究に関すること>
東京医科歯科大学 難治疾患研究所 神経病理学分野 教授
脳統合機能研究センター長 岡澤 均(オカザワ ヒトシ)
TEL:03-5803-5847 FAX:03-5803-5847
E-mail: okazawa.npat(ここに@を入れてください)mri.tmd.ac.jp
<報道に関すること>
東京医科歯科大学 広報部広報課
〒113-8510 東京都文京区湯島1-5-45
TEL:03-5803-5833 FAX:03-5803-0272
E-mail:kouhou.adm(ここに@を入れてください)tmd.ac.jp
<文部科学省 「脳科学研究戦略推進プログラム」に関すること>
脳科学研究戦略推進プログラム 事務局 (担当:本木)
TEL:03- 5282-5145 FAX:03- 5282-5146
E-mail:srpbs(ここに@を入れてください)nips.ac.jp
東京医科歯科大学 難治疾患研究所 神経病理学分野 教授
脳統合機能研究センター長 岡澤 均(オカザワ ヒトシ)
TEL:03-5803-5847 FAX:03-5803-5847
E-mail: okazawa.npat(ここに@を入れてください)mri.tmd.ac.jp
<報道に関すること>
東京医科歯科大学 広報部広報課
〒113-8510 東京都文京区湯島1-5-45
TEL:03-5803-5833 FAX:03-5803-0272
E-mail:kouhou.adm(ここに@を入れてください)tmd.ac.jp
<文部科学省 「脳科学研究戦略推進プログラム」に関すること>
脳科学研究戦略推進プログラム 事務局 (担当:本木)
TEL:03- 5282-5145 FAX:03- 5282-5146
E-mail:srpbs(ここに@を入れてください)nips.ac.jp

