「新規蛍光顕微観測を実現する蛍光標識技術ポラリス法の開発」【寺田純雄 教授】

寺田 純雄(テラダ スミオ)教授 大学院医歯学総合研究科 神経機能形態学分野(右)
佐藤 啓介(サトウ ケイスケ)助教 同上(左)
杉崎 綾奈(スギザキ アヤナ)大学院生 同上(中央)
ポイント
| ● | 偏光の情報を利用し、細胞内生体分子の位置と配向を同時に観測可能とする新規蛍光標識技術ポラリス(POLArIS)法を開発しました。 |
| ● | ポラリス法によりヒトデ卵母細胞中のアクチン重合体を標識し、受精後の細胞分裂過程を蛍光偏光顕微鏡観察したところ、従来しられていなかった構造(フレア〈FLARE〉構造と命名)の動態の発見に成功しました。 |
| ● | 顕微鏡観測をはじめとする様々な観測手法への応用が可能となり、新しい蛍光測光機器開発・普及への道が開かれました。 |
| ● | 様々な生命科学現象の解明と新規医学・生物学関連測定機器開発への応用が期待できます。 |
東京医科歯科大学大学院医歯学総合研究科神経機能形態学分野・脳統合機能研究センターの寺田純雄教授と佐藤啓介助教、杉崎綾奈大学院生らの研究グループは、お茶の水女子大学(千葉和義 基幹研究院 教授)、理化学研究所(白水美香子 生命機能科学研究センター チームリーダー 他)、米国ウッズホール海洋生物学研究所(谷知己 Associate Scientist 〈現 産業技術総合研究所 主任研究員〉 他)との共同研究で、生命科学領域において偏光の情報を利用して新たな蛍光観測を可能とする新規蛍光標識技術ポラリス法の開発に成功し、その最初の応用例としてヒトデ受精卵の細胞分裂時に形成される、従来しられていなかったアクチン関連構造であるフレア構造を発見しました。この研究は文部科学省科学研究費補助金、武田科学振興財団、日本医療研究開発機構創薬等ライフサイエンス研究支援基盤事業 創薬等先端技術支援基盤プラットフォーム(BINDS)、米国ウッズホール海洋生物学研究所ならびに米国NIH Research Project Grant Program (R01)の支援のもとでおこなわれたもので、その研究成果は、国際科学誌Proceedings of the National Academy of Sciences of the United States of America(米国科学アカデミー紀要)に、2021年3月5日(米国東部時間)にオンライン版で発表されました。
研究の背景
偏光は光の基礎的な性質の一つであり、顕微鏡から望遠鏡にいたるまで、様々な領域で計測に利用されています。たとえば終戦直後の東大三崎臨海実験所において、井上信也博士(後に米国ウッズホール海洋生物学研究所Distinguished Scientist)が開発した偏光顕微鏡により、細胞分裂中のウニ受精卵において当時の通常の光学顕微鏡では可視化することのできなかった分裂紡錘の動態が生きた細胞内で、実時間下に鮮やかに観察可能となったことは、歴史的な業績として有名です。配向のそろった分子に由来する光学特性は特定の軸方向の偏光により強調して観測されるため、チュブリン分子が規則正しく重合して形成される微小管から形成される分裂紡錘の消長を、偏光顕微鏡により生きた状態で直接観測することが可能となったのです。このように偏光を利用すると、観察対象分子の配向に関する情報を得ることができます。
一方で、最新の生命科学領域では、2014年にノーベル賞受賞対象となった超解像顕微鏡をはじめとして、蛍光標識された生体分子の動態を詳細に観察可能な蛍光顕微鏡が広く普及しています。しかし現存の蛍光顕微鏡観察ではこの偏光による情報はほとんど利用されることがありません。
蛍光顕微鏡で生体分子を観察する場合、たとえば蛍光タンパク質等の蛍光分子により観察対象のタンパク質分子を標識する必要があります。蛍光偏光を利用した顕微鏡観察では、蛍光タンパク質の発する蛍光偏光の向きにより標識された分子の向きの情報を取得します。そのため、両者を相互の空間的位置関係を保持しつつ結合させる、「かたい(=剛直な)」リンカーのアミノ酸配列を設計する必要があります。これはリンカー配列設計から蛍光タンパク質とこれにより標識されるタンパク質の複合タンパク質の立体構造を予測することを意味しますが、その設計は最新の理論をもってしても解くことが不可能な、難しい問題です。この問題のために、これまで蛍光偏光の生命科学研究への応用が阻まれてきました。
一方で、最新の生命科学領域では、2014年にノーベル賞受賞対象となった超解像顕微鏡をはじめとして、蛍光標識された生体分子の動態を詳細に観察可能な蛍光顕微鏡が広く普及しています。しかし現存の蛍光顕微鏡観察ではこの偏光による情報はほとんど利用されることがありません。
蛍光顕微鏡で生体分子を観察する場合、たとえば蛍光タンパク質等の蛍光分子により観察対象のタンパク質分子を標識する必要があります。蛍光偏光を利用した顕微鏡観察では、蛍光タンパク質の発する蛍光偏光の向きにより標識された分子の向きの情報を取得します。そのため、両者を相互の空間的位置関係を保持しつつ結合させる、「かたい(=剛直な)」リンカーのアミノ酸配列を設計する必要があります。これはリンカー配列設計から蛍光タンパク質とこれにより標識されるタンパク質の複合タンパク質の立体構造を予測することを意味しますが、その設計は最新の理論をもってしても解くことが不可能な、難しい問題です。この問題のために、これまで蛍光偏光の生命科学研究への応用が阻まれてきました。
研究成果の概要
東京医科歯科大学の研究グループは、上記の問題を解決するために、細胞内で発現させることの可能な人工抗体様小分子※1アフィマーを利用することにしました。アフィマーは英国リーズ大学のグループにより開発された改変タンパク質小分子(分子量12.1K)で、試験管中でファージディスプレイ法とよばれる手法により、抗体分子と同様任意の分子に強く結合する性質をもったものを選びだすことが可能です。このアフィマーに蛍光タンパク質を「かたく」つなぐことができれば、アフィマーを足場として任意の分子に対して蛍光タンパク質を剛直な結合を介してつなぐことができるはずです。アフィマーはそのアミノ末端側にαへリックスとよばれるタンパク質二次構造※2を有しています。他方、汎用される緑色蛍光タンパク質にも、そのアミノ末端側に3.10ヘリックスとよばれる二次構造が存在します。東京医科歯科大学の研究グループはある種の緑色蛍光タンパク質について、循環置換体とよばれる変異体を作成することにより、アミノ末端側とは逆のカルボキシル末端にヘリックス構造をもつ蛍光タンパク質を作成することにしました。この変異体のカルボキシル末端のヘリックス構造と、アフィマーのアミノ末端のヘリックス構造を連続してつないだ複合タンパク質を作成すれば、両者の相互の配置がヘリックス構造により保持された状態となることが期待できます。
理化学研究所グループの協力により、このように設計したアフィマー・変異緑色蛍光タンパク質複合タンパク質の結晶を作成し、その構造を解析したところ、確かにアフィマーと蛍光タンパク質はヘリックス構造により「かたく」つながっていることがわかりました(図1)。さらに代表的な細胞骨格タンパク質のひとつであるアクチン重合体に強く結合するアフィマーを利用し、このアフィマー・緑色蛍光タンパク質複合タンパク質から発生する蛍光偏光※3が、アクチン分子の配向を確かに反映していることを、ウッズホール海洋生物学研究所グループの開発した最新の蛍光偏光顕微鏡により確かめました(図2)。開発したアフィマー・緑色蛍光タンパク質複合タンパク質は、原理的に任意の生体分子を「かたい」結合により蛍光標識可能なプローブ分子として利用可能なことが期待され、これをポラリス(POLArIS、Probe for Orientation and Localization Assessment, recognizing specific Intracellular Structures of interest)プローブと命名しました。
東京医科歯科大学の研究グループは、お茶の水女子大学の研究グループの協力を得て、アクチン重合体に結合するポラリスプローブをヒトデ受精卵において発現させ、アクチンの分子動態を蛍光偏光顕微鏡により観察しました。すると分裂のたびに消長する放射状のアクチン重合体構造の存在が明らかとなりました(図3)。 この構造は、細胞分裂時に出現することがしられている微小管と挙動を一にして中心体※4から放射状に広がり、一部は分裂紡錘※5に沿うように走行していました。分裂紡錘にアクチン線維が伴走しているとする報告はごく最近出始めていますが、分裂紡錘だけでなく、微小管形成中心としての中心体から細胞表面へのびる星状微小管※6にも同様に伴走して消長を繰り返していることは、世界で初めての発見です。東京医科歯科大学の研究グループはこのアクチン構造をフレア(FLARE, FLuffy And Radial actin-aster associated with mitosis in Embryo) 構造と命名しました。分裂時の微小管動態は従来から詳細に解析され、高等学校の生物の教科書でも記載される現象ですが、同時に微小管構造に広く伴走するフレア構造の存在はこれまでしられておらず、その機能的意義の解明はこれからの課題です。
理化学研究所グループの協力により、このように設計したアフィマー・変異緑色蛍光タンパク質複合タンパク質の結晶を作成し、その構造を解析したところ、確かにアフィマーと蛍光タンパク質はヘリックス構造により「かたく」つながっていることがわかりました(図1)。さらに代表的な細胞骨格タンパク質のひとつであるアクチン重合体に強く結合するアフィマーを利用し、このアフィマー・緑色蛍光タンパク質複合タンパク質から発生する蛍光偏光※3が、アクチン分子の配向を確かに反映していることを、ウッズホール海洋生物学研究所グループの開発した最新の蛍光偏光顕微鏡により確かめました(図2)。開発したアフィマー・緑色蛍光タンパク質複合タンパク質は、原理的に任意の生体分子を「かたい」結合により蛍光標識可能なプローブ分子として利用可能なことが期待され、これをポラリス(POLArIS、Probe for Orientation and Localization Assessment, recognizing specific Intracellular Structures of interest)プローブと命名しました。
東京医科歯科大学の研究グループは、お茶の水女子大学の研究グループの協力を得て、アクチン重合体に結合するポラリスプローブをヒトデ受精卵において発現させ、アクチンの分子動態を蛍光偏光顕微鏡により観察しました。すると分裂のたびに消長する放射状のアクチン重合体構造の存在が明らかとなりました(図3)。 この構造は、細胞分裂時に出現することがしられている微小管と挙動を一にして中心体※4から放射状に広がり、一部は分裂紡錘※5に沿うように走行していました。分裂紡錘にアクチン線維が伴走しているとする報告はごく最近出始めていますが、分裂紡錘だけでなく、微小管形成中心としての中心体から細胞表面へのびる星状微小管※6にも同様に伴走して消長を繰り返していることは、世界で初めての発見です。東京医科歯科大学の研究グループはこのアクチン構造をフレア(FLARE, FLuffy And Radial actin-aster associated with mitosis in Embryo) 構造と命名しました。分裂時の微小管動態は従来から詳細に解析され、高等学校の生物の教科書でも記載される現象ですが、同時に微小管構造に広く伴走するフレア構造の存在はこれまでしられておらず、その機能的意義の解明はこれからの課題です。
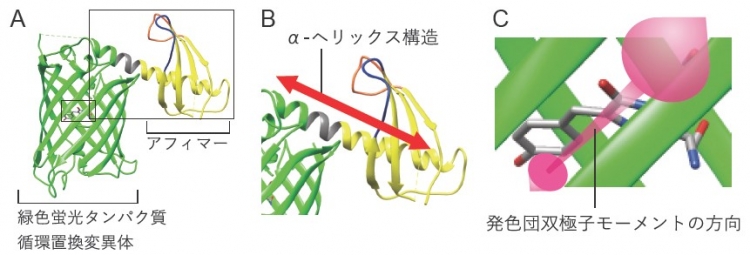
図1.開発したプローブ(アクチンを認識するポラリスプローブ)の立体構造
A: ポラリスプローブ構造の全体図。緑は緑色蛍光タンパク質の循環置換変異体を、黄色はアフィマーを、灰色は両者をつなぐリンカー配列を示す。二か所の標的分子認識部位を、青色および橙色で示す。B: A内の点線で囲まれた領域の拡大図。緑色蛍光タンパク質の変異体が、アフィマーとαへリックス構造で接続されている。C: A内の実線で囲まれた領域の拡大図。蛍光発色団の双極子モーメント※7の方向を示す。ポラリスプローブの蛍光偏光方向に対応する。
A: ポラリスプローブ構造の全体図。緑は緑色蛍光タンパク質の循環置換変異体を、黄色はアフィマーを、灰色は両者をつなぐリンカー配列を示す。二か所の標的分子認識部位を、青色および橙色で示す。B: A内の点線で囲まれた領域の拡大図。緑色蛍光タンパク質の変異体が、アフィマーとαへリックス構造で接続されている。C: A内の実線で囲まれた領域の拡大図。蛍光発色団の双極子モーメント※7の方向を示す。ポラリスプローブの蛍光偏光方向に対応する。

図2.ポラリスプローブにより検出されたアクチン分子の配向の様子
左図は試験管内で重合させたアクチン線維に、アクチン重合体に強く結合するポラリスプローブを結合させ、蛍光顕微鏡で撮影したもの。スケールバー: 1μm 右図は左図の蛍光輝点の偏光情報を解析したもの。丸は解析した蛍光輝点を、バーの向きは蛍光偏光の向きを、バーの長さは蛍光偏光の強さ(スケールバーは偏光度0.5)を示す。
左図は試験管内で重合させたアクチン線維に、アクチン重合体に強く結合するポラリスプローブを結合させ、蛍光顕微鏡で撮影したもの。スケールバー: 1μm 右図は左図の蛍光輝点の偏光情報を解析したもの。丸は解析した蛍光輝点を、バーの向きは蛍光偏光の向きを、バーの長さは蛍光偏光の強さ(スケールバーは偏光度0.5)を示す。
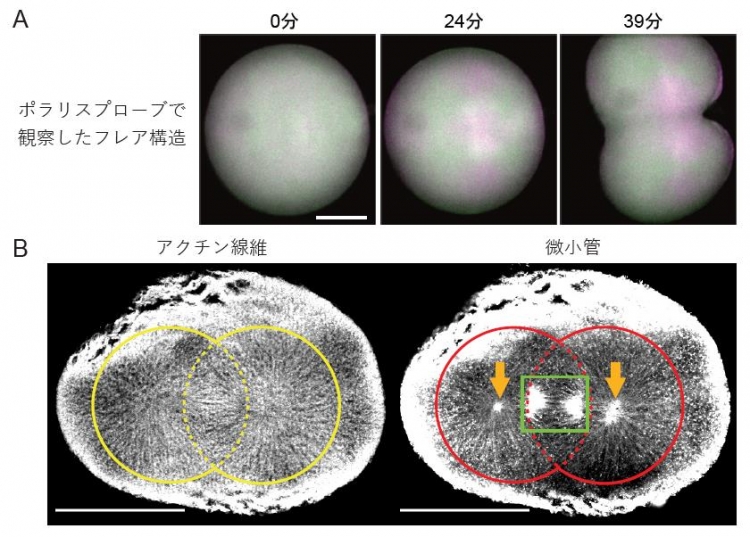
図3.アクチンを認識するポラリスプローブにより発見されたアクチンのフレア構造
A: アクチン重合体に強く結合するポラリスプローブを発現するイトマキヒトデ受精卵の細胞分裂(第一卵割)過程を、蛍光偏光顕微鏡により観察したもの。縦方向のアクチン重合体はマゼンタ色、横方向は緑色にみえる。放射状のアクチン重合体から構成されたフレア構造を反映して、縦がマゼンタ色、横が緑色の十字模様が出現している。B: 第一卵割中のイトマキヒトデ受精卵を固定し、アクチン重合体を特異的に標識するファロイジン(左)および微小管に特異的に結合する抗体(右)で染色した。黄線はフレア構造、赤線は星状微小管、緑線は分裂紡錘が存在する領域、橙色矢印は中心体の位置を示す。スケールバー: 100μm
A: アクチン重合体に強く結合するポラリスプローブを発現するイトマキヒトデ受精卵の細胞分裂(第一卵割)過程を、蛍光偏光顕微鏡により観察したもの。縦方向のアクチン重合体はマゼンタ色、横方向は緑色にみえる。放射状のアクチン重合体から構成されたフレア構造を反映して、縦がマゼンタ色、横が緑色の十字模様が出現している。B: 第一卵割中のイトマキヒトデ受精卵を固定し、アクチン重合体を特異的に標識するファロイジン(左)および微小管に特異的に結合する抗体(右)で染色した。黄線はフレア構造、赤線は星状微小管、緑線は分裂紡錘が存在する領域、橙色矢印は中心体の位置を示す。スケールバー: 100μm
研究成果の意義
新規蛍光標識技術ポラリス法は、アクチンのみならず原理的に任意の生体分子を、蛍光偏光観測に適した形で標識することが可能で、蛍光偏光の生命科学領域への応用を阻んでいた難問を解決しました。そしてアクチンを標的とした初期応用により、実際にフレア構造の発見という基礎生物学的意義の高い観察結果を得ることができ、蛍光偏光の利用の有用性を実証しました。
偏光は光の基礎的な性質であり、蛍光偏光も蛍光を発生する分子の配向を反映することから、以上の研究成果をきっかけとして、生命科学領域の様々な研究分野で蛍光偏光の利用が広がっていくことが期待できます。特にポラリスプローブは遺伝子にコードされていることから、発生過程や細胞から組織、個体レベルにいたる様々な時間的、空間的局面で、生命現象を追跡するツールとして広く応用が可能です。たとえば、生体分子複合体の構造変化の詳細な解析や新たな超解像解析など、さまざまな実験をささえる基礎技術となるでしょう。また顕微鏡のみならず、蛍光相関分光法などの蛍光顕微測光技術への応用も考えられ、あらたな蛍光測光機器開発を促進すると予想されます。
偏光は光の基礎的な性質であり、蛍光偏光も蛍光を発生する分子の配向を反映することから、以上の研究成果をきっかけとして、生命科学領域の様々な研究分野で蛍光偏光の利用が広がっていくことが期待できます。特にポラリスプローブは遺伝子にコードされていることから、発生過程や細胞から組織、個体レベルにいたる様々な時間的、空間的局面で、生命現象を追跡するツールとして広く応用が可能です。たとえば、生体分子複合体の構造変化の詳細な解析や新たな超解像解析など、さまざまな実験をささえる基礎技術となるでしょう。また顕微鏡のみならず、蛍光相関分光法などの蛍光顕微測光技術への応用も考えられ、あらたな蛍光測光機器開発を促進すると予想されます。
用語解説
※1人工抗体様小分子・・・・・・・・通常の抗体と同じように特定の標的分子に強く結合することができるが、分子量を小さくして扱いやすくしたもの。一般的にファージディスプレイ法とよばれる試験管内でのスクリーニングにより、遺伝子のコードされたタンパク質として選択できる。単鎖抗体やナノボディーとよばれるものが代表的で、アフィマーもその一種である。
※2タンパク質二次構造・・・・・・・・アミノ酸がつながってタンパク質が構成されるが、その配列を一次構造、さらに連結したアミノ酸が部分的に折りたたまれた構造を二次構造とよぶ。たとえばαへリックスはタンパク質の代表的な二次構造の一つで、右巻きのらせん構造をとることがしられている。
※3蛍光偏光・・・・・・・・光は電磁波の一種であり、電場と磁場が進行方向に垂直な面内で振動する横波としての性質を有する。蛍光タンパク質等の蛍光分子は、その発色団(蛍光を発する分子構造)の配向に対して振動面のそろった蛍光を発することがしられており、この振動面がそろった蛍光を蛍光偏光と表現する。
※4中心体・・・・・・・・動物細胞の細胞内小器官のひとつで、細胞分裂時に微小管が形成され始める、いわゆる微小管形成中心として機能することがしられている。
※5分裂紡錘・・・・・・・・細胞分裂時に中心体からのびた微小管の束が集まって構成される構造で、複製された染色体を分裂後のそれぞれの細胞に分配する働きをもつと考えられている。紡錘体とも呼ばれる。
※6星状微小管・・・・・・・・細胞分裂時に中心体から細胞表層へ向かう微小管の束で構成される構造で、細胞内における分裂紡錘の位置決めに働くと考えられている。
※7双極子モーメント・・・・・・・・ここでは蛍光タンパク質中の発色団の電荷的な分極(電荷分布の偏り)の大きさと向きを示す量。蛍光タンパク質はこの向きに対して平行な振動面をもつ蛍光偏光を発する。
※2タンパク質二次構造・・・・・・・・アミノ酸がつながってタンパク質が構成されるが、その配列を一次構造、さらに連結したアミノ酸が部分的に折りたたまれた構造を二次構造とよぶ。たとえばαへリックスはタンパク質の代表的な二次構造の一つで、右巻きのらせん構造をとることがしられている。
※3蛍光偏光・・・・・・・・光は電磁波の一種であり、電場と磁場が進行方向に垂直な面内で振動する横波としての性質を有する。蛍光タンパク質等の蛍光分子は、その発色団(蛍光を発する分子構造)の配向に対して振動面のそろった蛍光を発することがしられており、この振動面がそろった蛍光を蛍光偏光と表現する。
※4中心体・・・・・・・・動物細胞の細胞内小器官のひとつで、細胞分裂時に微小管が形成され始める、いわゆる微小管形成中心として機能することがしられている。
※5分裂紡錘・・・・・・・・細胞分裂時に中心体からのびた微小管の束が集まって構成される構造で、複製された染色体を分裂後のそれぞれの細胞に分配する働きをもつと考えられている。紡錘体とも呼ばれる。
※6星状微小管・・・・・・・・細胞分裂時に中心体から細胞表層へ向かう微小管の束で構成される構造で、細胞内における分裂紡錘の位置決めに働くと考えられている。
※7双極子モーメント・・・・・・・・ここでは蛍光タンパク質中の発色団の電荷的な分極(電荷分布の偏り)の大きさと向きを示す量。蛍光タンパク質はこの向きに対して平行な振動面をもつ蛍光偏光を発する。
論文情報
掲載誌:Proceedings of the National Academy of Sciences of the United States of America
論文タイトル:POLArIS, a versatile probe for molecular orientation, revealed actin filaments associated with microtubule asters in early embryos
論文タイトル:POLArIS, a versatile probe for molecular orientation, revealed actin filaments associated with microtubule asters in early embryos
研究者プロフィール

寺田 純雄 (テラダ スミオ) Terada Sumio
東京医科歯科大学 大学院医歯学総合研究科 神経機能形態学分野 教授
・研究領域
解剖学・細胞生物学・生物物理学・神経科学
東京医科歯科大学 大学院医歯学総合研究科 神経機能形態学分野 教授
・研究領域
解剖学・細胞生物学・生物物理学・神経科学

佐藤 啓介 (サトウ ケイスケ) Sato Keisuke
東京医科歯科大学 大学院医歯学総合研究科 神経機能形態学分野 助教
・研究領域
細胞生物学
東京医科歯科大学 大学院医歯学総合研究科 神経機能形態学分野 助教
・研究領域
細胞生物学

杉崎 綾奈 (スギザキ アヤナ) Sugizaki Ayana
東京医科歯科大学 大学院医歯学総合研究科
神経機能形態学分野(形態・生体情報解析学分野より委託) 大学院生
・研究領域
解剖学・細胞生物学
東京医科歯科大学 大学院医歯学総合研究科
神経機能形態学分野(形態・生体情報解析学分野より委託) 大学院生
・研究領域
解剖学・細胞生物学
問い合わせ先
<研究に関すること>
東京医科歯科大学大学院医歯学総合研究科
神経機能形態学分野 寺田純雄(テラダ スミオ)
TEL:03-5803-5148 FAX:03-5803-5151
E-mail:terada.nana@tmd.ac.jp
<報道に関すること>
東京医科歯科大学 総務部総務秘書課広報係
〒113-8510 東京都文京区湯島1-5-45
TEL:03-5803-5011 FAX:03-5803-0272
E-mail:kouhou.adm@tmd.ac.jp
東京医科歯科大学大学院医歯学総合研究科
神経機能形態学分野 寺田純雄(テラダ スミオ)
TEL:03-5803-5148 FAX:03-5803-5151
E-mail:terada.nana@tmd.ac.jp
<報道に関すること>
東京医科歯科大学 総務部総務秘書課広報係
〒113-8510 東京都文京区湯島1-5-45
TEL:03-5803-5011 FAX:03-5803-0272
E-mail:kouhou.adm@tmd.ac.jp

