「拡張型心筋症の原因変異が分子ばねタンパク質の発現に影響するしくみを解明」【黒柳秀人 准教授、木村彰方 教授】
― モデルマウスによる病態解明と治療法開発へ前進 ―

黒柳 秀人(クロヤナギ ヒデヒト)准教授 難治疾患研究所遺伝子発現制御学(右)
木村 彰方(キムラ アキノリ)教授 難治疾患研究所分子病態分野(左)
ポイント
| ● | 日米の拡張型心筋症患者さんにスプライシング制御因子RBM20の遺伝子変異を見出しました。 |
| ● | RBM20遺伝子で拡張型心筋症の病因変異が集中する領域がRBM20の細胞核への局在に必須であることを明らかにしました。 |
| ● | 患者型変異を導入した遺伝子改変マウスは、患者さんと同様に、心筋細胞で分子ばねとして機能するタイチンタンパクの異常を示しました。 |
| ● | 作製したRbm20遺伝子改変マウスは、心筋症の病態解明や治療法開発への応用が期待できます。 |
東京医科歯科大学難治疾患研究所フロンティア研究室(遺伝子発現制御学)の黒柳秀人准教授と同研究所分子病態分野の木村彰方教授の研究グループは、山口大学および米国インディアナ大学との共同研究で、拡張型心筋症の病因となるmRNAスプライシング制御因子RBM20の変異により、心筋細胞の分子ばねとして機能するタイチンタンパク質の発現が異常になる分子機構をつきとめました。この研究は文部科学省・日本学術振興会科学研究費補助金、「難治疾患共同研究拠点」共同研究費ならびに公益財団法人武田科学振興財団「医学系研究奨励(基礎)」の支援のもとでおこなわれたもので、その研究成果は、国際科学誌Scientific Reports(サイエンティフィック・レポーツ)に、2018年6月12日午前10時(グリニッジ標準時)にオンラインで発表されます。
研究の背景
拡張型心筋症は、左心室の収縮機能不全を特徴とする疾患で、2,000~3,500人に1人の割合で発症しますが、心臓移植以外の根本的治療法がなく、病態発現に至る分子機構の解明と治療法の開発が待たれています。近年では、木村教授らのグループを含む各国の研究グループにより家族性や孤発生の拡張型心筋症患者さんの遺伝子解析が精力的に行われ、筋収縮機能に直接関わるタンパク質を中心とする60種類近いタンパク質の遺伝子に変異が報告されています。
RBM20遺伝子は、常染色体性優性遺伝形式をとる家族性拡張型心筋症の患者さんで変異が見出されることから、拡張型心筋症の原因遺伝子であることが判明しています。RBM20はRNA結合タンパク質であるため、筋収縮には直接関与しない異色の原因遺伝子でしたが、最近になって、心室が拡張して心筋細胞が伸展した際に受動的張力をもたらす分子ばねタンパク質であるタイチンをコードするTTN遺伝子のメッセンジャーRNA(mRNA)の心筋型選択的スプライシングの制御因子であることが報告されました。このため、拡張型心筋症の病態解明の新たな手がかりになることが期待されていますが、患者さんに見られるRBM20遺伝子の変異がRBM20のスプライシング制御因子としての機能にどのように影響するのか、その分子機構はよく解っていませんでした。
RBM20遺伝子は、常染色体性優性遺伝形式をとる家族性拡張型心筋症の患者さんで変異が見出されることから、拡張型心筋症の原因遺伝子であることが判明しています。RBM20はRNA結合タンパク質であるため、筋収縮には直接関与しない異色の原因遺伝子でしたが、最近になって、心室が拡張して心筋細胞が伸展した際に受動的張力をもたらす分子ばねタンパク質であるタイチンをコードするTTN遺伝子のメッセンジャーRNA(mRNA)の心筋型選択的スプライシングの制御因子であることが報告されました。このため、拡張型心筋症の病態解明の新たな手がかりになることが期待されていますが、患者さんに見られるRBM20遺伝子の変異がRBM20のスプライシング制御因子としての機能にどのように影響するのか、その分子機構はよく解っていませんでした。
研究成果の概要
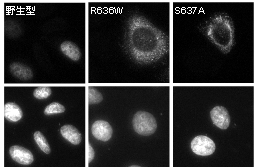
図1.野生型および患者型RBM20の細胞
内局在。上段はRBM20、下段は核を染色。
日米の拡張型心筋症患者さん計93人の遺伝子を解析し、18歳で発症した日本の男性患者さんとその父親でやはり拡張型心筋症の症状を示す方にRBM20遺伝子のR634Wヘテロ接合アミノ酸置換変異、21歳で発症した米国の男性患者さんにG1031Xホモ接合ナンセンス変異を見出しました。
上述の日本の患者さんを含め、これまでに世界各国の拡張型心筋症患者さんに見出されたRBM20遺伝子のヘテロ接合アミノ酸置換変異は、RNA結合ドメインではなく、アルギニン-セリン-アルギニン-セリン-プロリン(RSRSP)という5アミノ酸残基から成る短い配列に集中していました。そこで、RBM20によるmRNAスプライシング制御に際してのRSRSP配列の機能を培養細胞で解析し、RSRSP配列中の2つのセリン残基が共にリン酸化されること、そのリン酸化がスプライシングの場である細胞核へのRBM20の局在に必須であることを明らかにしました(図1)。
上述の日本の患者さんを含め、これまでに世界各国の拡張型心筋症患者さんに見出されたRBM20遺伝子のヘテロ接合アミノ酸置換変異は、RNA結合ドメインではなく、アルギニン-セリン-アルギニン-セリン-プロリン(RSRSP)という5アミノ酸残基から成る短い配列に集中していました。そこで、RBM20によるmRNAスプライシング制御に際してのRSRSP配列の機能を培養細胞で解析し、RSRSP配列中の2つのセリン残基が共にリン酸化されること、そのリン酸化がスプライシングの場である細胞核へのRBM20の局在に必須であることを明らかにしました(図1)。
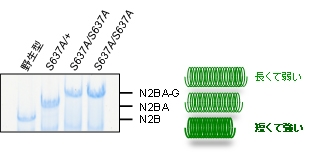
図2.患者型遺伝子改変マウスの心臓で発現する
タイチンタンパク質の分子量の解析
RSRSP配列の重要性を哺乳動物の個体レベルで確認するために、高効率のゲノム編集技術を利用し、RBM20遺伝子変異が最初に報告された拡張型心筋症の患者さんが持つS635A変異を模したRbm20S637A遺伝子改変マウスを作製しました。野生型マウスの成体の心筋では、RBM20のはたらきにより受動的張力が最も強いN2B型タイチンが主に発現していますが、Rbm20S637A/+ヘテロ接合体ではS635A変異を持つ患者さんでも増加することが報告されているN2BA型タイチンが主に発現し、Rbm20S637A/S637Aホモ接合体では野生型成体マウスの心筋には存在しない長大で受動的張力が最も弱いと考えられるN2BA-G型タイチンが発現していました(図2)。
これらの結果から、マウスの心臓においてもRBM20のRSRSP配列がTtn遺伝子のスプライシング制御機能にとって必須であることが確認されました(図3に模式図)。
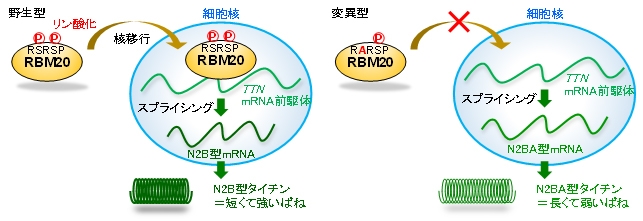
図3.RBM20によるTTN遺伝子の心筋特異的選択的スプライシング制御の模式図。(左)野生型RBM20ではRSRSP配列中の2つのセリン残基(S)が共にリン酸化(P)されて核移行しN2B型タイチンmRNAを産生させる。(右)変異型RBM20では核移行が起こらずN2BA型タイチンmRNAが産生される。
研究成果の意義
今回の研究で作製されたRbm20S637A遺伝子改変マウスは、拡張型心筋症の発症に至る病態発現機構の解明やTTN遺伝子の選択的スプライシング制御を標的とした治療法の開発に役立つと期待されます。
補足説明
タイチンは哺乳動物がもつすべてのタンパク質のうちで最も分子量が大きく、3,800 kDaに達します。また、タイチンをコードするTTN遺伝子は哺乳動物のすべての遺伝子のうちで最もエクソンの数が多く、ヒトやマウスでは363個ものエクソンから成っています。そして、RBM20は心筋においてTTN遺伝子のエクソン51からエクソン218までのすべてのエクソンのスプライシングを漏れなく抑制するという、異例とも言える選択的スプライシング制御によりN2B型タイチンを発現させます。このように、心筋におけるRBM20によるTTN遺伝子の選択的スプライシング制御は生物学的に特殊な事象と言えます。
拡張型心筋症の患者さん集団を対象とした遺伝子解析によって、候補も含めると約60個の原因遺伝子が同定されていますが、全世界でみるとTTN遺伝子に変異が見つかる患者さんが最も多く、全体の20~25%を占めています。これは、タイチンタンパク質の正常な発現が心筋の機能維持にとって極めて重要であることを示しています。
拡張型心筋症の患者さん集団を対象とした遺伝子解析によって、候補も含めると約60個の原因遺伝子が同定されていますが、全世界でみるとTTN遺伝子に変異が見つかる患者さんが最も多く、全体の20~25%を占めています。これは、タイチンタンパク質の正常な発現が心筋の機能維持にとって極めて重要であることを示しています。
論文情報
掲載誌:Scientific Reports
論文タイトル:Phosphorylation of the RSRSP stretch is critical for splicing regulation by RNA-Binding Motif Protein 20 (RBM20) through nuclear localization.
DOI:10.1038/s41598-018-26624-w
論文タイトル:Phosphorylation of the RSRSP stretch is critical for splicing regulation by RNA-Binding Motif Protein 20 (RBM20) through nuclear localization.
DOI:10.1038/s41598-018-26624-w
研究者プロフィール

黒柳秀人 (クロヤナギ ヒデヒト) KUROYANAGI Hidehito, Ph.D.
東京医科歯科大学
難治疾患研究所 准教授
・研究領域
分子生物学(遺伝子発現制御機構)
モデル生物を用いた基礎研究で得た知見を疾患研究に還元していきたいと考えています
東京医科歯科大学
難治疾患研究所 准教授
・研究領域
分子生物学(遺伝子発現制御機構)
モデル生物を用いた基礎研究で得た知見を疾患研究に還元していきたいと考えています

木村彰方(キムラ アキノリ) KIMURA Akinori, MD, PhD
東京医科歯科大学
特命副学長(研究・評価担当)
難治疾患研究所 教授
・研究領域
人類遺伝学
難治疾患の病因・病態形成機序を究明し、あらたな診断、治療、予防法の開発につなげたいと思います
東京医科歯科大学
特命副学長(研究・評価担当)
難治疾患研究所 教授
・研究領域
人類遺伝学
難治疾患の病因・病態形成機序を究明し、あらたな診断、治療、予防法の開発につなげたいと思います
問い合わせ先
研究に関すること
東京医科歯科大学難治疾患研究所
遺伝子発現制御学 黒柳秀人 (クロヤナギ ヒデヒト)
TEL:03-5803-4695
E-mail:kuroyana.end@tmd.ac.jp
分子病態分野 木村彰方 (キムラ アキノリ)
TEL:03-5803-4905
E-mail:akitis@mri.tmd.ac.jp
遺伝子発現制御学 黒柳秀人 (クロヤナギ ヒデヒト)
TEL:03-5803-4695
E-mail:kuroyana.end@tmd.ac.jp
分子病態分野 木村彰方 (キムラ アキノリ)
TEL:03-5803-4905
E-mail:akitis@mri.tmd.ac.jp
報道に関すること
東京医科歯科大学 総務部総務秘書課広報係
〒113-8510 東京都文京区湯島1-5-45
TEL:03-5803-5833 FAX:03-5803-0272
E-mail:kouhou.adm@tmd.ac.jp
〒113-8510 東京都文京区湯島1-5-45
TEL:03-5803-5833 FAX:03-5803-0272
E-mail:kouhou.adm@tmd.ac.jp

