炎症性筋疾患の原因解明と新しい治療法の開発
炎症性筋疾患の診療における満たされないニーズ
炎症性筋疾患は、手足の体に近い部分や首、飲み込む時に使う筋肉の筋力低下を主な症状とする慢性疾患で、多発性筋炎や皮膚筋炎などが含まれます。これらの疾患は我が国における特定疾患(いわゆる難病)に指定され、国内には2万名以上の患者さんがいらっしゃり、毎年約2千名が新しく炎症性筋疾患を発症されます。病気の成り立ちは詳しく分かっていませんが、自己反応性(自分の体の構成成分に反応して、自身の細胞や組織を攻撃する)免疫細胞が筋細胞を傷害してしまう、自己免疫疾患であると考えられています。炎症性筋疾患の治療には、副腎皮質ステロイド薬や様々な免疫抑制剤が用いられています。これらは免疫細胞を標的とした治療ですが、非特異的(疾患において本質的な部分にとどまらず、広範囲)に免疫力を抑えてしまうことから、感染症などの副作用が問題となります。また、副腎皮質ステロイド薬はステロイド筋症を誘導して、さらなる筋力低下を引き起こします。そのうえ、これらの治療法が効果不十分にとどまる患者さんや、筋の炎症が落ち着いた後にも筋力が回復するのに長期間を要する患者さんがいらっしゃることも大きな問題です。これらの診療上の満たされないニーズを解決するような、安全で、しかも筋力を改善させる効果のある治療の開発が求められています。
炎症性筋疾患の研究のブレークスルーを目指して
このような多くの満たされないニーズが残る原因のひとつに、炎症性筋疾患の研究が進んでこなかったことが挙げられます。炎症性筋疾患の研究は、患者さんの血液中に特別に検出される様々な自己抗体や、合併する間質性肺炎や特徴的な皮膚の発疹などの筋肉以外の病変を含んだ病状の全体像については発展している一方で、なぜ筋肉に炎症が起きるのか、どうして筋力が低下してしまうのかについて根本から追求する研究は進んでいませんでした。その背景には、病気を詳しく解析するため、そして治療薬の効果を評価するために必要な、適切な動物モデルや細胞モデルがなかったことが挙げられます。炎症性筋疾患の研究は、長きにわたり患者さんの筋を顕微鏡で観察した所見を頼りに、病変部に豊富に存在する細胞や分子が病気に関係していると推測するより致しようがありませんでした。
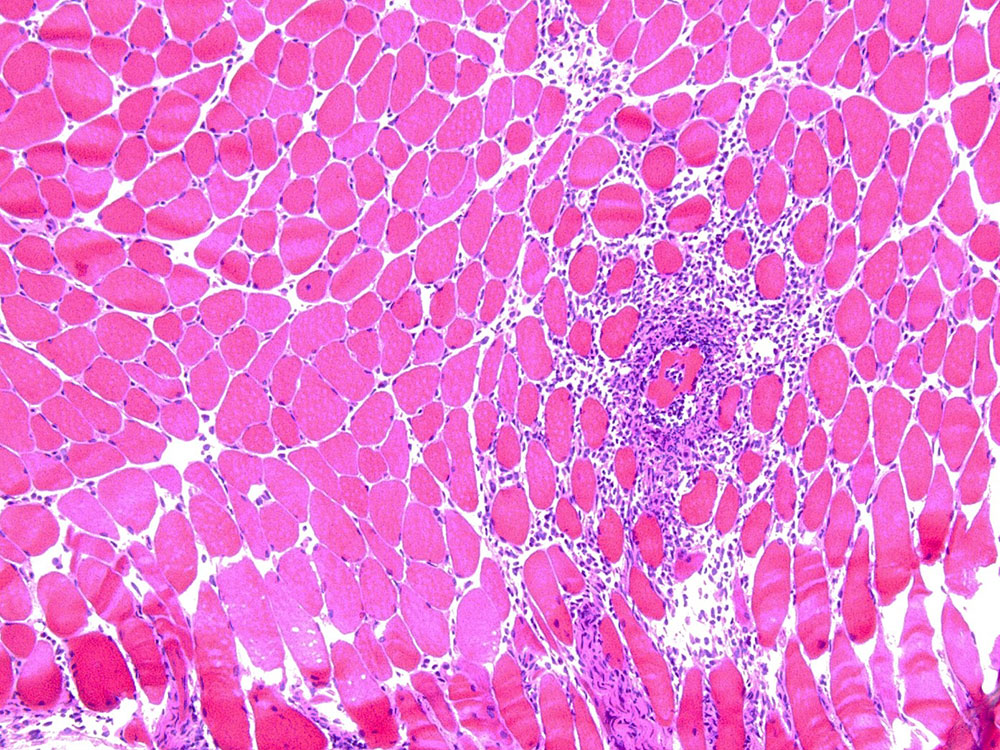
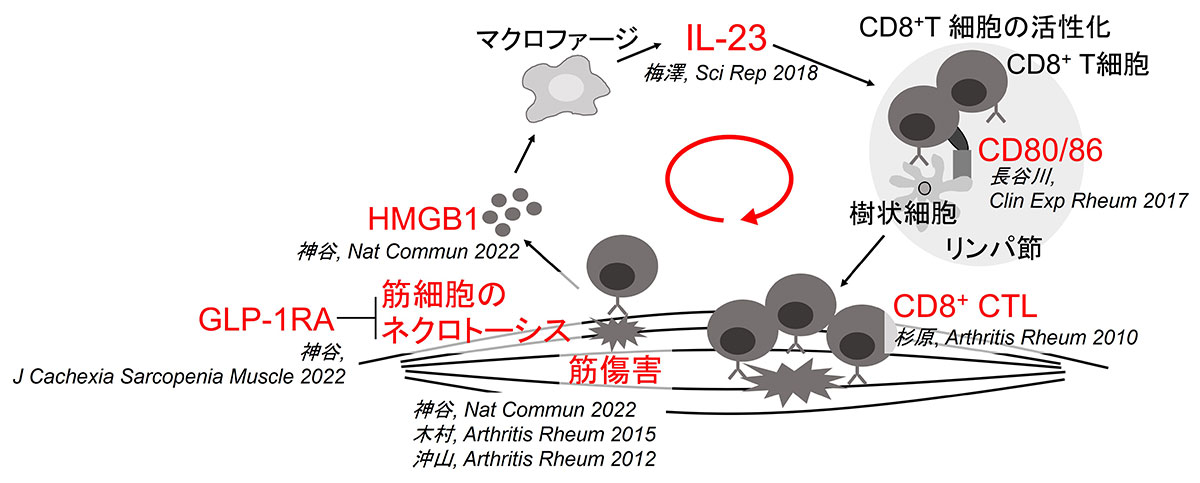
そこで、私たちは、多発性筋炎のモデルマウスであるC蛋白誘導性筋炎(C protein-induced myositis; CIM)を開発しました(図1)1。かつて炎症性筋疾患の研究に用いられていたマウスモデルにおいては、遺伝子変異のために筋肉が壊れやすい系統のマウスや、遺伝子操作によって筋肉にストレスをかけたマウスを用いる必要があった一方、CIMは様々な系統の健常なマウスに対して、筋肉の構成成分であるC蛋白の断片を1回免疫することにより安定して筋炎を起こすことができます。CIMにおいて、多発性筋炎の患者さんの筋に特徴的とされる、CD8陽性細胞傷害性Tリンパ球(cytotoxic T lymphocytes; CTL)による筋組織攻撃が重要な役割を果たすことも確認され2、多発性筋炎に近いマウスモデルと考えられます。さらに、実際に多発性筋炎や皮膚筋炎の患者さんに有効である、免疫グロブリン大量静注療法を含む様々な治療法がこのモデルにも奏功しました1。このように、CIMは多発性筋炎の解析に相応しいマウスです。当研究室では遺伝子改変マウスや様々な治療薬、そして細胞の養子移入実験(筋炎を発症したマウスのリンパ節から取り出した細胞を、筋炎を誘導していないマウスに投与する検証)によるCIMの検証を通して、マクロファージ由来のインターロイキン(IL-)23や、抗原提示細胞とT細胞間の共刺激がCIMに重要な役割を担うことを示し3,4、これらが炎症性筋疾患の新しい治療標的となる可能性を示してきました。国内外の複数の研究施設においてもCIMを用いた研究が盛んに行われ、このモデルは炎症性筋疾患の研究を大きく発展させたと評価されています。
さらに、私たちは多発性筋炎の細胞モデルを開発しました(図2)5。このモデルは、CTLによる筋細胞傷害を試験管の中で再現したもので、筋細胞がダメージを受ける仕組みをダイナミックかつ容易に解析することを可能としました。これらの細胞を標的とした新しい治療薬の候補の評価・選択にも応用できます。
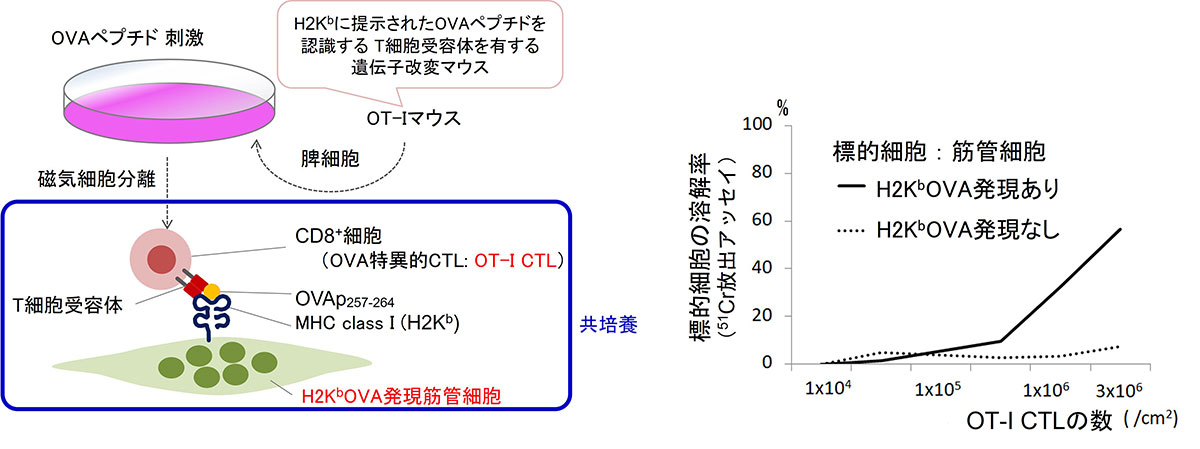
(左)概要;抗原特異的なCTLによる細胞傷害を誘導するためにモデル抗原(OVAp257-264)とOT-Iマウスを利用した
(右)OT-I CTLによる筋管細胞傷害は抗原特異的である
筋細胞の細胞死を炎症性筋疾患の新しい治療標的として特定
副腎皮質ステロイドや免疫抑制剤などの、免疫細胞を標的とした治療が、炎症性筋疾患の患者さんの筋力回復に効果不十分である現状から、私たちは炎症性筋疾患における筋細胞の役割に着目した研究も行ってきました。これまでに私たちはCIMを用いた検証を通して、筋炎の発症には自己反応性のCTLだけではなく、筋組織におけるマクロファージなどの自然免疫系の細胞の活性化も必要であることを示しました3,6。さらに、傷害を受けた結果、筋細胞は細胞死に至り脱落しますが、その際に炎症介在因子を放出し筋肉局所における自然免疫系を活性化させることを示しました7。よって、筋細胞の細胞死が筋の自然免疫の活性化を促し、さらなる炎症を誘導すると考えられ、筋細胞の細胞死の制御が炎症性筋疾患の新しい治療法になり得ると予想しました。しかし、筋細胞は各々の細胞に多数の核をもち、長径数センチメートルに及ぶ特殊な細胞であり、その細胞死の機序は未解明でした。炎症性筋疾患における筋細胞の細胞死は、分子の信号伝達によって能動的かつ厳密に執行され制御が可能なプログラム細胞死ではなく、むしろ偶発的・受動的で制御不能な細胞死であるネクローシス(壊死)と考えられていました。
私たちは患者さんの筋を用いた検証と、細胞モデルを用いた分析から、傷害を受けた結果、筋細胞がネクロトーシスと呼ばれるプログラム細胞死に至ることを発見しました8。ネクロトーシスは炎症介在因子の放出を伴う炎症誘導性の細胞死と知られ、実際にCIMに対するネクロトーシスを阻害する薬剤を用いた治療は、CIMによる筋力低下や筋の炎症を改善させました(図3)8。さらに、ネクロトーシスに至った筋細胞からHMGB1という炎症介在因子が放出され、HMGB1に対する阻害抗体を用いた治療もマウスの筋力や筋の炎症を改善させることも示しました8(図3)。これらの発見により、筋細胞はCTLなどの免疫細胞の単なる標的にとどまらず、ネクロトーシスを介して病気の悪化に積極的に関わることが示され、炎症性筋疾患の全く新しい治療標的を見出しました。筋細胞のネクロトーシスを標的とした治療は、免疫細胞を標的とした現在の治療法とは全く違う仕組みを介した、いわば”筋指向性”の治療戦略であり、感染症などの副作用が少なく筋力改善効果を有する治療方法として期待されます。
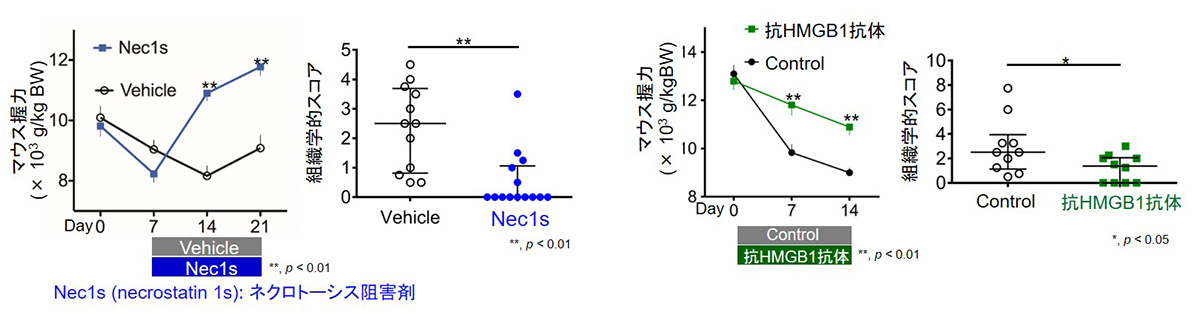
(左)Nec1sによるネクロトーシス阻害はCIMの筋力や筋の炎症を改善させた
(右)抗HMGB1抗体によるHMGB1阻害はCIMの筋力や筋の炎症を改善させた
さらに、筋細胞のネクロトーシスには、従来から知られるネクロトーシス関連分子(RIPK1, RIPK3, MLKL)の信号伝達だけではなく、ミトコンドリアの機能を制御する分子であるPGAM5や、活性酸素種(ROS)がその執行のアクセル役になることを示しました(図4)9。私たちは、国際共同研究にて、新しいグルカゴン様ペプチド-1受容体作動薬(GLP-1RA)であるPF1801が、PGAM5やROSを抑えることを介して、筋細胞のネクロトーシスとそれに引き続いたHMGB1放出を抑制し、筋炎マウスモデルの筋力や炎症を改善させることを発見しました(図4)9。GLP-1RAは、糖尿病の治療薬として既に臨床現場で患者さんに使用されており、その安全性についての充分な情報が存在します。現在は、本薬剤の臨床応用を目指した治験の実施を計画しています。
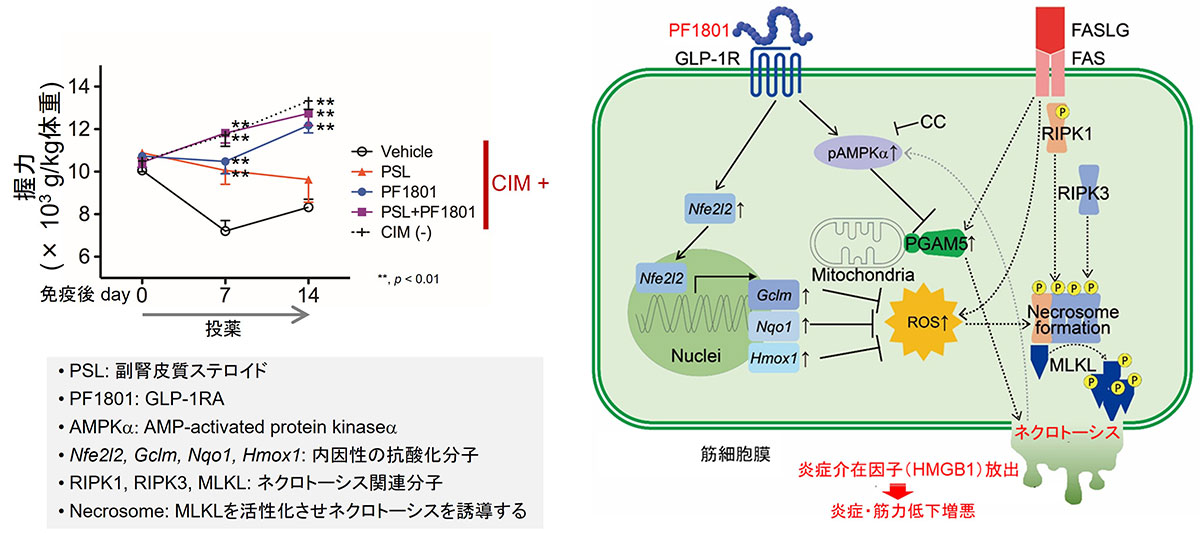
(左)GLP-1RAは単独あるいは副腎皮質ステロイドとの併用でCIMの筋力を改善させた
(右)GLP-1RAは筋細胞のネクロトーシスを抑制し、筋炎を改善させる
炎症性筋疾患研究への誘い
以上のように、私たちは、患者さん由来の筋組織、マウスモデル、細胞モデルを用いた統合的な解析を駆使して、安全かつ、筋力改善効果を有する治療法開発を目指した研究に取り組んできました(図5)。タフでチャレンジングなことにもしばしば遭遇しますが、研究成果が炎症性筋疾患の診療に貢献できることを信じて日々奮闘しています。私たちの研究に興味をお持ちいただき、このウェブサイトを訪れてくださった皆様、これも何かのご縁と思います。学生さん、若手医師の皆様、まずは一度研究室見学にいらっしゃいませんか。
References
- Sugihara, T. et al. A new murine model to define the critical pathologic and therapeutic mediators of polymyositis. Arthritis Rheum. 56, 1304–1314 (2007).
- Sugihara, T. et al. Definitive engagement of cytotoxic CD8 T cells in C protein-induced myositis, a murine model of polymyositis. Arthritis Rheum. 62, 3088–3092 (2010).
- Umezawa, N. et al. Interleukin-23 as a therapeutic target for inflammatory myopathy. Sci. Rep. 8, (2018).
- Hasegawa, H. et al. Direct suppression of autoaggressive CD8+ T cells with CD80/86 blockade in CD8+ T cell-mediated polymyositis models of mice. Clin. Exp. Rheumatol. 35, 593–597 (2017).
- Kamiya, M. et al. A new in vitro model of polymyositis reveals CD8+ T cell invasion into muscle cells and its cytotoxic role. Rheumatol. (United Kingdom) 59, 224–232 (2020).
- Okiyama, N. et al. T lymphocytes and muscle condition act like seeds and soil in a murine polymyositis model. Arthritis Rheum. 64, 3741–3749 (2012).
- Kimura, N., Hirata, S., Miyasaka, N., Kawahata, K. & Kohsaka, H. Injury and subsequent regeneration of muscles for activation of local innate immunity to facilitate the development and relapse of autoimmune myositis in C57BL/6 mice. Arthritis Rheumatol. 67, 1107–1116 (2015).
- Kamiya, M. et al. Targeting necroptosis in muscle fibers ameliorates inflammatory myopathies. Nat. Commun. 13, 166 (2022).
- Kamiya, M., Mizoguchi, F. & Yasuda, S. Amelioration of inflammatory myopathies by glucagon-like peptide-1 receptor agonist via suppressing muscle fibre necroptosis. J. Cachexia. Sarcopenia Muscle (2022). doi:10.1002/JCSM.13025


