 希少疾患・難病 RD
希少疾患・難病 RD神経疾患および関連領域
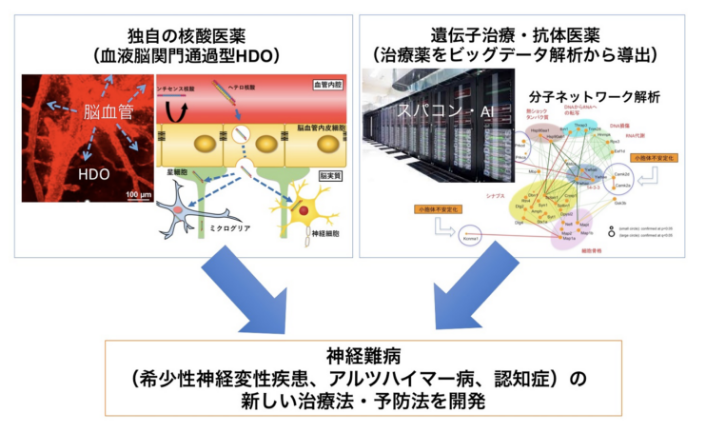
希少性神経疾患あるいはアルツハイマー病などの神経難病を対象に、独自に開発したヘテロ核酸技術によって創製した核酸医薬、あるいは、AI・スパコンを駆使した分子ネットワーク解析から開発した治療薬を用いて、認知症と神経難病の新しい治療・予防を創出します。
横田グループでは、これまで核酸医薬の基盤技術である「ヘテロ核酸技術」を独自に発明し、研究開発をしてきました。核酸医薬品は近年上市が相次ぎ注目されておりますが、中枢神経への薬物送達と毒性の点で課題がありました。本研究では、ヘテロ核酸技術を用いて核酸医薬の課題を克服し、認知症と神経難病に対する治療薬の創製を行います。
岡澤グループでは、アルツハイマー病などの認知症の症状顕在化の、はるか前の分子的兆候を網羅的解析手法によって探索してきました。そして、得られたビッグデータを、スーパーコンピュータやAIを用いて解析することで、神経変性の本質が徐々に明らかになってきました。このうち本研究では、分子ネットワークの時間的遷移と脳炎症にフォーカスした研究を進めます。
指定研究者一覧
公募班

統合失調症の病期縦断的・異種性横断的な病態解明
大学院医歯学総合研究科 精神行動医科学分野 大学院生
統合失調症は人口の約1%が発症する比較的頻度の高い精神疾患で、幻覚妄想などの陽性症状、意欲低下などの陰性症状、認知機能低下などが認められて社会復帰が困難となる例も少なくありません。その病態解明、治療法の確立は喫緊の課題ですが、統合失調症の病態は多岐にわたるため十分に研究がなされていないのが現状です。本研究では複数の統合失調症ハイリスク遺伝子の改変動物を用いて、統合失調症の早期、発症期、進行期の縦断的な解析を行っていきます。統合失調症で共通する病態および進行に関わる分子を解明し、新たなバイオマーカー・治療ターゲットを創出することを目指しています。

高活性と安全性を両立する中枢神経標的の核酸医薬の技術基盤の創出
大学院医歯学総合研究科 脳神経病態学分野 特任助教
核酸医薬は標的遺伝子の発現制御やスプライシング制御を行う、従来の低分子医薬や抗体医薬とは一線を画す新たな創薬モダリティです。これまで治療法のなかった多くの疾患モデルにおいて、核酸医薬による病態改善効果が認められています。特にアンチセンス核酸(ASO)は神経難病に対し臨床応用が注目されています。したがってヒトへの臨床応用を見据えた時、有効性と安全性を同時に担保するASO技術の開発が望まれます。ヘテロ二本鎖核酸(HDO)はユニークな二本鎖構造を持つ核酸医薬で、東京医科歯科大学発の独自技術です。本研究ではこの技術をさらに発展させ、様々な人工核酸を組み合わせることで、中枢神経で高い活性と安全性を担保する次世代HDOの創生を目指します。

ポリグルタミン病SCA6の病態におけるタンパク質分解機構GOMEDの重要性とそれを応用した治療法開発
高等研究府 病態細胞生物学研究室 プロジェクト助教
SCA6はCACNA1A遺伝子におけるCAG配列の異常伸長により、ポリグルタミン(polyQ)が付加されたCav2.1(Cav2.1-polyQ)が蓄積し、小脳のプルキンエ細胞の変性・脱落を引き起こす。病状は患者の環境によって変化し、その理由としてポリグルタミンタンパク質の細胞内分解の重要性が指摘されているが、Cav2.1-polyQの分解機構は不明である。申請者のグループは、ゴルジ体関連分解(GOMED)経路を新たなタンパク質分解機構として発見し、これが細胞外または細胞膜タンパク質の分解および神経細胞維持に関与していることを明らかにした。SCA6治療タンパク質は細胞膜タンパク質であり、ゴルジ体を介して輸送および発現されるため、GOMEDがSCA6疾患に関与している可能性があると考えられる。本研究では、遺伝性神経変性疾患であるSpinocerebellar Ataxia 6(SCA6)の病態メカニズムを解明し、新たな創薬開発を目指す。

筋萎縮性側索硬化症の原因タンパク質TDP-43の凝集抑制を目的とした新規アプタマーの創出
大学院医歯学総合研究科 脳神経病態学分野 プロジェクト助教
筋萎縮性側索硬化症(ALS)は、主に運動神経が障害され、全身の筋力が低下し人工呼吸器を使用しない場合平均して3−5年で死に至る重篤な疾患です。しかしながら非遺伝性のALSに対する有効な治療法は確立されていません。TDP-43タンパク質は95%以上の非遺伝性ALS患者の方の神経細胞内で異常な凝集体を形成しており、ALSの病態への関与が強く疑われています。当分野ではALSの治療法開発を目標とし、TDP-43の凝集を抑制する核酸医薬の開発を進めてきました。本班では更に発展させ、新規の構造をもち、より有効性の高い核酸の開発を進めています。その作用機序の詳細な解明とともに、薬としての有効性・安全性を改善させ、ALSの治療法開発へとつなげることを目指しています。

核酸高次構造を標的としたリピート伸長病の創薬研究
リサーチインフラ・マネジメント機構バイオサイエンスセンター 御茶ノ水リサーチファシリティ 助教
近年、難治性神経疾患であるリピート伸長病の疾患原因の一つとして、グアニン四重鎖(G4)と呼ばれる特殊な核酸の高次構造が着目されています。一部のリピート伸長病の原因遺伝子は、グアニン豊富な繰り返し配列を有しており、G4の形成とそれに結合するタンパク質が集積することで、リピート伸長病の発症に繋がることが報告されました。そこで本研究課題では、原因遺伝子上で形成されるG4と結合タンパク質との相互作用を阻害する低分子化合物を探索し、そのモダリティ化を行うことでリピート伸長病に対する創薬シーズ化合物の取得を目指します。

新規オートファジー関連因子 BCAS3 を原因因子とする HEMARS の発症機構解明
難治疾患研究所 機能分子病態学分野 学振特別研究員 PD
オートファジーは、不要なものを分解して細胞の健康状態を保つシステムです。神経系の細胞にとって細胞内恒常性の維持は極めて重要であり、オートファジー遺伝子の変異によって発症する神経疾患も知られています。本研究では、我々がオートファジー膜に集積するタンパク質として同定し、その後、神経発達障害の原因として報告された新規オートファジー関連因子を扱います。単一遺伝子の変異による遺伝性疾患の治療法確立には、その変異がどのような遺伝子産物を生み出し、どのような分子機能の破綻または獲得が病態を引き起こすのかを理解することが必要です。分子機能と病態の解析を並行して進め、治療法創出につながる足がかりを得ることを目指します。
過去の公募班
難治性精神疾患におけるシナプス分子に対する自己抗体病態の解明と治療法の開発
大学院医歯学総合研究科 精神行動医科学分野 テニュアトラック准教授
神経変性疾患モデルiPS細胞とAIを用いた細胞死の予兆検知
難治疾患研究所 神経病理学分野 講師