
医化学
瀬川 勝盛
本分野では、「どのように細胞は恒常性を維持しているのか?」という疑問に基づいた基礎医学・生物学研究を進めています。順遺伝学は、仮説を立てず、表現型に“実際に”関与する遺伝子を同定する手法であり、多様な細胞機能を理解する上で強力な実験系です。現在は、膜脂質の恒常性維持のメカニズムに注目し、順遺伝学の手法を用いてこれらの現象に関与する遺伝子を同定すること、同定した遺伝子に変異をもつ患者さんの病態を明らかにする研究を進めています


未来生命科学、病態制御科学、バイオデータ科学の3部門17分野、フロンティア研究室、ジョイントリサーチ部門及び大学院教育研究支援実験施設についてご紹介します。
未来生命科学研究部門は、生命現象の基本的なメカニズムの研究を通じて、新しい医療を切り拓くことを理念とします。この理念に基づいて、疾患ES細胞/iPS細胞、がん幹細胞、オルガノイドや疾患モデル動物、質量分析技術を含む最先端の生物試料や手法を開発・駆使すること で、難治疾患の病因の発見、病態の解明、ならびに、診断法・治療法・予防法の開発基盤を築きます。疾患の学理と応用の研究を展開し、本学の指定国立大学法人化に伴い掲げられた「創生医学研究」の推進に貢献します。


医化学
本分野では、「どのように細胞は恒常性を維持しているのか?」という疑問に基づいた基礎医学・生物学研究を進めています。順遺伝学は、仮説を立てず、表現型に“実際に”関与する遺伝子を同定する手法であり、多様な細胞機能を理解する上で強力な実験系です。現在は、膜脂質の恒常性維持のメカニズムに注目し、順遺伝学の手法を用いてこれらの現象に関与する遺伝子を同定すること、同定した遺伝子に変異をもつ患者さんの病態を明らかにする研究を進めています

病態生理化学
当研究室では、多様な脂質の構造と機能に着目した医学・生物学研究を進めています。脂質が生命現象を司る機序を紐解き、脂質代謝や脂質シグナリングの破綻により出現する病態を解明することで、難治疾患の治療標的や診断・層別化に有為な生体分子の同定を目指します。

発生再生生物学
「細胞社会である組織や器官がどのような仕組みで形成され、そして機能発現体として維持されるのか」という課題を、情報のやり取り(シグナル伝達)の観点から、発生工学・遺伝学・細胞生物学・分子生物学・生化学などの幅広い実験手法を駆使しながら解明することを目的としています。

分子細胞生物学
細胞の運命決定は、細胞外に存在する様々なシグナルを、個々の細胞が細胞内シグナル伝達を介して認識しそれに適した応答を選択することによって行われています。また、発生過程におけるシグナル伝達経路の理解が癌や高血圧症を含めた種々の疾患の発症機構を明らかにすることにもつながると考えられています。我々は発生過程の細胞の運命決定において重要な役割を担っている細胞内シグナル伝達経路に注目し、分子生物学、生化学的解析に加え、モデル生物としてXenopusを用いた機能解析を行っています。


統合生理学
統合生理学分野では、心臓・血管・免疫・神経・脳がつくる複雑なネットワークを研究しています。AIや数理データ解析、一細胞解析や光遺伝学、超小型デバイス、ロボット技術などの進歩により、細胞内の分子メカニズムから臓器間の相互作用、個体差、個体と社会との関係に至るまで多層的に解析できるようになりました。これまで別々に理解されてきた現象を統合し、新しい視点から病態や生理を包括的にとらえることが統合生理学の挑戦です。さらに私たちは、この知見を医学・生命科学の発展に結びつける研究を展開しています。
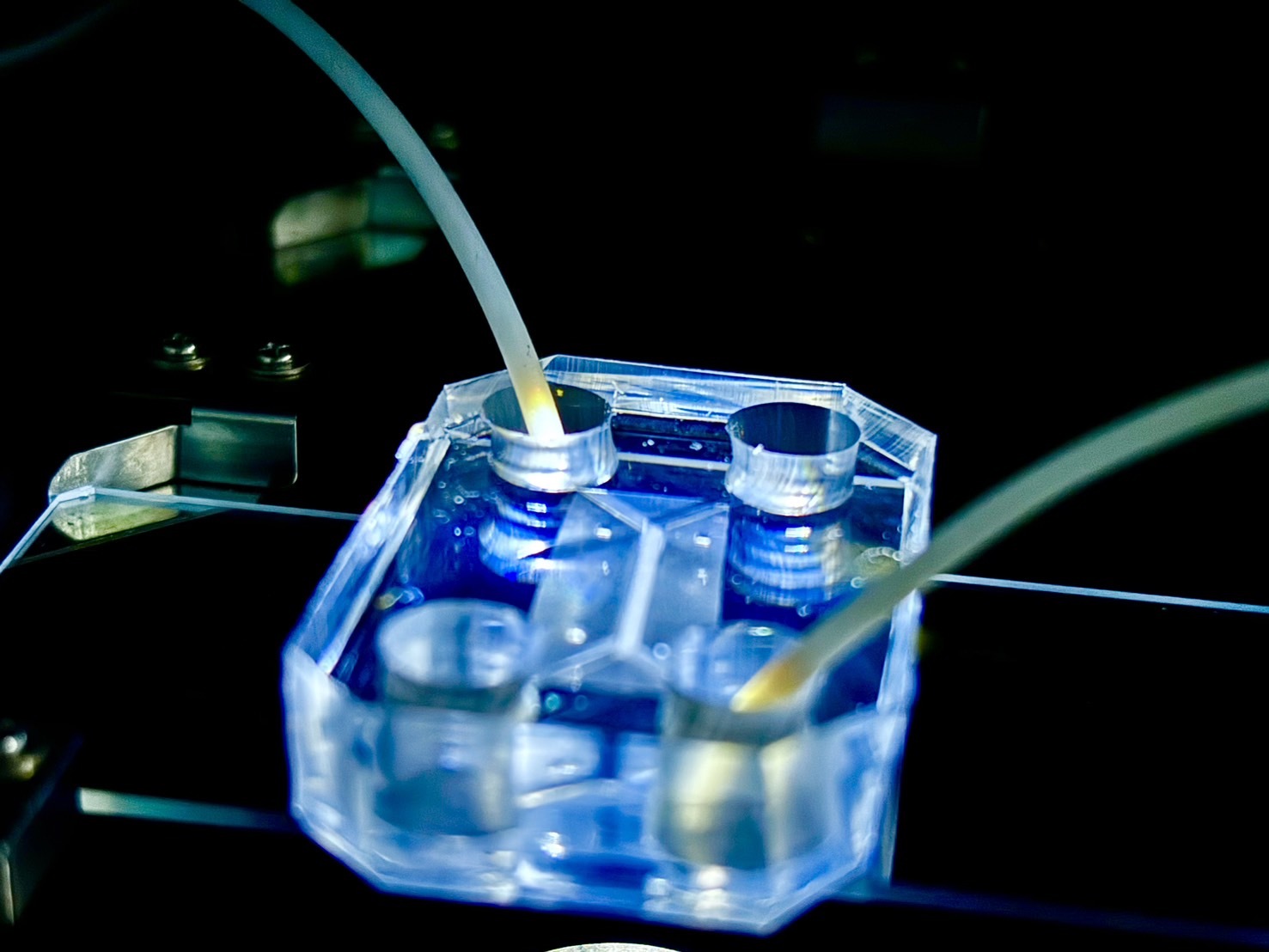

人体模倣システム学
本分野ではiPS細胞やオルガノイド、生体模倣デバイス(臓器チップ)を用いてヒトの臓器を生体外で創出する研究を行っております。主に、呼吸器と腸管、肝臓を対象とした研究を実施しています。開発した臓器モデルを用いてウイルス感染症や炎症、線維症のための創薬研究を進めています。臨床予測性の高い創薬技術を開発し、難治疾患の理解を深め、新たな治療薬を創出することを目標としています。
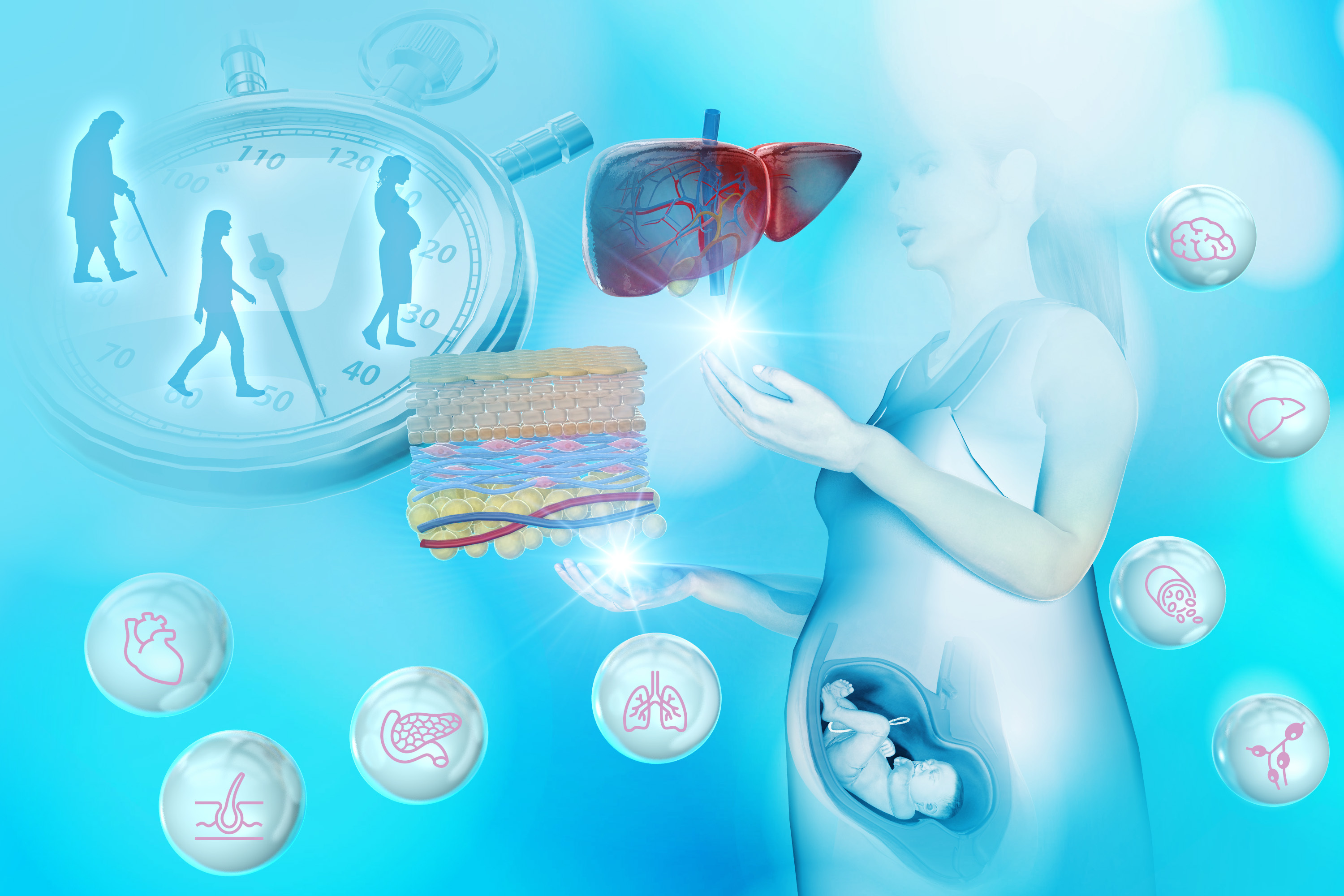

恒常性医学
体内の臓器は、ライフステージに伴う体の生理変化に応じて形態と機能を変化させます。この臓器リモデリング機構は体の恒常性維持に必須であり、その破綻によって様々な病態変容がもたらされます。本分野では、「妊娠」と「老化」における臓器リモデリング機構について、組織幹細胞、多臓器連関、メカノバイオロジーの観点から研究を進めています。母体臓器リモデリングと胎児の発生・疾患との関連について検証するとともに、生理的な臓器リモデリング機構を利用した、再生医療やアンチエイジング技術開発を推進しています。
難治疾患とは、病因や病態形成機序が不明であり、有効な予防法や治療法がない疾患の総称です。病態制御科学研究部門では、難治疾患の病因・病態形成機序の解明を通じて、生命現象の基本メカニズムの理解を深めるとともに、新たな診断法、治療法、予防法の開発を行っています。 本研究部門は現在6つの分野から構成されており、指定国立大学に認定された本学の重点研究領域「難治疾患研究」「口腔科学研究」に貢献しています。
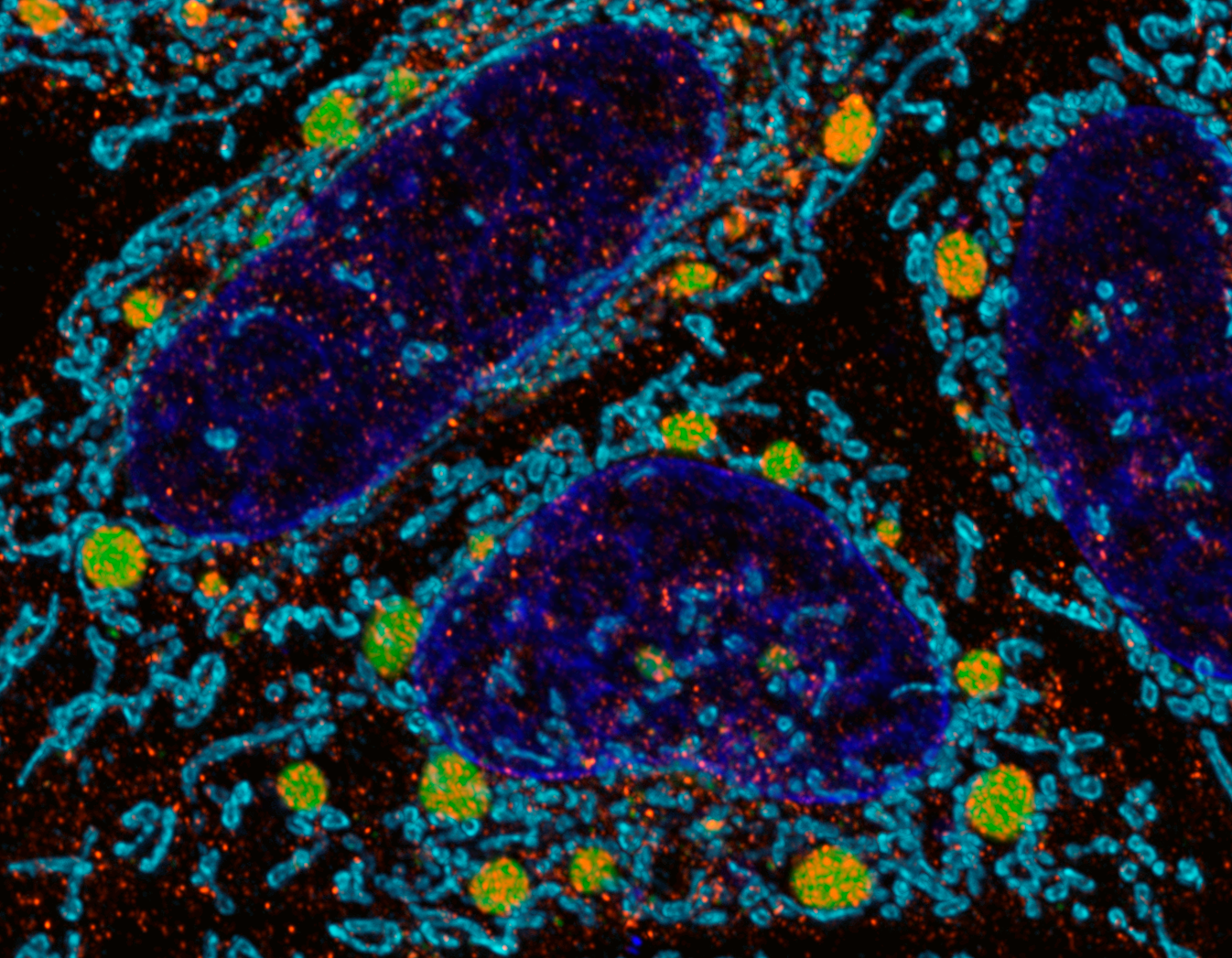

機能分子病態学
本分野では、生体内の様々な機能分子の破綻が難治疾患を引き起こすメカニズムを研究しています。分野を代表する研究としては、PINK1 やParkinがユビキチン化を介して損傷ミトコンドリアをオートファジー分解に導く仕組みを解明し、このプロセスの破綻が遺伝性潜性パーキンソン病の発症につながることを提唱してきました。これからも、ユビキチン依存性オートファジー・アミノ基の翻訳後修飾・オルガネラ品質管理・マイトファジーなどをキーワードに据えて、遺伝性潜性パーキンソン病を含む難治疾患の発症メカニズムを研究していく予定です。

生体防御学
生体の防御と恒常性維持の統合的理解」に焦点をあて、免疫細胞や組織幹細胞の分化や機能を解明することを目的にしています。主として、樹状細胞・マクロファージ・ミクログリアなどのミエロイド系細胞や、血液・腸・皮膚・舌・食道・腸などの幹細胞や癌幹細胞を研究対象として、難治性疾患の病態解明と予防法・治療法の開発を目指しています。
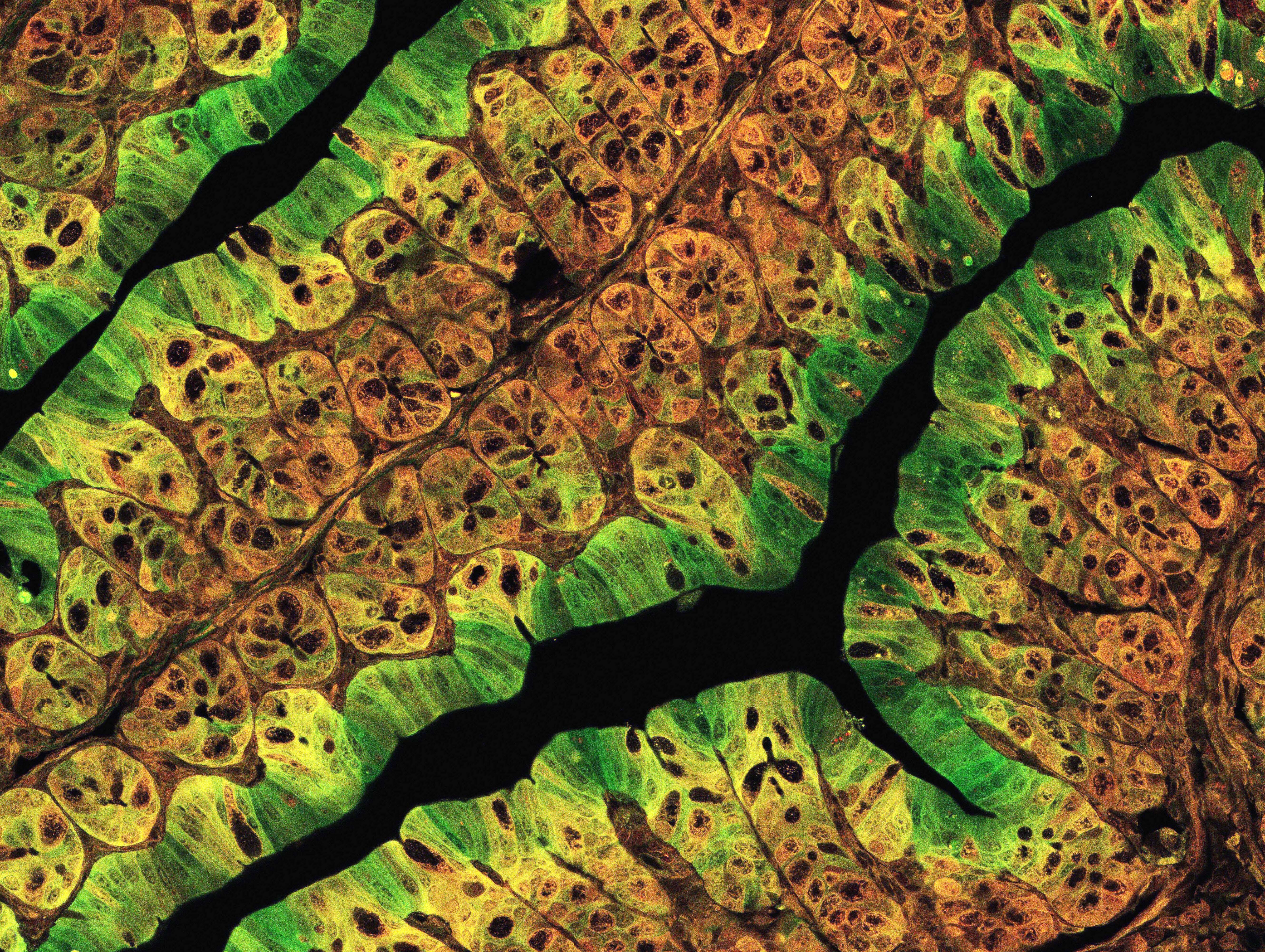

細胞動態学
多細胞生物では、さまざまな種類の細胞が複雑に相互作用することによって、細胞集団としての生命体が維持されます。本分野では、多細胞生物を構成する細胞の多様性を理解し、その動態を制御する科学技術の開発を目指した研究を推進しています。特に、がん化の過程や個体発生における細胞動態に注目し、個々の細胞の運命決定機構や細胞間相互作用を通じた細胞集団としての振る舞いの解明に取り組んでいます。

免疫制御学
個体の健康を維持するために必須である免疫システムに着目し、免疫細胞と組織構成細胞の相互作用の解析を通して、免疫恒常性の維持・破綻機構の解明に向けた研究に取り組んでいます。とくに病原性T細胞と組織特異的な間葉系細胞、およびその相互作用に焦点をあて、自己免疫疾患をはじめとする難治疾患の病態解明や制御法の開発につなげることを目指しています。


神経炎症修復学
脳卒中や認知症は、要介護になる主要因であり、世界的に患者数の増加が見込まれています。しかしながら脳卒中や認知症に対する治療薬開発はまだ十分ではなく、失った脳機能を取り戻す手段に乏しい難治疾患の代表例として挙げられます。脳が損傷すると炎症が引き起こされますが、次いで脳内では修復プログラムが発動し、一定の脳機能回復が見込まれます。私達は、このような脳に備わった自然な回復メカニズムを強化・持続させることによって、脳機能の回復を可能とする治療法の開発を目指しています。
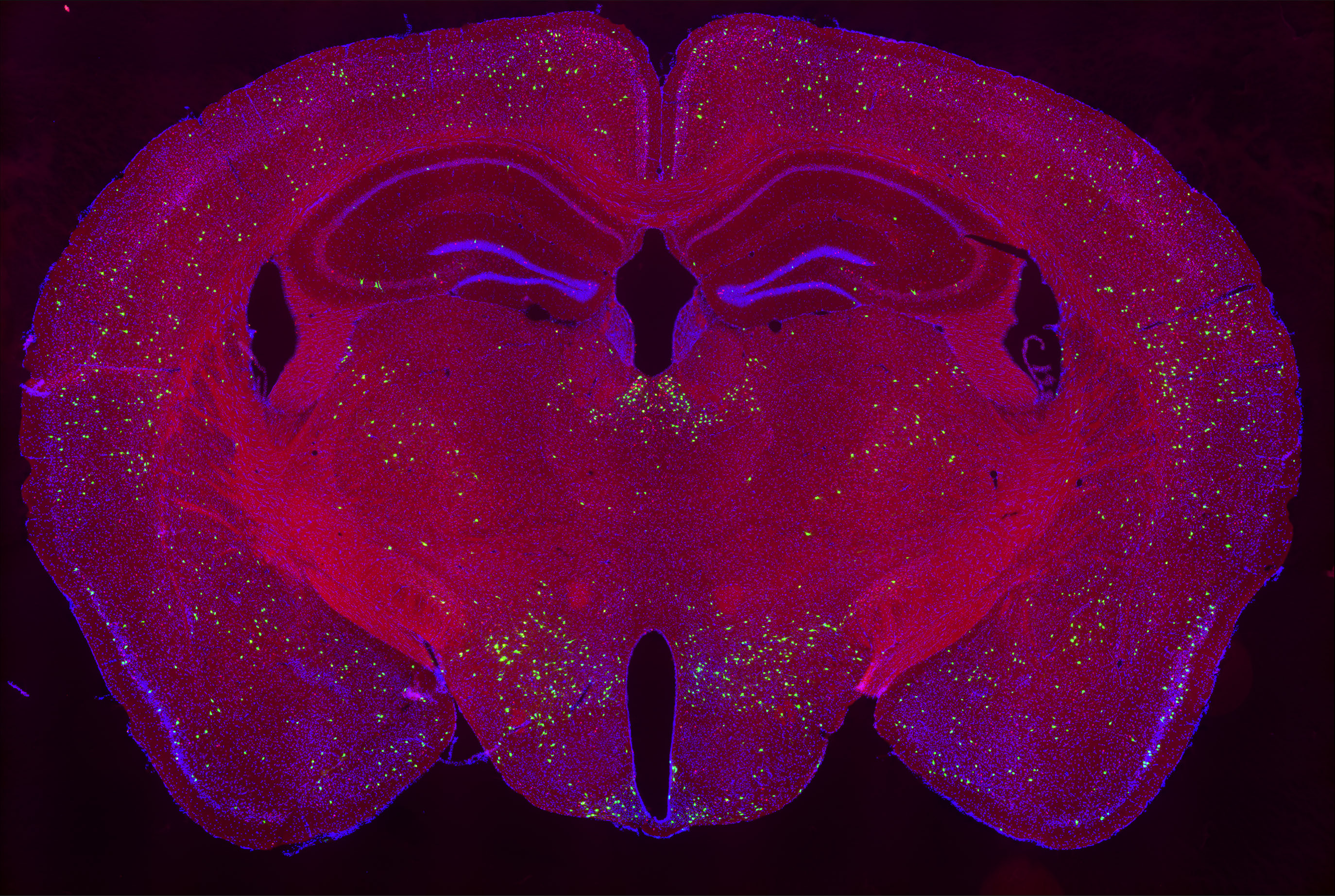

統合ストレス医科学
心理・社会的ストレスは精神・神経疾患や身体疾患の発症リスクを増大させます。しかし、ストレスが生体に及ぼす影響とそのメカニズムについてはよくわかっていません。また、ストレスに対する応答は個人により大きく異なります。当分野ではストレスによる行動変容の多様性創発メカニズムをエピゲノム・分子・細胞・神経回路の多階層レベルで解明し、ストレス性疾患の病態解明や治療法・予防法の開発をめざします。特にストレス環境下でも”元気な状態”を維持するレジリエンスのメカニズム解明研究を通じて、逆境でも発症・再発を予防する医薬品等の研究開発に挑戦します。
バイオデータ科学研究部門では、ゲノム、トランスクリプトーム、プロテオームなどのオミックスデータや、単一細胞解析、分子構造解析、生体イメージングなどの最新解析技術によって得られるバイオデータを、AIなどの最新のデータサイエンスで統合解析することによって、疾患の病因解明や、画期的な治療法の開発につなげることを目指しています。 さらに、これらのバイオデータを基に、「病気への罹りやすさ」といった、これまで体質と呼ばれてきたものを科学的に解明することで、個別化医療の実現や、疾患予防法の開発を目指します。


分子構造情報学
X線結晶構造解析を主たる研究手段として、生体高分子、特にタンパク質の立体構造や関連した物理化学的な性質の研究を行うことにより、その機能を原子レベルで理解することを目的としています。低分子化合物との複合体の研究を通して、創薬への貢献も目指しています。PDBjのメンバーとして、タンパク質立体構造データベース(PDB)の高度化プロジェクトを推進しています。

ゲノム機能情報
ヒトゲノムの機能を解明する次世代の実験技術とデータサイエンス技術を開発し、難治性疾患の病態解明やその治療・診断への応用を目指します。誰も達成できなかった精度や規模で生命現象を計測・制御するゲノム科学実験技術と、それによって得られるデータから生命情報を抽出する新しいデータ科学技術を開発します。


ゲノム機能多様性
免疫アレルギー疾患・生活習慣病・癌などの多因子疾患は、個人間の遺伝子配列の違い、すなわち遺伝子多型が積み重なることによって発症に至ります。ゲノムワイド関連解析(GWAS)によって、様々な疾患の感受性遺伝子多型が明らかにされましたが、病態解明は道半ばです。本分野では、ヒトゲノム、エピゲノム、トランスクリプトームなどの様々なビッグデータを用いた解析に、ロングリード・シークエンシング技術や分子生物学的手法を用いた解析を統合することによって、遺伝子多型によってもたらされるゲノム機能の多様性を理解し、多因子疾患の病態解明を行います。また、個人のゲノム情報に基づいた病態や薬剤応答性の予測法を開発し、いわゆるプレシジョン医療の確立を目指します。


ロボット科学
ロボットやAIとともに「新しい科学研究のありかた」をつくることを目指し、生命科学研究における自動化技術の開発と、その基盤となる学問体系の構築に取り組んでいます。分子生物学や細胞生物学にロボットやAIを導入することで、人間の手だけでは成しえなかった実験や研究を実現します。さらに、多数のロボットを連携させた大規模実験施設の実現を視野に入れ、次世代の研究環境を切り拓くための技術開発を進めています。
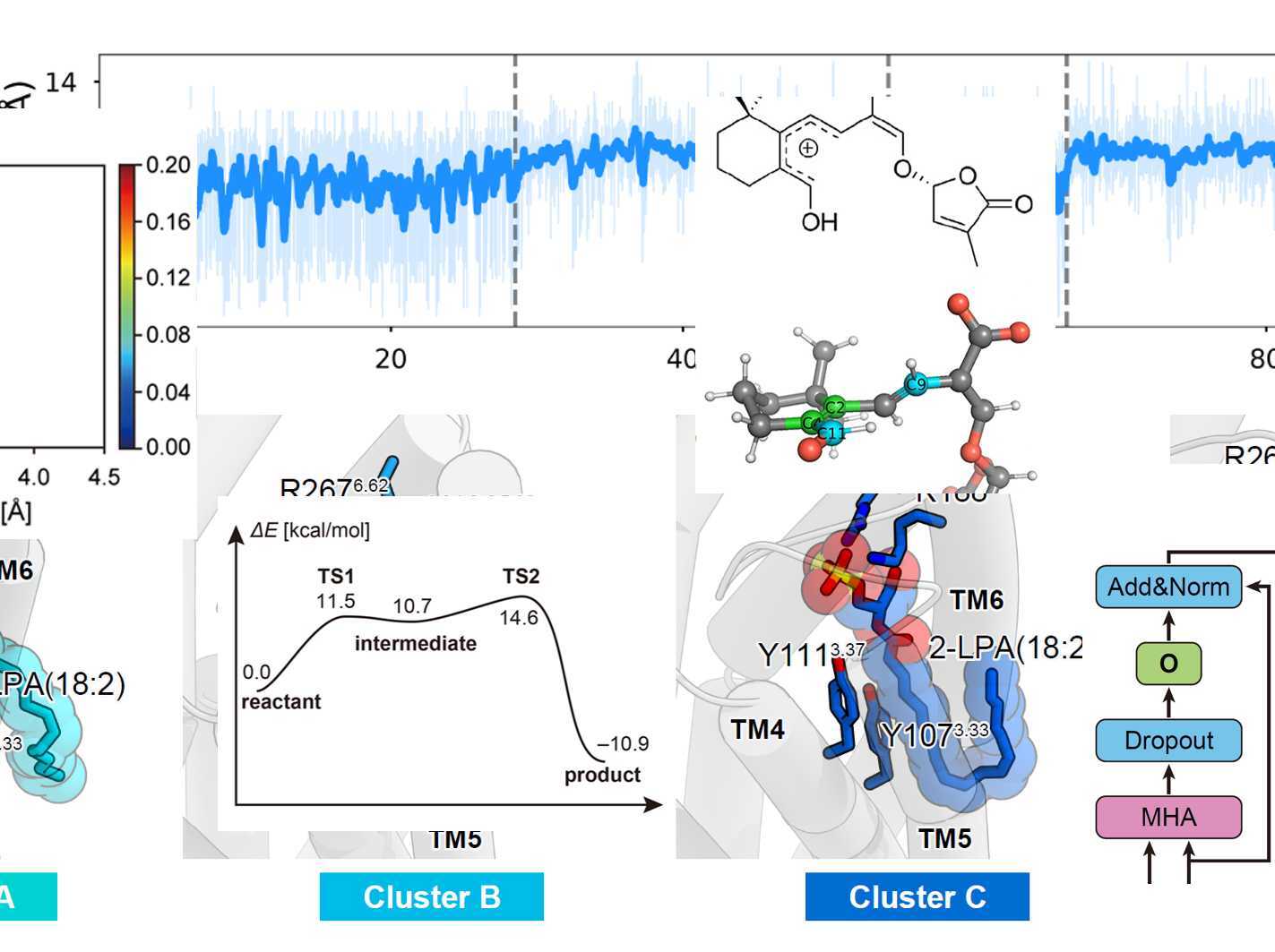

計算創薬科学
私たちの研究室では、計算物理化学的アプローチと情報科学的アプローチを組み合わせることで生命現象を理解することを目標とし、研究を進めています。計算物理化学では分子動力学シミュレーションや量子化学計算を用い、情報科学では機械学習や構造インフォマティクスを活用することで生体分子の設計や制御方法を開発し、最終的には創薬へとつなげることを目指します。また、研究の効率化を図るため、計算結果と実験データを自動的に連携させる実験自動化システムの開発にも力を入れています。

先端ナノ医工学
核酸医薬、遺伝子治療、さらにはmRNAワクチンなど新規モダリティが次々と実用化され、『薬』の概念が変わりつつあります。本分野では、特にmRNAワクチン、医薬を中心として、これらの新しい『薬』を体の中で狙い通りに機能させるナノDrug Delivery System (DDS)の開発から、その疾患治療への展開、社会実装まで取り組んでいます。また、このような応用研究の中で垣間見られる面白い生命現象を探究しています。

計算システム生物学
最先端のデータサイエンスや深層学習を機軸に、膨大な生命情報を読み解くための統計モデルや情報解析技術を開発し、生命現象や疾病の理解に資する医学研究を行っています。特に、最先端シークエンス技術によるゲノムや遺伝子発現などのオミクス情報や生体イメージングによる画像情報から、生命システムの動作原理をボトムアップに解明するために、数理科学と医学との融合を推進し、医療イノベーションを引き起こす研究を進めています。
難治疾患研究所では、研究所に所属する教員が部門や分野の枠を超えた共同研究体制を構築し、難病研究のさらなる推進を図るために、平成25年度に難病基盤・応用研究プロジェクト室を設置しました。 難病基盤・応用研究プロジェクト室では、難病に係る基礎研究や新たな研究技術の開発・進展等を主眼とする基盤研究、これまでに得られた基礎研究の成果(シーズ)を発展させ医療応用に至る開発を主眼とした応用研究、基盤研究と応用研究との連携発展を目的とする基盤・応用研究などを推進することとしています。
本施設は⼤学院教育の支援だけでなく所内の研究者が共通した研究機器を使⽤できること、日々進歩していく解析機器の設置と技術教育に対応していくことを目的として運営されています。 また、研究所による本学研究のサポート、所内-本学他部局の研究連携を目指して、所外の学内研究者の利用・受注も積極的に推進しています。さらに、難治疾患研究所は文部科学省から「難治疾患共同研究拠点」に認定されており、研究所を訪れた共同研究者の利⽤・受注、さらにはそれ以外の学外研究者からの受注も行い、研究者コミュニティーへの貢献も目指しています。