CRISPR
CRISPRとは
CRISPRとはClustered Regularly Interspaced Short Palindromic Repeatsの略で、近年原核生物でファージやプラスミドに対する獲得免疫機構として機能していることが判明したDNA領域のことを指します。図のようにCRISPRはリピート配列とスペーサー配列という2種類のDNA配列の繰り返しによって構成されていて、リピート配列は同一のCRISPR内では共通した配列だが、スペーサー配列はそれぞれ特異的な配列をしているという特徴があります。CRISPRの上流にはリーダー配列と呼ばれるAT richな領域が存在し、さらに上流にはCRISPR-associated genes(cas遺伝子群)が存在します。ファージやプラスミドが侵入してくると、Cas1タンパク質がProto-spacer Adjacent Motif(PAM)配列を認識してその上流数十bpを切り取り、リピート配列とともに自身のCRISPR領域の上流側に挿入します。このCRISPR領域は一連のpre-crRNAとして転写された後、Casタンパク質複合体によってリピート配列が切断されてcrRNAとなります。crRNAは別のCasタンパク質と複合体を形成し、スペーサー配列と相補的な配列を認識、切断除去します。
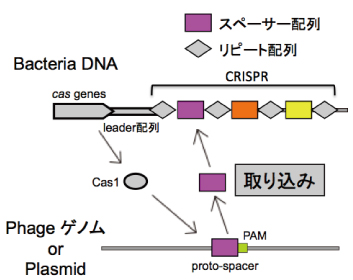
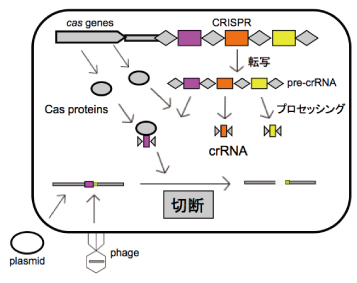
CRISPR/Casシステムによる新規スペーサー獲得機構と外来ゲノム排除機構
分類
2007年、Victor Kuninらの研究により、多くのCRISPRはリピート配列の相同性によって12種類に分類できることがわかりました。そしてそのうち6種類のリピート配列はパリンドローム構造を保有していて、ステムループ構造をとることがわかりました。また2005年、Daniel H. Haftらの研究により、CRISPR/Casシステムはcas遺伝子群の構成の類似性から8種類のサブタイプに分類することができることがわかりました。しかし同じCRISPR分類であってもCRISPR/Casシステムのサブタイプが異なっていたり、逆に同じCRISPR/CasシステムのサブタイプであってもCRISPR分類が異なっていることがあるので、両者の関係は謎なところが多いのが現状です。またCRISPRの中には12種類の分類に属していないものが多数存在することもあり、今後の研究によってこれらが解明されることを期待したいです。
なぜA群レンサ球菌のCRISPRを研究しているのか
A群レンサ球菌はゲノム内に2〜8個のプロファージ領域をもつグラム陽性菌です。このプロファージ領域にはヒアルロニダーゼやスーパー抗原といった病原性因子が多数存在しているため、A群レンサ球菌は保有するプロファージの種類によって病原性が大きく変化すると言われています。一方でA群レンサ球菌はCRISPR/Casシステムも保有していることがわかっています。当研究室で行った比較ゲノム解析の結果、A群レンサ球菌のCRISPR/Casシステムは2種類存在し、どちらもファージを排除する機能を有していることがわかりました。このことからA群レンサ球菌はCRISPR/Casシステムによってファージを選択的に取り込んで進化してきた珍しい生物であることが推察されます。したがってA群レンサ球菌のCRISPR/Casシステムを研究することはA群レンサ球菌の進化戦略を明らかにするだけでなく、CRISPR/Casシステムの新しい可能性を見いだすことにつながると言えるでしょう。
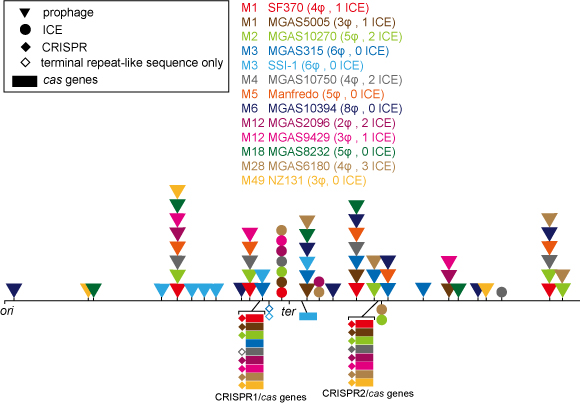
A群レンサ球菌ゲノム内のプロファージ領域とCRISPR/Casシステム
CRISPR/Casによるゲノム編集
近年、様々な生物種において標的の遺伝子を改変する技術として、人工ヌクレアーゼ(ZFNやTALEN)を利用した「ゲノム編集」が注目されている。ゲノム編集は、標的遺伝子のノックアウト(破壊)やレポーター遺伝子のノックイン(付加)が可能であり、あらゆる生物種、様々な培養細胞に利用可能であることから、次世代の遺伝子改変技術として期待されている。 さらに最近、新しいゲノム編集としてCRISPR/Casシステムを利用した技術が登場した(CRISPR/Casシステムについては別項参照)。本研究室では、このCRISPR/Casシステムによるゲノム編集技術を確立、改変することで、より手軽なゲノム編集技術の構築を行い、細菌ゲノムの編集、哺乳類培養細胞での遺伝子ノックアウトに成功している。





