(English | Japanese)
 石野研究室
石野研究室
東京医科歯科大学難治疾患研究所・エピジェネティクス分野
〒113-8510 東京都文京区湯島1-5-45tel: 03-5803-4862 fax: 03-5803-4863
(医歯学総合研究棟II期 23階 map)
 石野研究室
石野研究室ヒトをはじめ多くの生物種のゲノム配列が明らかにされてきました。しかし、これらのゲノム配列情報に書き込まれている“ゲノム機能”を読み解くのはこれからの科学の仕事です。生物にかかわる重要問題の多く、例えば細胞分化・個体発生・形態形成・脳機能そして生物進化という問題は、“ゲノム機能”という観点から理解されるものだと考えます。
私達の研究室では、ジェネティクスとエピジェネティクスを統合した観点から “ゲノム機能”を解析しています。ジェネティクスは普通には“遺伝学”と訳されます。これは遺伝子の変異による機能変化の遺伝を扱う学問で、遺伝子という物質の変化と生物の表現型という生命現象の因果関係を結ぶことを可能にした、現代生物学の基盤となる学問です。一方、エピジェネティクスは最近注目を集めるようになった学問分野ですが、ここでは遺伝子の発現調節に関わる情報の遺伝を扱います。遺伝子自身には変化を起こさないため、従来のジェネティクスの範疇には入りません。しかし、どちらも子孫の表現型に大きな影響を与えることには違いありません。「遺伝学をジェネティクスとエピジェネティクスを統合した観点からとらえ、生物現象を解釈して行くこと」を研究室の方針としています。
研究テーマには“哺乳類特異的ゲノム機能”の解明というものを掲げ、ヒトを含む哺乳動物の個体発生機構と生物進化機構の謎に迫っています。具体的な研究テーマとしては、哺乳類特異的遺伝子発現調節機構(エピジェネティックな問題)としてゲノムインプリンティング、体細胞クローン動物の解析、哺乳類特異的遺伝子群の機能(ジェネティックな問題)として哺乳類特異的なレトロトランスポゾン由来の遺伝子群の個体発生における体系的な機能解析を行っています。そして、これら哺乳類特異的遺伝子群やエピジェネティック機構が哺乳類の進化にどのような役割を果たしたのかという問題についても研究を進めています。
メンデルの遺伝法則は現代の分子生物学の基礎となっている重要な法則です。しかし、近年になって哺乳動物にはこの法則に従わない遺伝子群が存在しており、ヒトにおいても様々な遺伝病の原因となっていることがわかってきました。父親・母親由来のゲノムからのみ発現するPeg (Paternally expressed genes) 遺伝子群とMeg (Maternally expressed genes) 遺伝子群をあわせてインプリンティング遺伝子と言いますが、このような相補的に発現する遺伝子群が哺乳類ゲノムには存在します(図1)。
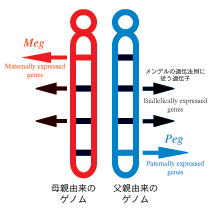
図1 インプリンティング遺伝子
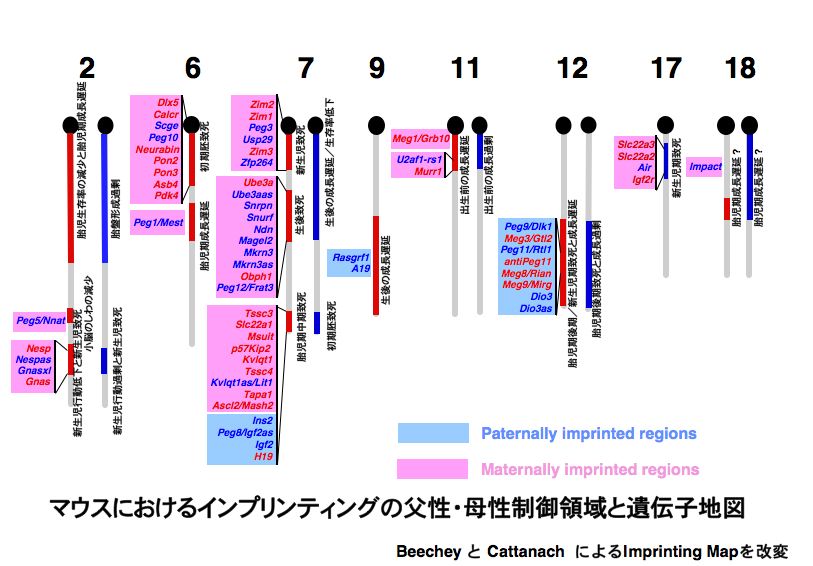
図2 インプリンティング遺伝子マップ
マウスの染色体(灰色)の一部が父親性2倍体(青)、母親性2倍体(赤)になると、さまざまな異常(出生前後の致死、成長異常、行動異常)が起こります。このような領域にはインプリンティグ遺伝子がクラスターをなして存在しています(インプリンティング領域)。一つまたは複数の遺伝子の機能欠失または発現過剰によって、これらの異常が起きています。インプリンティング領域は多くの場合 PegとMegを含んでいますが、個々の遺伝子ごとに発現が制御されるのではなく、領域単位で雄性または雌性生殖細胞系列(精細胞形成過程または卵子成熟過程)で刷込みが起きます(図3参照)。
私達の研究室では体系的なインプリンティング遺伝子の分離からこのような個体発生、成長、形態形成、精神行動に重要な遺伝子を同定し、その機能解析を行ってきました。また、これらの遺伝子の発現を体系的に解析することで、生殖細胞系列で起きるインプリンティング遺伝子の発現制御に関わるエピジェネティック記憶の消去過程を初めて明らかにしました(Lee et al.Development 2002/Nature Science update, Cells reprogram in 24 hours 参照)。これにより父親性インプリンティング領域、母親性インプリンティング領域がどちらもPegとMegから構成され、最終的に体細胞で片親性発現するまでのゲノムインプリンティングの体系が明らかになりました(図3)。
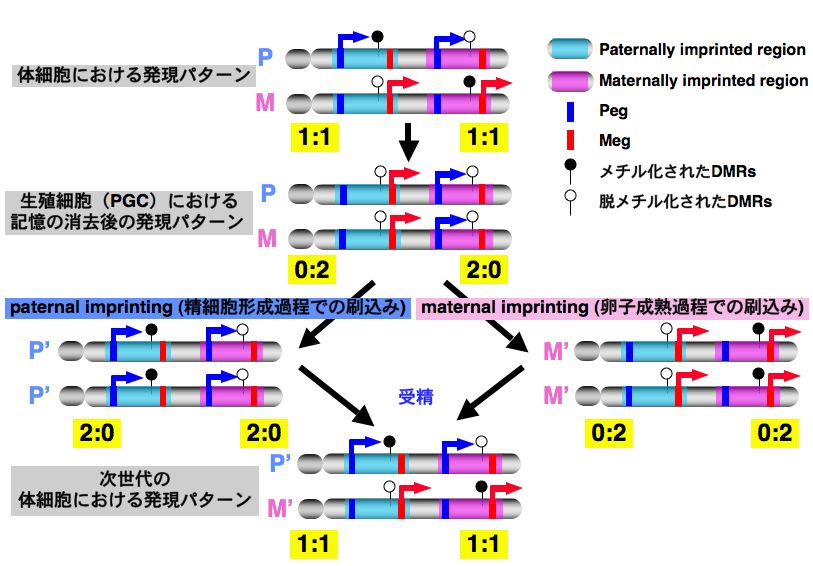
図3 インプリンティング記憶の再成立システムとコンプリメンテーション仮説
インプリンティング遺伝子は体細胞においては片親性発現を示します(PegとMeg)。これはインプリンティング領域におけるDMR(differentially methylated region)のメチル化によって制御され、体細胞系列ではエピジェネティックな記憶として一生残っています。この記憶は、次世代を作る生殖細胞系列で一度消去され、あらためて雄性・雌性生殖細胞系列で入り直します(paternally imprinted regionとmaternally imprinted region)。この図からわかるように、インプリンティング遺伝子の片親性発現は、単に片側の発現が抑制されるのではなく、DNAメチル化により、PegとMegの発現の逆転が制御されている、すなわち発現と抑制を同時に行うことによって成立している事がわかります。 哺乳類では、このように同じ領域に属するPegとMegは同時に発現することができません。インプリンティングによって父親・母親ゲノムの発現パターンが変ることによって、すべてのPegとMegの発現が保証されます。ゲノムインプリンティングの片親性発現は、すべてのインプリンティング遺伝子を発現させるための機構として機能していることがわかります(>コンプリメンテーション仮説)。
インプリンティング遺伝子には個体発生、成長、形態形成、精神行動に必須な機能を果たす遺伝子が多く含まれます。しかし、このような重要な遺伝子がなぜ哺乳類では片側しか発現しないのでしょうか?この問題は、哺乳類のゲノムインプリンティングの大きな謎でした。図3に示した体系から、哺乳類のゲノムでは、同じインプリンティング領域に存在するPegとMegは同時に発現することが出来ない事がわかります。爬虫類や鳥類では、これらの相同遺伝子が両親性発現をしていますので、おそらく哺乳類が成立する際にゲノム上に大きな変化が起き、これらの領域の遺伝子発現調節が変ってしまったのだと思われます(そのような証拠をゲノムから探している所です)。ですから私達はゲノムインプリンティングは、このような状況下でPegとMegの両者を発現させるため、父親ゲノムと母親ゲノムの機能を積極的に変えるシステムとして哺乳類に採用され、広く保存されてきたエピジェネティック機構であると考えています(コンプリメンテーション仮説)。すなわち、現在の個体発生システムにおいてゲノムインプリンティング機構の片親性遺伝子発現機構は必須の役割をはたしているのです。これが私達の考えているゲノムインプリンティングの生物学的意義です。それでは、このゲノムインプリンティング機構はどのようにして進化してきたのか?これについては 最近の研究成果:レトロトランスポゾン由来の遺伝子Peg10 の起源とゲノムインプリンティングの成立を御覧下さい。その一端が見え始めてきたと思っています。また、ゲノムインプリンティングの記憶の消去・再成立に関する分子機構の解明についても研究を進めています。
ご存知と思いますが、ヒトのゲノムの半分近くはレトロトランスポゾンに由来するDNAから出来てきます。これは哺乳類ゲノム全体に当てはまる性質です。このような一見ゴミと考えられるような配列が、高等脊椎動物のなかでも哺乳類に特に多く見られるという事実も、哺乳類ゲノムの大きな謎の一つです。哺乳類ゲノムにはレトロトランスポゾン由来の配列があちこちに入り込んでいるのです。これがゲノム領域の遺伝子発現制御を変化させるということがあっても不思議ではないと考えています。ゲノムインプリンティングではその制御に幾つかの“ゲノム機能単位”が働いています。このような“ゲノム機能単位”の組み合せとしてゲノムインプリンティングが制御できると考えています。
体細胞クローン技術は遺伝的に同一な個体群の作製を可能にします。この技術をもちいて作製した多分化能をもつクローンES細胞の樹立は、まさに21世紀の再生医療の成功の鍵を握っていると言えます。しかし、体細胞クローン動物は、生物学的にこれまで全く例の無い生殖様式で生まれてきた動物であり、この生物が本当に正常なのか?その個体発生において何が起きているのか?を正確に知ることが、この技術を安全に医学に応用するために必要です。
確かに体細胞クローン動物は、出生率は2%前後と低いものの、一見正常に生まれ、正常に生殖年齢に達するものがいます。私達の研究室が理化学研究所バイオリソースセンターの小倉淳郎室長のグループと共同で解析した体細胞クローンマウスの例を挙げると、少なくとも生まれてきたものに関しては、ほとんどが正常に発育します(Inoue et al.Science 2002/Nature science update, Cause of sick clones contested 参照)。しかし、この一見正常に見える体細胞クローンマウスの新生仔を用いて網羅的な遺伝子発現を行ったところ、驚くべき事に、これら遺伝的に同一な体細胞クローンマウスが、1匹ごとに異なる遺伝子発現パターンを示し、しかも、異常を示す遺伝子数は各個体で20−40%にものぼる事が明らかになりました(最近の研究成果:体細胞クローンの遺伝子発現は正常か?)。すなわち、エピジェネティックな意味ではクローンマウスは全くもって不均一な動物群であった事になります。
各個体でランダムに起きている(ように見える)遺伝子発現異常は、再生医療への応用を考える上で、解決されなければならない重要問題です。現在、上記の小倉淳郎室長のグループと理化学研究所発生・再生科学総合研究センターの若山照彦チームと共同で、遺伝子発現異常を起こしにくい体細胞クローン技術の開発を進めています。 また、体細胞クローンの個体発生過程を詳細に解析する事も重要な課題です。着床直後の時期で体細胞クローンマウス胚における胎仔と胎盤の形態解析から、ほとんどのクローン胚では胎盤組織と胎児組織のどちらにも多種多様な形態異常が見つかりました。また、一般には、体細胞クローンには胎盤の過剰形成が起きると信じられてきました(確かに生まれてきた体細胞クローンマウスでは、常に胎盤形成過剰が見られます)が、実際には、体細胞クローンの低成功率の原因は、胎児自体の異常に加えて胎盤形成不全が起きていることにありそうです(最近の研究成果:体細胞クローンマウスの初期発生の異常)。
生殖細胞系列では、ゲノムインプリンティング記憶だけでなく個体発生に関わるエピジェネティク情報のリプログラミングが起こります。有性生殖は、一回ごとに個体発生をリセットする方法なのです。一方、体細胞クローン動物では、このステップを省略して未受精卵に体細胞核を移植した際に起きる“初期化”にリプログラミングを任せていると言えます。逆に言えば、体細胞クローンマウスに見られる異常は、正常な生殖細胞系列で行われるリプログラミングの重要性を意味しています。ですから体細胞クローンマウスにおける異常な遺伝子発現パターンから正常な個体発生における遺伝子発現制御の制御体系が見えて来ると考えています(最近の研究成果:体細胞クローンの遺伝子発現は正常か?)。
哺乳類ゲノムの40-50%がレトロトランスポゾン由来の配列から出来ています。これらがゲノム中の単なるゴミなのか?何らかの意味(機能)をもっているのか?は明らかではありません。しかし、ゲノム配列の遺伝子ではない領域にも遺伝子発現調整に関わる重要な機能があることは間違いありません.ゲノムインプリンティングの制御のところでも述べましたが、そのような機能をもつゲノム機能単位を正確に同定して行く事が、今後の重要な課題です。今、タンパク質をコードしないRNAがゲノム中から発現していることが話題になっていますが、そのほとんどはこれらレトロトランスポゾン由来のゲノムに対応する部分だとも言えるのです。
一方で、レトロトランスポゾンの挿入は、新しいゲノム機能の源泉として生物進化に寄与したという考え方(exaptation)がS. J. Gouldらによって提唱されています。私達はゲノムインプリンティング遺伝子の探索からレトロトランスポゾン由来と考えられる遺伝子Peg10を2001年に報告しました。この遺伝子は、マウスで初期胚致死を引き起こすインプリンティング領域(6番染色体の近位部:図2参照)に存在しており、その表現型の原因候補遺伝子として分離したものです。そこでノックアウトマウスを作製して機能を解析したところ、この遺伝子が胎盤形成に必須な機能をもち、これが無くなるとマウスの発生が初期胚で止まってしまいました。すなわち、レトロトランスポゾン由来の遺伝子が、哺乳類の発生の特徴である胎盤形成に必須の機能を果たしている事が明らかになったのです(最近の研究成果:レトロトランスポゾン由来の遺伝子Peg10の個体発生における必須な機能)。Peg10は、ゲノム配列の報告されている哺乳類のすべての種に存在が確認されています。しかし、フグやニワトリのゲノムには存在していません。すなわち、高等脊椎動物の中で哺乳類特異的な遺伝子なのです。
最近、私達は、Peg10が有袋類(カンガルーやオポッサム等の哺乳類グループ)にも存在していること、しかし卵生の哺乳類である単孔類(カモノハシ)には存在してない事を明らかにしました(最近の研究成果:レトロトランスポゾン由来の遺伝子Peg10の起源とゲノムインプリンティングの成立)。これはPeg10のもとになったレトロトランスポゾンは高等脊椎動物の進化の中で、哺乳類が単孔類と獣類(有袋類と真獣類)に分岐した後で、挿入された事を意味しています。哺乳類といえば胎生という生殖様式が頭に思い浮かぶほど、特徴的な性質ですが実は、単孔類から獣類が分かれた後に挿入されたレトロトランスポゾンがこの胎生機構の進化に関係していたということになります(有袋類も胎生で、真獣類とは組織学的には異なる胎盤をもっています)。これは、Gouldの提唱したexaptationの哺乳類における実例となるものです。
もともとはレトロトランスポゾンであったこの遺伝子が現在のPeg10としての機能をいかにしてもつようになったのか?まさに生物進化の問題であり、また、タンパク質化学してもとても興味深い問題です。実は、哺乳類特異的なレトロトランスポゾン由来の遺伝子はこれ以外に10個存在しています。もしかしたら、これらの遺伝子が哺乳類という動物群を特徴づける性質をもたらしたのかもしれません。この可能性を検証するために、これらすべての遺伝子についてのノックアウトマウスによる機能解析、それらの由来を調べるために有袋類・単孔類のゲノム解析、タンパク質の構造解析等を総合的に進めています。
個体発生システムと生物進化(系統発生)の関係は、生物学の中でも重要なテーマの一つと考えられてきました。多くの種の生物のゲノム配列が明らかにされ、幾つかのモデル動物では遺伝子操作による遺伝子機能解析が可能になった現在において、実験科学として成立するテーマだと考えています。
研究室では新しい生物学へ挑戦する意欲のある学生、大学院生、ポスドクを歓迎しています。