 石野研究室
石野研究室
東京医科歯科大学難治疾患研究所・エピジェネティクス分野
〒113-8510 東京都文京区湯島1-5-45tel: 03-5803-4862 fax: 03-5803-4863
(医歯学総合研究棟II期 23階 map)
 石野研究室
石野研究室体細胞クローンは、その元になった個体と全く同じ遺伝情報を持った個体を作り出そうとする技術です。言ってみれば、歳の違う一卵性双生児を作ることにあたります。
私たちはこれまでマウスの体細胞クローンを材料に、遺伝子発現がどの程度正常なのかを調べてきました。クローンマウスは他の哺乳類のクローンと同様に出生に至るまで成長できる個体は2〜5%とごくわずかです。また、外見上正常に生まれてくる個体でもほとんどの場合胎盤の大きさが2倍以上も大きくなり、胎盤で遺伝子の発現を調べると非常に多くの異常が認められます(Science 2002)。 一方、外見上正常に生まれてくる個体は出生後も正常に成長し、次の世代の子供も生むことができます。しかし、一見正常に見えるこれらのクローンも、高頻度に肥満がみられたり、また寿命が短いなどの問題も報告されています。実際、これら外見上正常に見えるクローンの遺伝子発現は正常なのでしょうか。
今回、脳、肝臓、腎臓の三つの臓器で新生児期にどの程度遺伝子発現が正常であるか、およそ1万の遺伝子についてDNAマイクロアレーの技術を用いて解析を行いました(機能がまだ良く分かっていないものや名前がつけられていないものまで含めても蛋白質をコードしている哺乳類の全遺伝子の数は3万から4万の間と考えられています)。
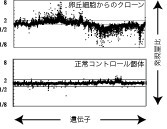 その結果どの個体でもこの三つの臓器のどれかでは10%から40%もの遺伝子が2倍以上の発現量の増加あるいは減少を示していました。これは普通の生殖による個体でのばらつきが3%程度の遺伝子に収まるのに比較して非常に大きな数字です。またクローンマウスは、遺伝子は同一でも普通のマウスに比べて遺伝子発現のパターンは個体によって大きなばらつきがみられることが分かりました(Biol. Reprod 2005)。
その結果どの個体でもこの三つの臓器のどれかでは10%から40%もの遺伝子が2倍以上の発現量の増加あるいは減少を示していました。これは普通の生殖による個体でのばらつきが3%程度の遺伝子に収まるのに比較して非常に大きな数字です。またクローンマウスは、遺伝子は同一でも普通のマウスに比べて遺伝子発現のパターンは個体によって大きなばらつきがみられることが分かりました(Biol. Reprod 2005)。
さらにこの遺伝子発現の乱れを詳しく解析すると、影響を受ける遺伝子は染色体の上に近くに並んでいるものが揃って影響を受けている部分が100カ所近く見つかり、クローンマウスの解析から哺乳類の遺伝子の染色体上でこれまで知られていなかった調節単位が存在するかも知れないこと明らかになってきました。
クローンの個体間で遺伝子発現のレベルを比較すると、どの個体にも共通して増加、あるいは減少している遺伝子はごく少数で、多くの遺伝子発現異常は個体間でばらつきが認められました。すなわち、体細胞クローニングによる発生は有性生殖による個体発生に比較して遺伝子発現の調節に大きな個体差を引き起こしていると結論することができます。従って、多くの個体での遺伝子発現のレベルを平均して、正常コントロール個体の平均値と比較したり、あるいはクローン個体群とコントロール個体群との間で統計的に有意に変化した遺伝子だけをt検定などで抽出すると、これらの多くの異常は相殺されてしまいます。このように、共通する異常だけに注目する解析は、クローンの異常のごく一部だけを見ることになり、十分な解析とは言えないと考えます。
逆に、個体間でランダムに誘導された遺伝子発現の異常が存在することを前提に、私たちはクローンの遺伝子発現プロフィールを次のように解析しました。個体間での発現のばらつきのパターンそれ自身を利用して遺伝子をグループ化します。このあと遺伝子をゲノムの配列に従って整列させると、発現パターンが類似した遺伝子がクラスターとして存在する領域が多数見いだされました。また、いくつかの代謝経路を構成する酵素の遺伝子の中にも共通する発現パターンを示す遺伝子が集まっているものが認められました。このことは、これらのゲノム上の領域や代謝経路のメンバーの中に共通する遺伝子発現の調節が存在することを強く示唆しています。この発現調節の異常はクローニングによって最初に引き起こされた異常だけではなく、多くのものが二次的に誘導されたものであると考えられますが、これらの「共通のパターン」はクラスターごとにいくつもの種類があることから、逆にクローン個体によってランダムにいくつもの異常が起きていたことを示していると考えられます。
また私たちは、このような遺伝子発現パターンの解析はクローン動物の解析だけでなく、一般に個体間でランダムに引き起こされるような現象を解析する場合に広く応用することにより、これまで知られていなかった遺伝子発現制御の単位を明らかにする強力な手段になると期待しています。