研究
血液内科学研究室
- 血液内科の魅力とは?:
診断から治療まで、移植や新規治療を含めて全て自身で行えること、またたとえ診断時に重篤な症例でも、経過次第で治癒を目指せるなど、その治療効果や展開の劇的さ、などの声が血液内科臨床医から良く聞かれます。
これに加えて、私たちはBed(臨床)とBench(研究)の距離が非常に近い、という点を強調したいと思います。 -
この20年間の血液内科診療の世界は、新規分子標的治療の相次ぐ登場とそのいち早い実践の舞台であり、ADCを含む各種抗体薬、チロシンキナーゼ阻害薬、プロテアソーム阻害薬、免疫チェックポイント治療、BiTE、CAR-Tなど、がん診療を行う内科医として、それまで想像もしないようなインパクトの連続でした。振り返るとこれらの治療法は、そのコンセプトが生まれてから、驚くほどのスピードでBenchからBedへ届けられています。
私たちは血液内科臨床医であり、日々の臨床の中で基礎的研究に費やすことのできる時間は限られます。しかし、研究室で行う基礎研究の経験が、独自の臨床的なバックグラウンドと相まって、その医師の視野を大きく広げ、将来像に奥行きを与えることは言を俟たないと思います。 - 日々の実験、検討で見いだされるものは、一見すると小さいものがほとんどですが、そこに新たなひらめきと感性、鋭い着眼点が加われば、それを積み重ねることで10年後、20年後に、ある疾患の治療戦略を一変させてしまうような発見につながる可能性があります。そのような魅力に触れながら、私たちと一緒に、clinical scientistとしての自分を見出してみませんか。
- 東京医科歯科大学血液内科研究室は、旧第一内科時代に凝固・線溶学の権威であられた青木延雄名誉教授が導入された分子生物学的研究環境を基に、血液内科の診療科としての独立後、三浦修名誉教授(前主任教授)が主に造血器腫瘍のシグナル伝達機構の解析の分野で多くの業績を残され、たくさんの同門の先生方がご活躍されました。現在の研究室スタッフはそのご指導・薫陶を受けて育ち、各々のバックグラウンドを生かしつつ、多忙な診療業務の合間を縫うように、それでも常に新たな知見と方向性を目指して日夜奮闘しています。まだ実績も経験も不足している状況ではありますが、一人でも多くの若い研究者が加わって、さらなる発展と発信に力を合わせて頂ければ、研究室としてこの上ない喜びです。
- 私たち血液内科学研究室では、白血病・骨髄異形成症候群・悪性リンパ腫・多発性骨髄腫などの造血器腫瘍や、再生不良性貧血・発作性夜間ヘモグロビン尿症・血球貪食症候群などの造血不全の原因となる、細胞機能・染色体・遺伝子の異常や、その病態形成に関与する免疫担当細胞や微小環境、外的因子との相互作用について明らかにするとともに、それらの基礎的データと臨床経過との関連について解析する研究に従事しています。
- 特に造血器腫瘍領域では近年、腫瘍の起源となる細胞(Cell of Origin: COO)に基づく細分類と、染色体・遺伝子異常の解析法の革新により、疾患特異的治療の確立へ向けた大きな進歩があります。また生体が本来保持している抗腫瘍能のメカニズムの研究が進み、その強化を図るための新たな介入方法が次々と開発され、これらの成果が先に述べたように、新たな分子標的治療として次々に診療の場に登場しています。
- 私たちは現在、難治性の急性骨髄性白血病やB細胞性リンパ腫における新たな分子標的を確立する研究、また抗腫瘍薬に対する薬剤感受性の向上のための研究、さらにはリンパ球などの免疫担当細胞への遺伝子導入による抗腫瘍能の強化やその制御に関わる研究などに注力して、活動を進めています。ここではその内容の一部を紹介します。
- 大学院への進学を検討される方は、研究室責任者の雁金または秋山までご連絡ください。
長尾班
私たちの研究グループでは主に難治性B細胞リンパ腫を対象に、COOである正常なカウンターパート細胞が元来有する機能と関連した特異的遺伝子変異と、これに誘導される活性化シグナル伝達経路に着目し、新たなdrug-ableな分子標的の検索を進めています。
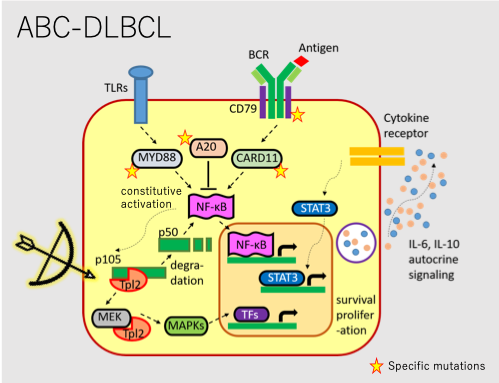
1. NF-κB経路の構成的活性化を伴う、難治性B細胞腫瘍に対する新たな分子標的TPL2
活性化B細胞様びまん性大細胞型B細胞リンパ腫(ABC-DLBCL)を初めとする、難治性B細胞腫瘍の多くはNF-κB系の構成的な活性化が、その病態形成に深く関与しています。私たちは、現在ABC-DLBCLにおいてNF-κB経路の下流で活性化する多機能キナーゼTPL2に着目し、新たな分子標的としての可能性について検討しています。直近では、疾患特異的遺伝子変異であるMYD88-L265P陽性細胞において、TPL2が他のシグナル伝達経路の活性化を誘導し、協調的に腫瘍原性に関与していることを見出し、新たな知見を含めて論文投稿を予定しています。
2. B細胞腫瘍の腫瘍原性におけるPECAM-1の機能とその分子標的としての可能性
一部のB細胞腫瘍では、その細胞表面にPECAM-1(CD31)を発現しています。PECAM-1は全ての血管内皮細胞に発現するとともに、形質細胞腫瘍や一部のB細胞腫瘍で高発現するCD38のligandとしての機能を有することから、これらB細胞腫瘍細胞同士のinteractionや、組織浸潤、増殖機転などへの関与が推定されます。現在大学院生の本村が中心となり、解析を進めています。
3. 原発性眼内リンパ腫(PVRL)特異的遺伝子異常の解析とその臨床像との関連
PVRLは硝子体や網膜を原発巣とする悪性リンパ腫(DLBCL)で、その発生や臨床像から中枢神経原発悪性リンパ腫(PCNSL)の一病型であるとも考えられ、遺伝子変異のパターンなどを共有する一方で、未だ標準的な治療戦略(局所療法および中枢神経浸潤予防)が確立されておらず、予後不良の疾患群です。私たちの研究室では、吉藤助教が中心となり当院眼科や学外施設との共同研究としてPVRL患者の硝子体サンプルを用いた遺伝子解析研究を進めております。さらに臨床経過や、CNS再発時のサンプルの解析を加えることで、予後と相関する因子の同定など、細分類や層別化につながる知見が得られる可能性があります。
4. 各種造血器腫瘍細胞株の樹立、その解析と応用
当科では悪性リンパ腫や急性骨髄性白血病など造血器腫瘍の患者さんの臨床検体から様々な細胞株を樹立し、その性質の解析を進めています。これらは元になった疾患の腫瘍原性や薬剤感受性などの解析に非常に有用で、研究目的での譲渡が可能です。
ご興味のある方は遠慮なく当方までお問い合わせ下さい。
| Cell lines | Details |
|---|---|
| TNET-1 | AML cell line derived from triple negative MPN. (on analysis) |
| CARLET | CALR del52+ AML cell line derived from ET. (on analysis) |
| PVTL-1 | Jak2-V617F+ AML cell line with Lyn activation. (publised) |
| PVTL-2 | Jak2-V617F+ AML cell line with Jak3, MPL expression. (publised) |
| TMD12 | ABC-DLBCL cell line with MYD88 & CD79B mutation. (in preparation) |
| TMD13 | GCB-DLBCL cell line (on analysis) |
| FJI-3 | Flt3-Wt AML line from Flt3-ITD positive AML case. (on analysis) |
| Others in process |
その他、各種造血器腫瘍の臨床検体の遺伝子変異や特定の蛋白の発現の有無について、種々の分子生物学的手法を用いて検討し、臨床経過や予後との関連を解析しています。ご質問や提携、共同研究のご提案などございましたら遠慮なくお問い合わせください。
→連絡先:nagao.hema@tmd.ac.jp
野上班
1. 「基礎研究」の大学院で経験できることとは?
私たちは、血液内科医であるとともに難治性白血病や血液難病の進展や治療抵抗性に関わる機構を探索することにより新たな治療法を見出そうと、日夜研究に取り組んでいます。
これまで多くの学生さんが研究に参加し、自身の手で真実を見出す科学的手法を享受し、観察力と論理的思考を磨き、Clinical Scientistとしての糧を得ています。一つ一つのデータを積み重ねるのは地道な作業ですが、国際雑誌や国際学会への報告を通じて高い水準での客観的なフィードバックと新たなcuriosityを得て、さらに前進する活力としています。気がつくと自身で研究計画書が書けるようになり、Clinical Scientistとして走り出し、留学の準備も整うでしょう。以下の研究にご興味がある方は、お気軽にご連絡下さい。
2. 既存の疾患概念を超えた難病への取り組み 〜Listen to the patient.〜
患者さんの訴えに答えがある。臨床を経験した研究者だからこそ見出せる真実がある。
疾患の根幹をなす分子が、一つ一つの症状を物語っている。
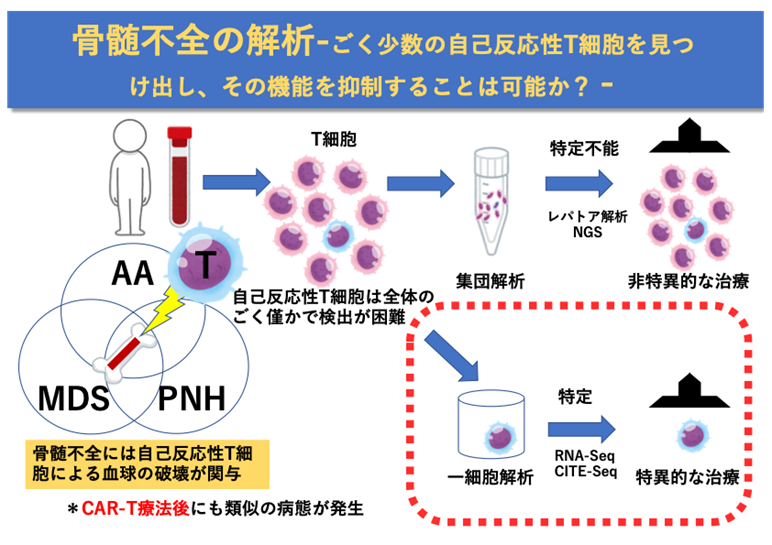
このような考えから、従来の血液腫瘍のシグナル解析に加え新しい取り組みを開始しています。診療と研究に携わる立場では、既知の疾患概念の理解を超えた病態に遭遇します。例えば、良性疾患に分類されながらも難病である血液疾患に再生不良性貧血や発作性夜間ヘモグロビン尿症があります。これらの骨髄不全症の患者さんでは、免疫抑制剤の投与により血球の回復を認める一方、ごく一部の患者さんには白血病の発症を認めます。私たちは、骨髄不全の病態をより詳しく調べることにより、造血の異常に関与する周囲環境や、その標的分子を明らかにすることを目的として、既存の分類にとらわれない疾患へのアプローチを開始しています。
3. CAR-T療法後骨髄不全症の解析
また、当科で積極的に行っているCAR-T療法の治療後に血球が減少する合併症(CAR-T療法後骨髄不全)が生じることがあります。この仕組みを解析し、既存の骨髄不全との差異を明らかにすることで治療成績の向上に繋げたいと考えています。このテーマでは新しい遺伝子配列決定技術や形態解析技術を積極的に取り入れ、これまで解決困難とされた課題を、多岐にわたる血液疾患の診療に従事する者ならではの視点で明らかにし、確実に臨床に還元できる意義のある研究成果を出せるよう努めていきます。
4. Flt3-ITD変異陽性の白血病の治療抵抗性に関与する分子機序の解明〜臨床で直面する課題を紐解き、新たな治療に繋げる〜
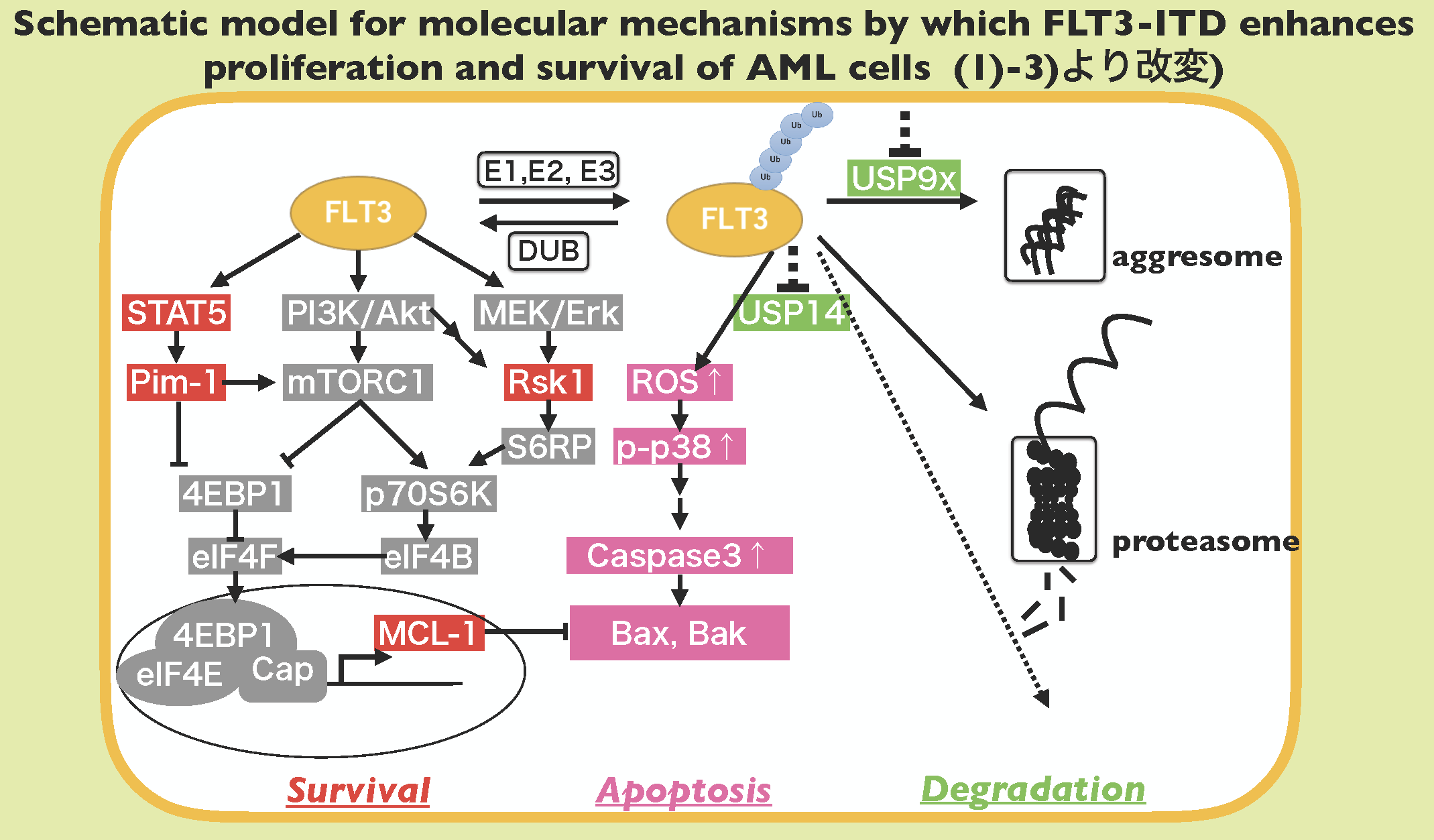
急性骨髄性白血病の20-30%の患者さんに、Flt3-ITDという遺伝子変異が認められ、予後を悪くすることが知られています。私たちの研究室は、この遺伝子変異に発見された当初より着目し、その急激な増殖を可能にしている機構は何なのか、薬剤が効きにくいのは何故なのか、について多くの研究成果を報告してきました。私たちは、Flt3-ITDタンパクが、HSP90結合阻害時にc-Cblを介してプロテアソーム依存的に分解されることを発見し、その後Flt3-ITD陽性白血病の治療抵抗性がSTAT5の活性化に起因すること1)、続いてその実行分子がPimキナーゼであること2)を報告しました。これらの研究の中で私たちが当初より指摘した治療抵抗性分子の一部(Mcl-1, Bcl-2)は、最新の白血病治療薬の標的となっています。さらに、他の白血病との比較研究の過程でFlt3-ITD陽性白血病細胞で特異的に働く未報告の治療抵抗性因子としてRSKを見出し、その詳細な機構の解析は現在、さらなる展開をみせています3)。また、これらの細胞におけるタンパク分解機構に着目し、Flt3特異的阻害薬に抵抗性のFlt3-ITD陽性白血病細胞をプロテアソーム阻害薬Bortezomibが、Flt3特異的阻害薬との併用でアポトーシスに導く機構を報告しました。このように、増殖や治療抵抗性の機構のみならず、その爆発的な増殖をサポートしている白血病細胞内のタンパク分解機構にも着目し、より普遍的な腫瘍の理解を進めています。
青山班
近年、血液悪性腫瘍に対しては抗がん剤治療や放射線治療、またさらなる広がりをみせる分子標的治療などの広く行われている治療に加えて、免疫学的なアプローチでの新しい治療法が開発され優れた治療成績を示しています。キメラ抗原受容体(Chimeric Antigen Receptor, CAR)遺伝子を導入したT細胞を用いる“CAR-T細胞療法”は、代表的な細胞免疫療法のひとつです。CAR遺伝子は標的タンパク質を認識する部位とT細胞を活性化する部位で構成されており、CAR遺伝子を発現するT細胞(CAR-T細胞)は、対応するタンパク質を発現する標的細胞に対して特異的な細胞障害活性を示します。本邦でも2019年よりCD19タンパク質を標的としたCAR-T細胞療法が承認され、再発・難治性のB細胞性腫瘍に対して用いられています。(なお、本学大学病院血液内科でも本治療が実施されています。)また、多発性骨髄腫をはじめとした、そのほかの疾患に対するCAR-T細胞療法の開発についても世界中の研究者が興味をもち、広く取り組まれています。
CAR-T細胞は標的細胞に対して優れた特異性を持ちますが、すべての悪性腫瘍がその表面に「特異的な」タンパク質を発現するわけではありません。例えば、CD19タンパク質はB細胞性腫瘍のみならず、正常のB細胞の表面にも発現しているため、CD19を認識するCAR-T細胞は正常のB細胞も攻撃してしまいます。正常細胞が攻撃されてしまうことは、CAR-T細胞療法の適応となる疾患を限定してしまうひとつの大きな原因です。“ON-Target/OFF-Tumor effect”と呼ばれる、このCAR-T細胞に特徴的な副作用を改善することは、従来のCAR-T細胞療法の安全性をさらに改善し、また適応となる疾患を拡大することに繋がります。
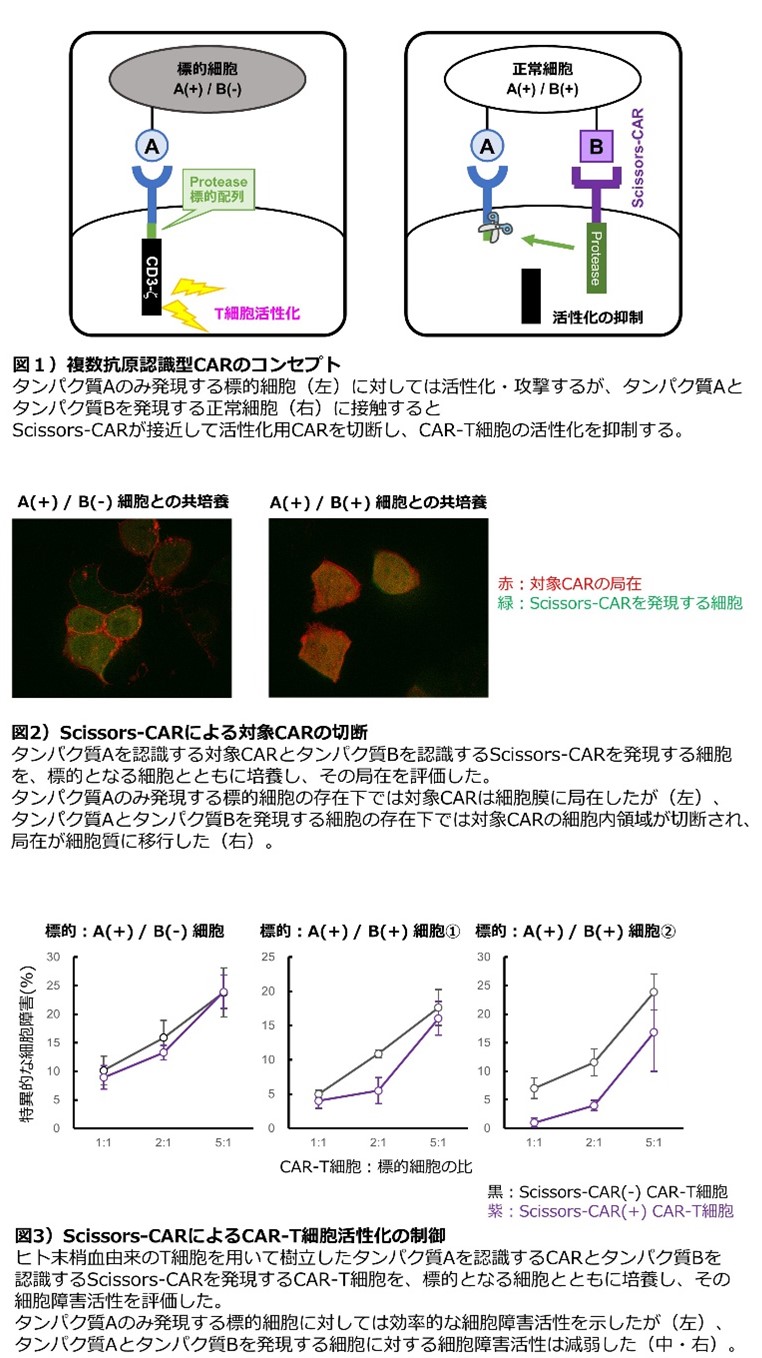
この問題を解決するため、我々の研究チームではCAR-T細胞の標的特異性を改善することを目標とし、研究を続けています。2022年現在、主に『複数の標的タンパク質の発現パターンを認識し、CAR-T細胞による攻撃の特異性を改善する』システムの研究に取り組んでいます。
従来型のCARではひとつの標的タンパク質を認識しますが、我々は
- 標的タンパク質Aを認識する、T細胞を活性化するためのCAR
- 標的タンパク質Bを認識する、対象となるCAR①を切断する酵素(protease)を持つCAR(“Scissors-CAR”と呼称)
Scissors-CARは標的細胞の表面タンパク質の発現パターンを認識し、対象となるCARを切断しその局在を細胞膜から細胞質へと移動させました(図2)。ヒト末梢血由来のT細胞を用いてこれらのCAR遺伝子をともに発現するCAR-T細胞を作成し、標的となる細胞と培養したところ、タンパク質Aとタンパク質Bの双方を発現する細胞に対しての攻撃が選択的に減弱しました(図3)。このように、Scissors-CARによってCAR-T細胞の標的細胞への特異性・選択性の向上が得られました。
我々はこれらの研究成果を、日本血液学会やアメリカ血液学会、アメリカ癌学会など複数の国際学会で発表し、また研究論文として報告しています(in press)。また、本学産学連携センターと連携し、特許取得を含めて我々の系を実際の臨床に結び付けられるよう、研究・開発を進めています。活性制御を効率化することや疾患に応じて最適化することなど、報告したこのシステムはまだまだ研究の途上にあります。ベンチとベッドをつなぐような“Translational Research”にご興味のある、熱意ある方のご参加をお待ちしています。

 外来受診
外来受診


