- Marshall B. Helicobacter pylori: 20 years on. Clin Med
2002;2:147-152.
- Baldari CT, Lanzavecchia A, Telford JL. Immune subversion
by Helicobacter pylori. Trends Immunol 2005;26:199-207.
- Yamaoka Y, Kita M, Kodama T, et al. Helicobacter pylori
cagA gene and expression of cytokine messenger RNA in gastric
mucosa.Gastroenterology 1996;110:1744-1752.
- Reyrat JM, Pelicic V, Papini E, et al. Towards deciphering
the Helicobacter pylori cytotoxin. Mol Microbiol 1999;34:197-204.
- Mohammadi M, Czinn S, Redline R, et al.
Helicobacter-specific cell-mediated immune responses display a
predominant Th1 phenotype and promote a delayed-type hypersensitivity
response in the stomachs of mice. J Immunol 1996;156:4729-4738.
- D'Elios MM, Manghetti M, De Carli M, et al. T helper 1
effector cells specific for Helicobacter pylori in the gastric antrum
of patients with peptic ulcer disease. J Immunol 1997;158:962-967.
- Lundgren A, Trollmo C, Edebo A, et al. Helicobacter
pylori-specific CD4+ T cells home to and accumulate in the human
Helicobacter pylori-infected gastric mucosa. Infect Immun
2005;73:5612-5619.
- Suerbaum S, Michetti P. Helicobacter pylori infection. N
Engl J Med 2002;347:1175-1186.
- Andersen LP, Holck S. Possible evidence of invasiveness of
Helicobacter (Campylobacter) pylori. Eur J Clin Microbiol Infect Dis
1990;9:135-138.
- Mai UE, Perez-Perez GI, Allen JB, et al. Surface proteins
from Helicobacter pylori exhibit chemotactic activity for human
leukocytes and are present in gastric mucosa. J Exp Med
1992;175:517-525.
- Morozov IA. Possibility of Helicobacter pylori invasion
into the lamina propria of the gastric mucosa. Arkh Patol 1994;56:19-22.
- Ko GH, Kang SM, Kim YK, et al. Invasiveness of Helicobacter
pylori into human gastric mucosa. Helicobacter 1999;4:77-81.
- Franceschi F, Gasbarrini A. Helicobacter pylori and
extragastric diseases. Best Pract Res Clin Gastroenterol
2007;21:325-334.
|










 粘
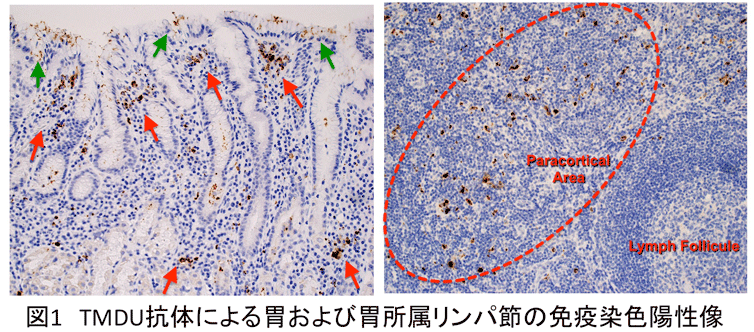
膜固有層においてはピロリ菌陽性細胞の全てがCD68陽性を示し、ピロリ菌はマクロファージに捕捉されていると考えられた(図2)。また、上皮細胞間およ
び粘液層ではMPO陽性の好中球内にピロリ菌が検出されたが、粘膜固有層では好中球内に菌体は観察されなかった。リンパ節においてもピロリ菌陽性細胞の多
くはCD68陽性を示すマクロファージであったが、少数のfascin 陽性樹状細胞(interdigitating dendritic
cell)内もピロリ菌が観察された。また粘膜固有層間質およびリンパ節において、細胞外に存在する菌体は観察されなかった。
粘
膜固有層においてはピロリ菌陽性細胞の全てがCD68陽性を示し、ピロリ菌はマクロファージに捕捉されていると考えられた(図2)。また、上皮細胞間およ
び粘液層ではMPO陽性の好中球内にピロリ菌が検出されたが、粘膜固有層では好中球内に菌体は観察されなかった。リンパ節においてもピロリ菌陽性細胞の多
くはCD68陽性を示すマクロファージであったが、少数のfascin 陽性樹状細胞(interdigitating dendritic
cell)内もピロリ菌が観察された。また粘膜固有層間質およびリンパ節において、細胞外に存在する菌体は観察されなかった。 粘
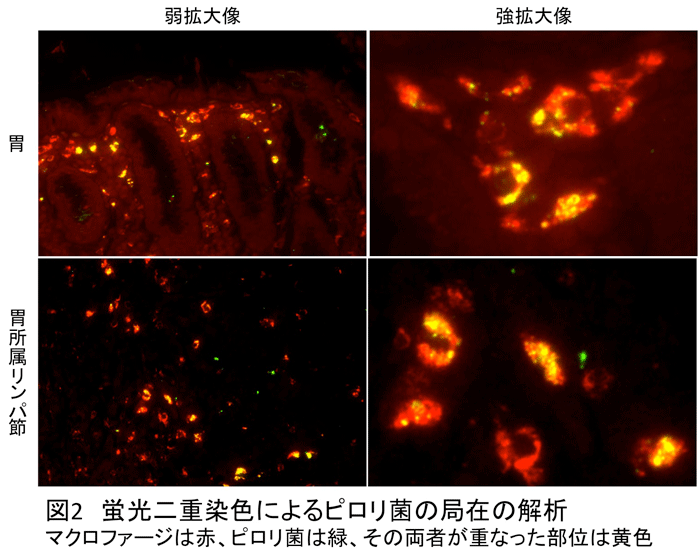
液内および壁細胞の陽性像は菌体の辺縁を縁取るように認められ、菌体のLPSの分布に一致しているものとして矛盾しない(図3)。なお、壁細胞の陽性像は
細胞内分泌細管の中に観察され、真の細胞内侵入とはし難く、粘液内に存在するものと同様の細胞外の菌体であると考えられた。一方、細胞内ピロリ菌の陽性像
は、ファゴソーム様の円形の構造に一致して認められた。細胞外のピロリ菌に見られたものとは異なり一定の構造を呈しておらず、消化を受けているかの印象で
ある。細胞内の菌体の生死に関して、形態学的に明らかな知見を得る事は出来なかった。
粘
液内および壁細胞の陽性像は菌体の辺縁を縁取るように認められ、菌体のLPSの分布に一致しているものとして矛盾しない(図3)。なお、壁細胞の陽性像は
細胞内分泌細管の中に観察され、真の細胞内侵入とはし難く、粘液内に存在するものと同様の細胞外の菌体であると考えられた。一方、細胞内ピロリ菌の陽性像
は、ファゴソーム様の円形の構造に一致して認められた。細胞外のピロリ菌に見られたものとは異なり一定の構造を呈しておらず、消化を受けているかの印象で
ある。細胞内の菌体の生死に関して、形態学的に明らかな知見を得る事は出来なかった。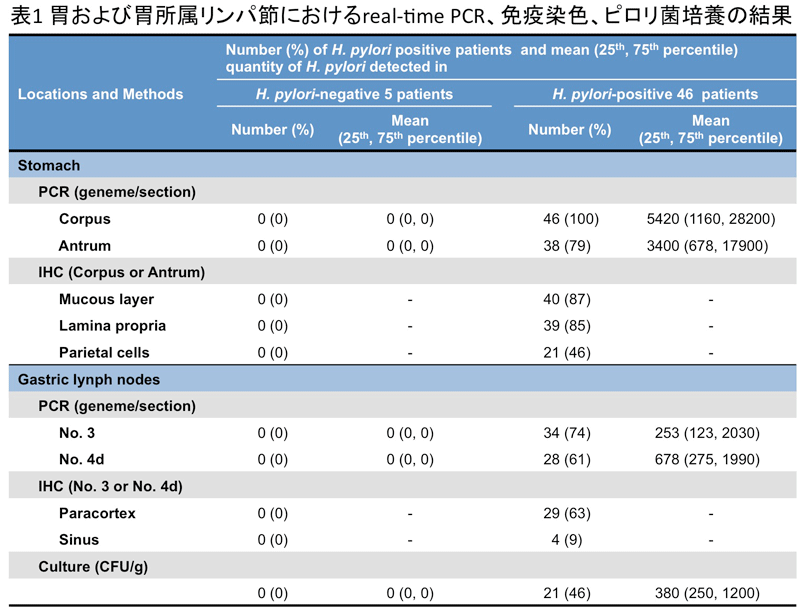 胃のPCRにてピロリ菌が検出されなかった症例をピロリ菌陰性症例とすると、ピロリ菌陰性の5例ではPCR、免疫染色、培養のいずれの検出法においても
胃およびリンパ節の全ての検出結果が陰性を示した(表1
胃のPCRにてピロリ菌が検出されなかった症例をピロリ菌陰性症例とすると、ピロリ菌陰性の5例ではPCR、免疫染色、培養のいずれの検出法においても
胃およびリンパ節の全ての検出結果が陰性を示した(表1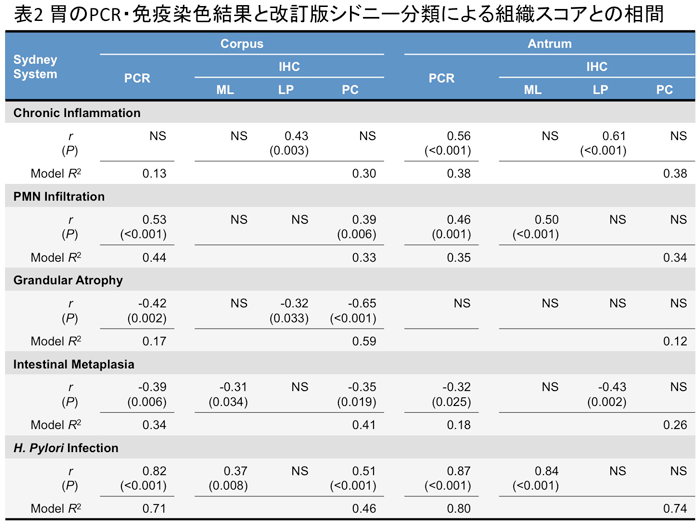 胃粘膜固有層での免疫染色結果と改訂版シドニー分類による胃炎の状態との相関を解析したところ(表2)、粘膜固有層の免疫染色結果が慢性炎症の程度と相関
を示していた。これは、粘膜固有層におけるピロリ菌陽性マクロファージの存在が慢性胃炎に関与している可能性を示唆している。また、胃のPCR結果は好中
球浸潤の程度と相関していた。胃のPCR定量値は粘液層のピロリ菌の数を反映しているものと考えられ、上皮細胞への多数のピロリ菌の接着がより強い急性炎
症を惹起している可能性が示唆される。また、胃のピロリ菌検出結果とリンパ節の検出結果との相関を解析すると、前庭部において粘膜固有層の免疫染色結果と
リンパ節での免疫染色結果と
が相関を示した。これは、粘膜固有層のピロリ菌陽性マクロファージがリンパ流を介してリンパ節へと流入している可能性を示唆している。また、胃のPCR結
果はリンパ節の検出結果全てと相関を示しており、胃の粘液層における多数のピロリ菌の存在が、より強い上皮傷害を惹起し、ピロリ菌の粘膜固有層への侵入と
ピロリ菌陽性細胞のリンパ節への流入が生じやすくなっていると考えられる。
胃粘膜固有層での免疫染色結果と改訂版シドニー分類による胃炎の状態との相関を解析したところ(表2)、粘膜固有層の免疫染色結果が慢性炎症の程度と相関
を示していた。これは、粘膜固有層におけるピロリ菌陽性マクロファージの存在が慢性胃炎に関与している可能性を示唆している。また、胃のPCR結果は好中
球浸潤の程度と相関していた。胃のPCR定量値は粘液層のピロリ菌の数を反映しているものと考えられ、上皮細胞への多数のピロリ菌の接着がより強い急性炎
症を惹起している可能性が示唆される。また、胃のピロリ菌検出結果とリンパ節の検出結果との相関を解析すると、前庭部において粘膜固有層の免疫染色結果と
リンパ節での免疫染色結果と
が相関を示した。これは、粘膜固有層のピロリ菌陽性マクロファージがリンパ流を介してリンパ節へと流入している可能性を示唆している。また、胃のPCR結
果はリンパ節の検出結果全てと相関を示しており、胃の粘液層における多数のピロリ菌の存在が、より強い上皮傷害を惹起し、ピロリ菌の粘膜固有層への侵入と
ピロリ菌陽性細胞のリンパ節への流入が生じやすくなっていると考えられる。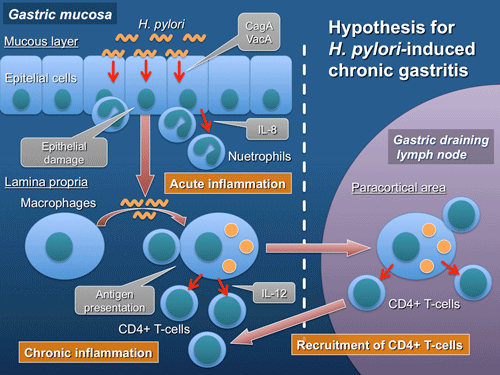 免疫染色にて粘膜固有層およびリンパ節にピロリ菌陽性マクロファージが観察され、また、リンパ節からのピロリ菌の
培養に成功したことから、ピロリ菌の粘
膜固有層への侵入およびリンパ節へのtranslocationが明らかとなった。また、ピロリ菌陽性マクロファージがピロリ菌感染に伴う慢性胃炎の惹
起・維持に関与している可能性が示唆された。
免疫染色にて粘膜固有層およびリンパ節にピロリ菌陽性マクロファージが観察され、また、リンパ節からのピロリ菌の
培養に成功したことから、ピロリ菌の粘
膜固有層への侵入およびリンパ節へのtranslocationが明らかとなった。また、ピロリ菌陽性マクロファージがピロリ菌感染に伴う慢性胃炎の惹
起・維持に関与している可能性が示唆された。