研究内容
研究概略
地球上の多細胞生物は進化の過程で生活環境に適した個体サイズと多様性を獲得してきました。個体発生や器官(臓器)形成に関与する分子レベルの理解は進んでいますが、個体・器官のサイズや多様性の決定機構は不明です。当研究室では、情報のやり取り(シグナル伝達)の観点から、発生工学・遺伝学・細胞生物学・生化学・分子生物学などの幅広い実験手法を駆使して、「高次の細胞社会である組織や器官、個体がどのような仕組みで形成され、そして機能発現体として維持されるのか?」という課題に取り組んでいます。モデル生物として、哺乳動物のマウスと小型魚類のメダカおよびゼブラフィッシュ、また、マウスとヒトの胚性幹(ES)細胞を用いており、それぞれの長所を活かした実験を行っています。難治性疾患に対する再生療法の開発や創薬のためには、正確で詳細な知見が必要です。
現在の主な研究テーマ
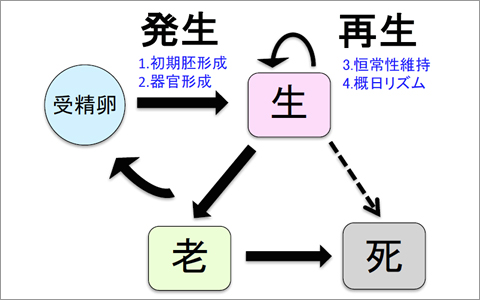
1. 初期胚発生に関する研究
哺乳動物の受精卵は、細胞分裂を繰り返し、器官の基となる外・中・内の三胚葉を形成します。外胚葉は胚盤葉上層から形成され、中胚葉と内胚葉は原始線条からダイナミックな細胞移動と細胞分化などを経て形成されます(図1A)。それ故、原始線条は“細胞分化の入り口”と呼ばれ、個体発生を運命づける極めて重要な組織です。しかしながら、原始線条は妊娠マウス子宮内の胎仔を構成する微小な組織であり、その単離は困難です。ましてや原始線条を用いた生化学的解析は極めて困難です。それ故、原始線条の形成に関わる分子機構については不明な点が多く残されています。我々は、マウス胚性幹(ES)細胞を用いて、未分化細胞から原始線条様細胞集団を経て、拍動する心筋細胞(中胚葉由来)やアルブミンを産生する肝細胞(内胚葉由来)を分化誘導する細胞分化誘導系を確立してきました。その結果、原始線条形成には、脂質代謝経路の1つであるメバロン酸経路とその下流のファルネシル2リン酸による“タンパク質のファルネシル化”と呼ばれる脂質修飾過程が必須の役割を果たしていること、一方、コレステロール合成は必須ではないことを明らかにしました(図1B、プレスリリース)。原始線条の形成に必要な代謝経路の解明を目指しています。
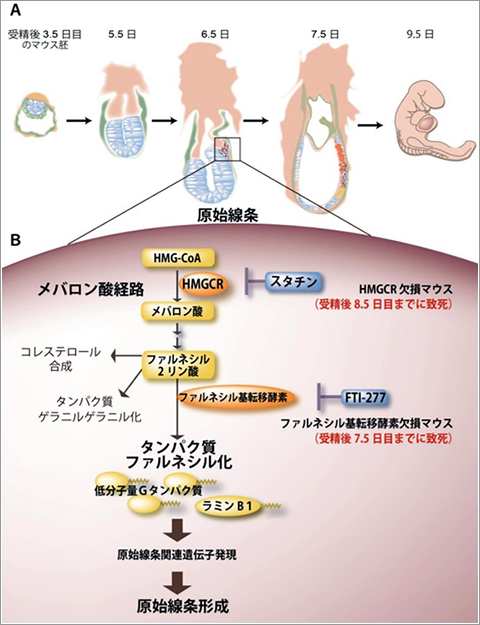
図1 原始線条形成に必須なメバロン酸経路とファルネシル化経路
2. 器官形成に関する研究
約100年前に英国の物理・数学者D'Arcy Thompsonは、地球上の生物の形は重力に大きな影響を受けていると予言しました。しかし、生物がどのように重力に抵抗して個体を形成するのかは謎です。また、様々な組織や器官は整然と配置され、適切なサイズになることで機能する組織や器官を形成します。しかし、その形成メカニズムは不明です。我々は、これら重大な課題を解決するためには、適切なモデル生物を用いて研究することが重要と考えています。そのため、ノックアウトマウスの作出や変異メダカの単離によって、上記課題の解決に取り組んできました。その結果、ノックアウトマウスの作出からMKK4/MKK7-JNK経路が肝臓や脳の形成に必須であることを見出しました(図2)。また、メダカ変異体の単離からHippo-YAP経路が重力に抵抗して3次元の器官を形成するために必須であることを明らかにしました(図3、プレスリリース)。器官サイズを制御する主要なシグナル伝達系としてHippo-YAP/TAZシグナル伝達系が注目されています。しかしながら、個体内の器官サイズ制御機構は未だ不明であり、この解明を目指しています。
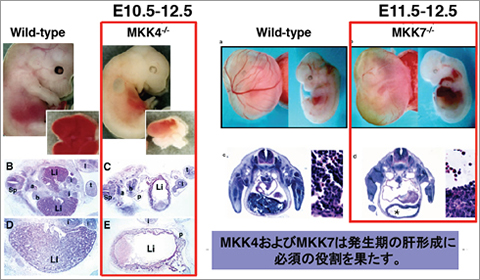
図2 肝形成不全になるMKK4とMKK7欠損マウス
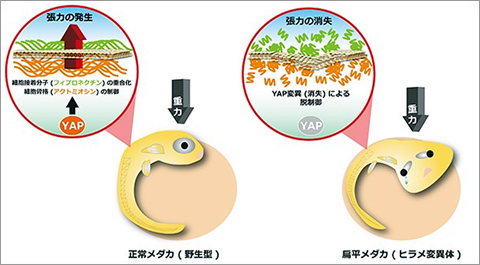
図3 大規模スクリーニングによって単離された扁平メダカhirame(ヒラメ)変異体
3. 器官の恒常性維持に関する研究
老化あるいは損傷した異常な細胞は、がんなどの疾患の原因となります。それ故、器官の恒常性維持のためには適切に排除される必要があります。しかしながら、哺乳動物の組織や器官に出現する異常な細胞を除去する機構は、未解明な点が多く残されています。我々は、哺乳動物培養細胞を用いて、器官サイズを制御する転写共役因子YAPが異常な細胞の除去に関与することを明らかにしました(図4、プレスリリース)。また、マウスを用いた実験から、アルコールなどで損傷した肝細胞がYAP依存的に排除されることを見出しました(図5、プレスリリース)。「異常肝細胞排除機構を基盤にした肝疾患に対する治療法」の創出研究を行っています。
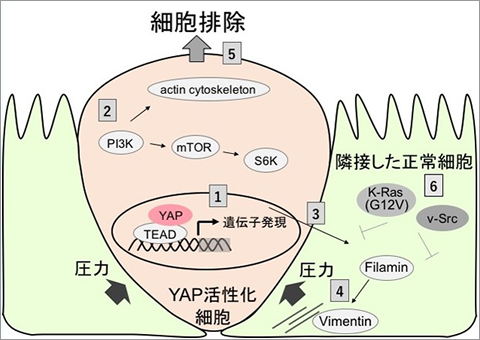
図4 YAP活性化異常細胞が隣接する正常細胞から排除される機構
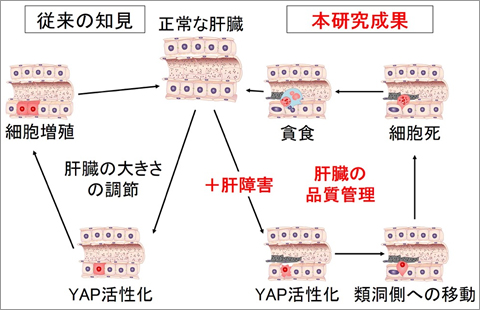
図5 YAPによる肝臓の大きさの調節と品質管理
4. 個体の概日リズムに関する研究
体内時計は多様な生理機能に24時間の周期変動を作り出す装置であり、「光を利用し自然界の昼夜の変化に対し体内環境を最適化する」という重要な恒常性維持機構です。体内時計は、個体の各細胞に存在する遺伝子発現のネガティブフィードバックループ(細胞時計)が基本単位となっています。体内時計の形成には、光刺激により複数の細胞時計が同じ時刻に同調することが必須です。しかしながら、体内時計の形成機構やその生理機構については未だ不明な点が多く残されています。我々は、マウスの神経細胞内で恒常的に活性化されているMKK7-JNK経路が体内時計や細胞時計の周期制御に関与することを明らかにしました(図6、プレスリリース)。また、ゼブラフィッシュの光誘導性の時計制御分子に注目し、これらを機能阻害したゼブラフィッシュを作出・解析し、光誘導性の時計制御分子が、エネルギー代謝を通じて行動量を制御すること、個体内の個々の細胞時計を同調させ体内時計を形成させることを明らかにしました(図7、プレスリリース)。
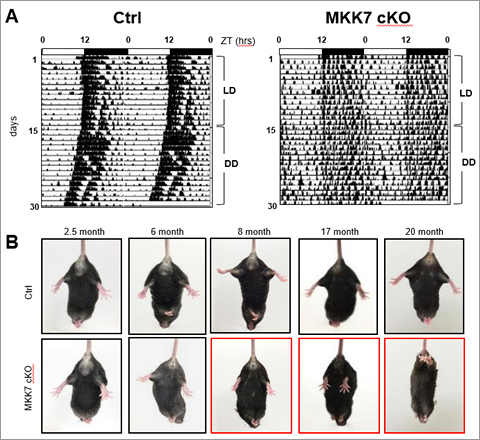
図6 概日リズム異常と筋力低下を示す神経細胞特異的MKK7欠損マウス
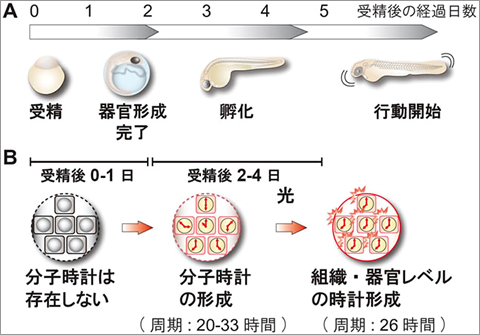
図7 ゼブラフィッシュの発生(A)と概日リズム形成(B)

