研究
研究内容
当教室の研究テーマは多岐に渡っています。下記の項目別にご紹介致します。
- 核酸医薬の研究
- 先端的脳画像による病態解明、多モダリティー学習を行う「人工知能」の開発
- 神経疾患の体液バイオマーカーの検索
- アルツハイマー病の病態解明と治療薬の開発
- 筋萎縮性側索硬化症(ALS)の原因究明と治療法開発研究
- 脳血管障害の研究
- 脊髄小脳変性症の分子遺伝学的方法による病態解明、及び治療法開発
- 血液脳関門の機能制御を目指した研究
- 神経生理学的な臨床研究
- 脱髄性中枢神経疾患における神経変性プロセスの解析
- 神経病理学的研究
1. 核酸医薬の研究
① 新たな核酸医薬技術の創生
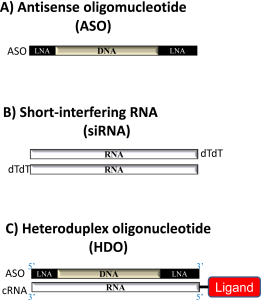
核酸医薬とは6-30 塩基の短い天然型または非天然型の核酸 (オリゴヌクレオチド) を基本骨格として利用する医薬品です。細胞膜表面のある分子しか標的にできない抗体医薬と異なって、核酸医薬は細胞内のあらゆるRNAを標的とすることが可能であり、さらに標的となるRNAの発現を抑制、RNA編集やRNA-タンパク結合制御などが幅広い応用が可能なことから、次世代の分子標的治療薬として大きく期待されています。また、神経筋疾患の病態におけるRNA制御機構がこの十年近くで急速に解明されてきています。それに伴い、核酸医薬はRNA 制御治療(RNA-modulating Therapeutics)として多くの神経筋疾患で開発が急ピッチで進んでいます。特に、2016年に海外でかつ2017年に日本でも認可された、脊髄性筋萎縮症に対するアンチセンス核酸(ヌシネルセン)は運動機能・生命予後を劇的に改善させることに成功し、脳神経内科の歴史において大きなターニングポイントとなりました。つまり、「不治の病」と言われることの多い神経変性疾患の根本的な治療が、核酸医薬によって初めて達成されたのです。このヌシネルセンに続いて、同年に、デュシェンヌ型筋ジストロフィー、2019年にトランスサイレンチン型家族性アミロイドポリニューロパチーといった神経筋疾患に対して核酸医薬が承認されました。このように、素晴らしい臨床試験の結果が続々と出てきており、「神経筋疾患は核酸医薬によって治せる疾患」という時代に突入しています。
臨床応用が進められている核酸医薬の多くはアンチセンス核酸医薬(antisense oligonucleotide; ASO)、small interfering RNA (siRNA) の2 種類ですが、全身投与では肝臓以外への標的臓器への導入効率や遺伝子抑制の有効性が十分ではなく、課題となっています。
そこで我々の教室では、「第3の核酸医薬」としてDNA/RNAヘテロ2本鎖核酸 (図1)を考案しました。ヘテロ核酸は従来の核酸医薬の20-300倍の飛躍的な有効性の向上とともに、神経系を含むあらゆる臓器や細胞への導入が可能とした革新的な新規核酸医薬で、1本鎖DNAであるASOや2本鎖RNAである siRNAと異なる作用機序を有しています。(後述)
更にヘテロ2本鎖核酸の研究開発の推進のために、東京医科歯科大学発のバイオベンチャー「Rena Therapeutics社」が2015年に創立され、一部は大手製薬企業にライセンスされました。パーキンソン病、筋萎縮性側索硬化症などの神経難病の根本的な治療薬開発や急性期脳梗塞の病態改善薬の開発などにおいて画期的な最先端の治療薬創生を目指しています。
② ヘテロ2本鎖核酸の特徴
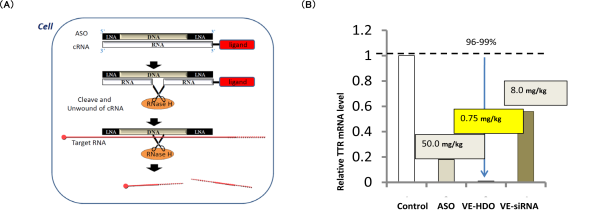
ヘテロ2本鎖核酸は標的RNA への結合でアンチセンス活性を有するDNA の主鎖と、主鎖に相補的なRNA (cRNA) からなる非天然機能核酸です。この主鎖は両端がLNA (locked nucleic acid)などの化学修飾核酸、中央部がDNA であり、2 本鎖の中央部がDNA-RNA ヘテロ核酸になるため、この部分が細胞内のエンドヌクレアーゼであるRNase H によって相補鎖RNAが切断されます。その結果、単独となった主鎖が標的mRNA に結合して再びRNase H が標的mRNA を切断して遺伝子抑制効果を発揮するデザインです。すなわち、RNase H が相補鎖RNA と標的mRNA の切断の一人二役を果たすことにより、主鎖の結合親和性に影響を与えることなく相補鎖RNA にデリバリー分子を結合することが可能となった点が特徴の分子技術です(図2A)。
核酸医薬のデリバリー分子として我々の特許であるビタミンE (VE)をヘテロ2本鎖核酸に結合させた場合、静脈投与にて、ASO やVE 結合siRNA(VE-siRNA) と比較して飛躍的に高い標的遺伝子抑制を肝臓にて実現し、さらに低投与量 (0.75mg/kg) でも99%以上と今までにない劇的な抑制率を達成しました(図2B)。
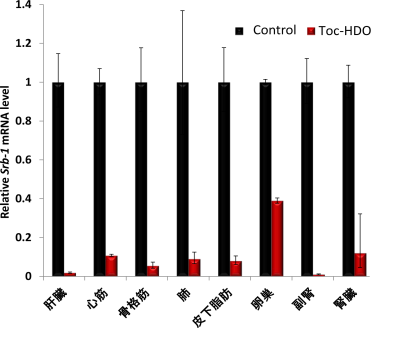
研究当初は、ヘテロ2本鎖核酸の効果は肝臓に限定されており、その投与ルートも静脈投与のみで有効でした。最近、我々はその新規の分子設計によって肝臓以外の心筋、腎臓などほとんどの腹部臓器や皮下脂肪、骨格筋の標的遺伝子制御を可能にしました(図3)。
その成果から種々の特許や研究資金を獲得し、今後は現在治療法が確立されていない難病の克服に向けた最先端の治療薬創生を目指しています。
③ 血液脳関門通過性ヘテロ2本鎖核酸
前述のように脊髄性筋萎縮症に対するアンチセンス核酸であるヌシネルセンは脳神経内科領域に革新的な進歩をもたらしました。しかし、既存の核酸医薬は一生涯にわたる頻回の髄腔内投与(腰椎穿刺)が必要で、静脈注射などの全身投与で中枢神経へ核酸医薬の送達ができないことが最大の問題点です。最近、我々は世界に先駆けて血液脳関門(BBB)を通過して効率的に脳内に導入できるリガンド分子を発見し、このリガンド分子を結合したヘテロ2本鎖核酸の静脈投与により、大脳、小脳、脊髄などの中枢神経における内因性遺伝子の広範かつ70-90%に及ぶ顕著な抑制に成功しました。投与したヘテロ2本鎖核酸は、BBBを通過した後に大脳皮質・白質のほとんどの神経細胞やグリア細胞に広くデリバリーされ、顕著な遺伝子抑制が示されました (図4)。

このBBB通過性ヘテロ2本鎖核酸はブレイクスルー技術として、武田薬品などの日米のリーディングの製薬企業にライセンスされています。(東京医科歯科大学プレスリリース)この技術によって、アルツハイマー病、パーキンソン病、筋萎縮性側索硬化症などの神経変性疾患の根本的な治療を実現すべく、AMEDの創薬基盤研究の最大グラントである先端的バイオ創薬等基盤技術開発事業「次世代血液脳関門通過性ヘテロ核酸の開発による脳神経細胞種特異的 分子標的治療とブレインイメージング」(総額5億円)(AMEDのページ)に加え、AMEDの難治性疾患実用化研究事業「双方向転写産物が関わる遺伝性神経変性疾患に対する核酸医薬開発」(総額2億円)、日本学術振興会の科学研究費助成事業・基盤研究(S)「血液脳関門通過性ヘテロ核酸の開発」(総額2億円)など多数の大型公的研究費を獲得し、さらに日米の複数の大手製薬企業と大型の共同研究(約8億円/年)を推進し、いままで計32の核酸医薬関連の特許を出してきました。最近では、マイクロRNAの制御やリンパ球など免疫系や骨格筋・心筋の遺伝子制御などでも大きな進歩があり、神経や筋の難病克服のためにヘテロ2本鎖核酸技術をバイオ医薬による分子標的治療の標準治療にすべく、一流の化学・遺伝子工学・薬学・分子生物学の研究者と共同で、創薬研究をダイナミックに展開しています。
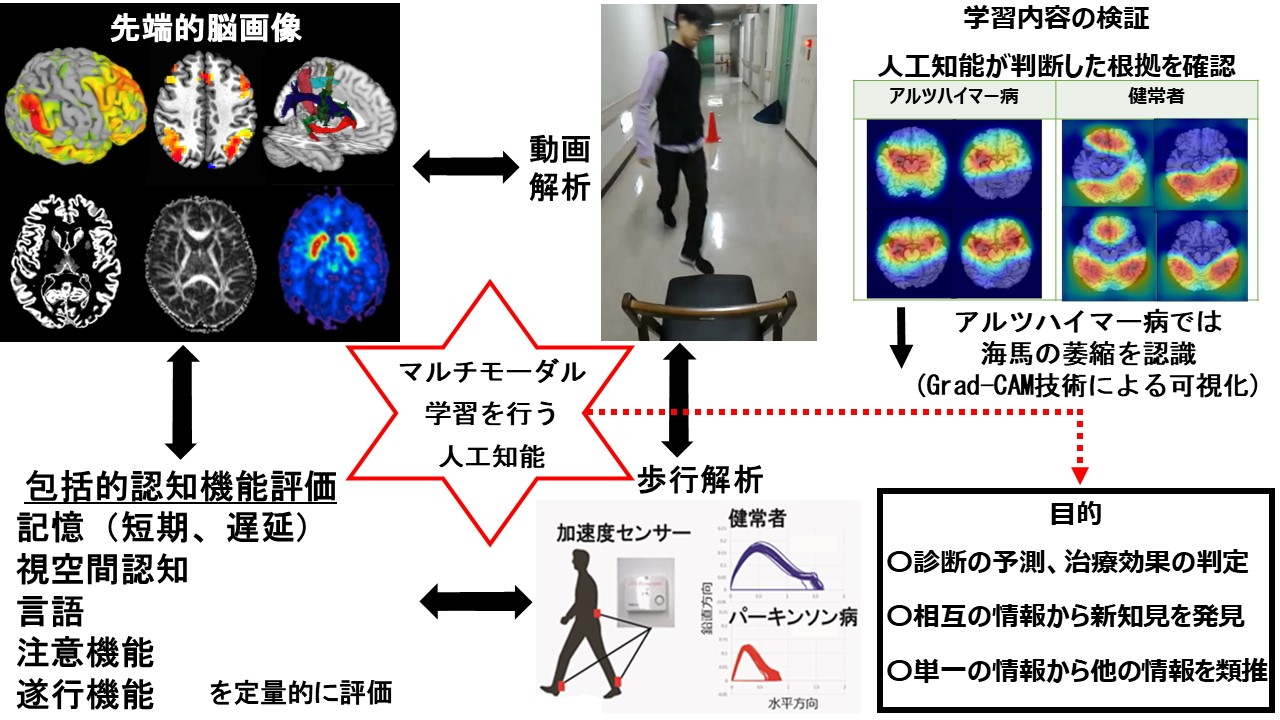
2. 先端的脳画像による病態解明、多モダリティー学習を行う「人工知能」の開発
脳画像解析を用いた病態、神経ネットワーク、治療効果の可視化
私たちは、先端的な脳画像を用いることで、患者さんの脳で実際に起きている病態を「見える」ようにする研究活動、臨床応用を進めています。複数のMRI撮像法を組み合わせることで、多彩な脳機能、構造を非侵襲的に評価するマルチモーダル脳画像を実用化しています。
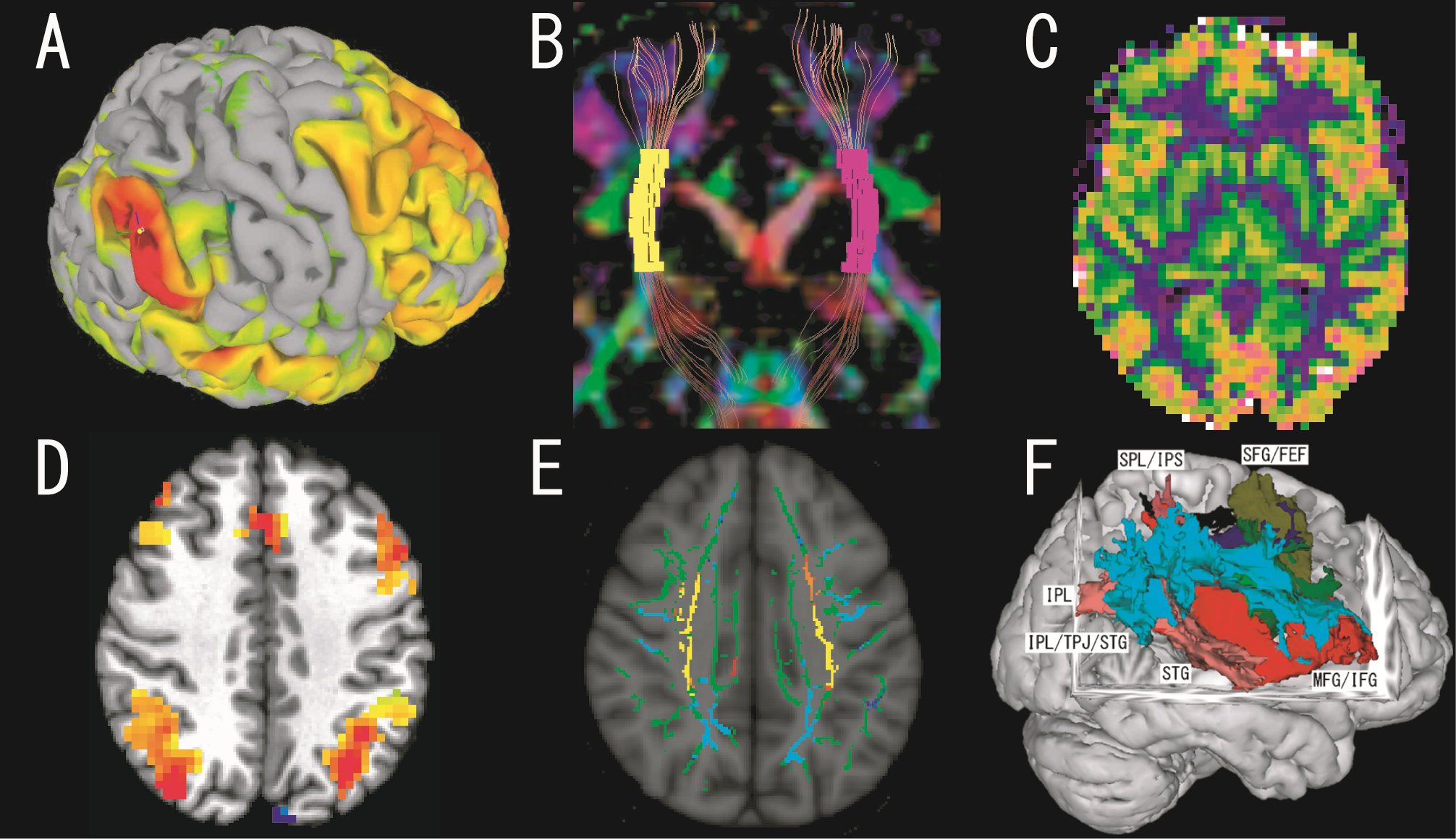
具体的には、機能的MRIを用いて、神経ネットワークを同定する機能的結合(functional connectivity)(図A)、拡散テンソル画像を用いて白質による線維経路を同定する構造的結合(structural connectivity)(図B)、脳のシナプス活動を反映する血流量を評価するArterial Spin Labelling(ASL)法(図C)によって、神経ネットワークの視覚化、定量化を行っています。
これまでに、パーキンソン病患者さんの運動機能、認知機能に関わる神経ネットワークの異常(OHBM, 2015)、灰白質や白質の異常、血流変化(Hum Brain Mapp, 2012)、ワーキングメモリー施行時の脳賦活の異常(OHBM, 2018, 図D)、特発性正常圧水頭症(AJNR, 2011, 2012)の白質障害(図E)、半側空間無視に関わる空間性注意の構造的結合(Brain Imaging and Behavior, 2018)(図F)などを明らかにしてきました。
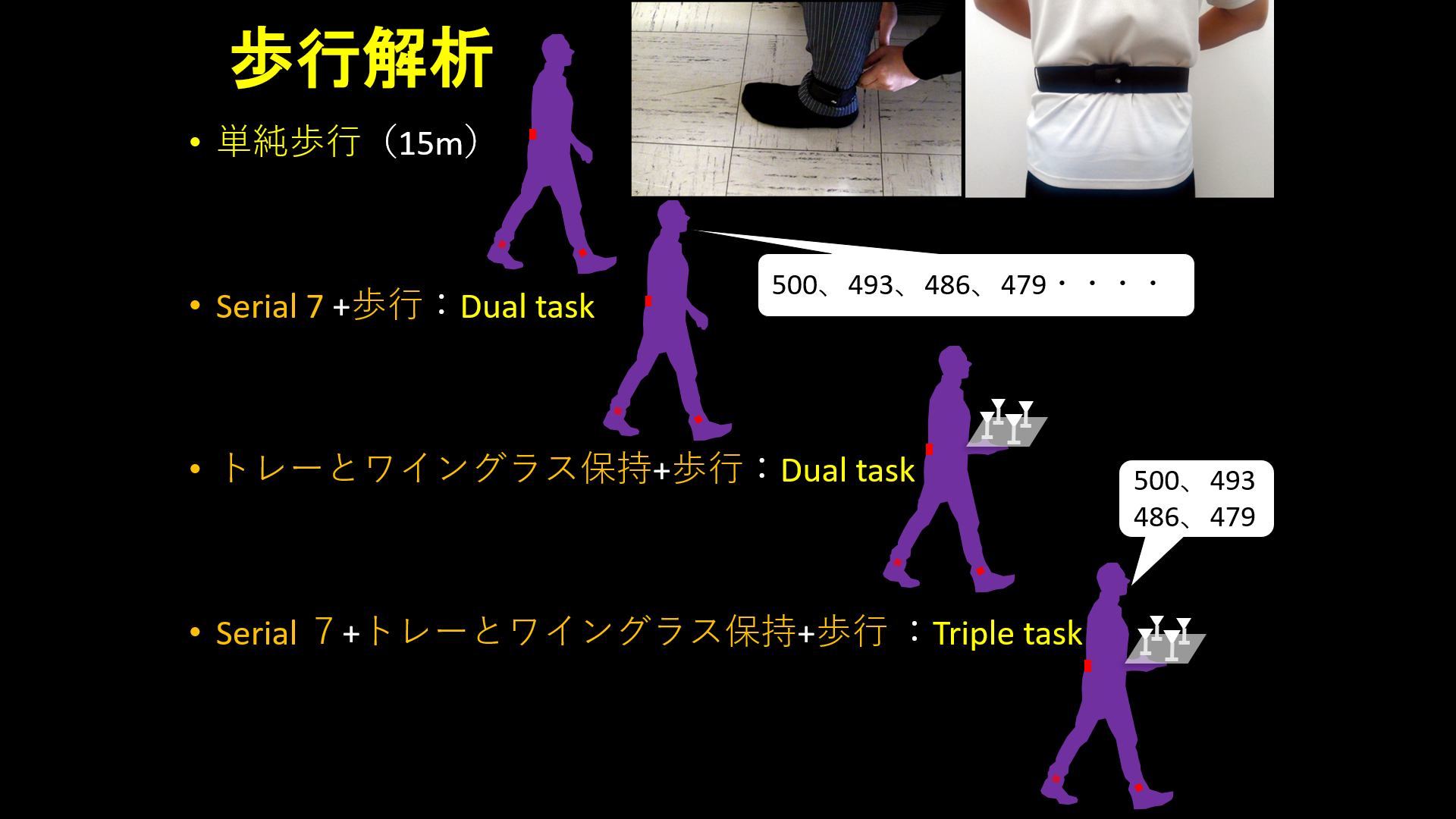
現在、画像解析を専門とする医師、大学院生、病棟医が協力して、下記の疾患の患者さんを対象に画像解析、歩行解析(両足首と腰に加速度計を装着し、治療前後や経時的に評価)、包括的認知機能評価(認知ドメインごとに評価)を行っています。
歩行解析は、単純歩行のみではなくて、7の連続引き算をしながらの歩行(dual task)、トレーとワイングラスを持ちながらの歩行(dual task)、その両者を当時に行いながらの歩行(triple task)なども合わせて行っています。このように、認知タスク、運動タスク、その両者の負荷が歩行に加わることで、脳内で干渉が起きて、代償機転などが取り除かれることでより病態が顕在化するのではないかと考えています。
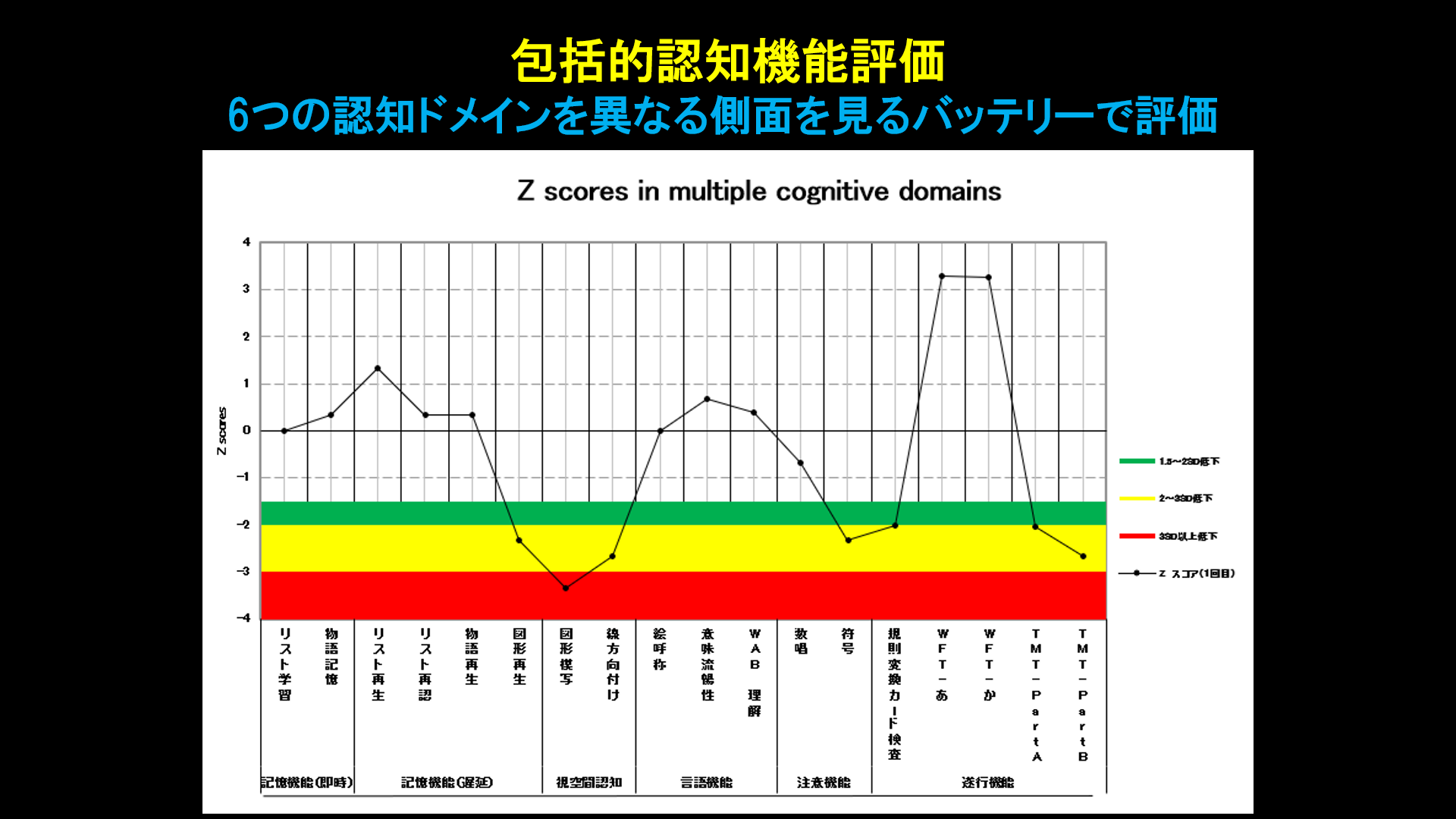
私たちは、神経心理士によって、記憶機能(短期)、記憶機能(遅延)、視空間認知、言語機能、注意機能、遂行機能の6つの認知機能ドメインを、それぞれ異なる側面を評価する2つ以上のバッテリーで定量的に評価しています。検査結果は、同じ年齢の健常データと比較して正規化(z-score)し、グラフにすることで可視化し、その患者で障害されている認知機能ドメインが一目瞭然となります。
パーキンソン病、パーキンソン症候群
パーキンソン病やパーキンソン症候群は、ドパミン神経の変性、脱落の結果、無動、筋強剛、振戦、姿勢反射障害といった運動症状を呈し、レボドパなどの抗パーキンソン病薬によって症状が改善しうる疾患です。一方で、各症状の詳細な神経基盤や、薬剤の投与が脳の神経ネットワークにどのような変化を与えるかは十分に分かっていません。本研究では、マルチモーダル脳画像、脳内のドパミン節前細胞の神経終末を画像化するSPECT検査、歩行解析、認知機能評価を組み合わせることで、運動症状の神経基盤を解明し、レボドパ投与による神経ネットワークの変化を明らかにすることを目指しています。また、複数の感覚入力を用いたリハビリテーションを行うことで、脳の可塑性を活用しながら運動症状の改善を目指す新たな治療法も確立してゆきます。
こうした研究の成果として、症状に対応する神経基盤が同定できるようになり、より正確な診断が可能となり、治療の効果も可視化できることで、各患者さんに適した治療選択が可能となることが期待されます。
筋萎縮性側索硬化症
筋萎縮性側索硬化症(Amyotrophic Lateral Sclerosis, ALS)は、大脳の運動野と脊髄の前角細胞という運動神経に選択的な障害がおきる運動ニューロン疾患として知られています。今日、ALSでは運動野以外の脳領域にも障害が進展してゆくことが知られてきています。一方、通常のMRIでは、ALSによる脳の異常を捉えることは困難で、診断に苦慮することがあります。そこで、我々は、神経ネットワークの評価、灰白質の体積、白質の微小構造、脳血流などのマルチモーダル脳画像、電気生理検査、歩行解析を組み合わせることで、ALS患者さんの脳内の構造的、機能的な異常の可視化を目指しています。
こうした研究の成果として、ALSにおける上位運動ニューロン障害を含む脳の障害が可視化され、正確な診断、進行度の評価、治療法の効果判定が可能となることが期待されます。
特発性正常圧水頭症とその類縁疾患
特発性正常圧水頭症(idiopathic normal pressure hydrocephalus, iNPH)は、歩行障害、認知機能障害、尿失禁を特徴とする症候群です。iNPHは治療可能な認知症と位置づけられており、超高齢化社会の到来を受けてiNPHの診断の重要性はさらに高まっていますが、その神経基盤は未だに明らかではありません。そこで、我々は髄液除去テスト前後でマルチモーダル脳画像、歩行解析、認知機能評価を行うことで、髄液除去テストによって改善するiNPHの症状の神経基盤を同定しようとしています。
一方で、これまでの先行研究では、iNPHとの診断のもとでシャント手術を施行されたが、のちになって症状が悪化し、剖検にて別の中枢神経疾患であったとする症例も報告されています。こうした報告より、我々は中枢神経疾患を基盤に二次的に髄液除去テスト陽性となるiNPHに類似した病態があるのではないかと考えています。そのために、中枢神経疾患を有する患者さんに髄液除去テストを行い、症状とマルチモーダル脳画像の変化を比較検討する前向き研究を開始しております。
こうした研究の成果として、iNPHや髄液除去テスト陽性となる中枢神経疾患の疫学、病態、神経基盤が明らかになり、正確な診断に基づいたより適切な治療選択が可能となることが期待されます。
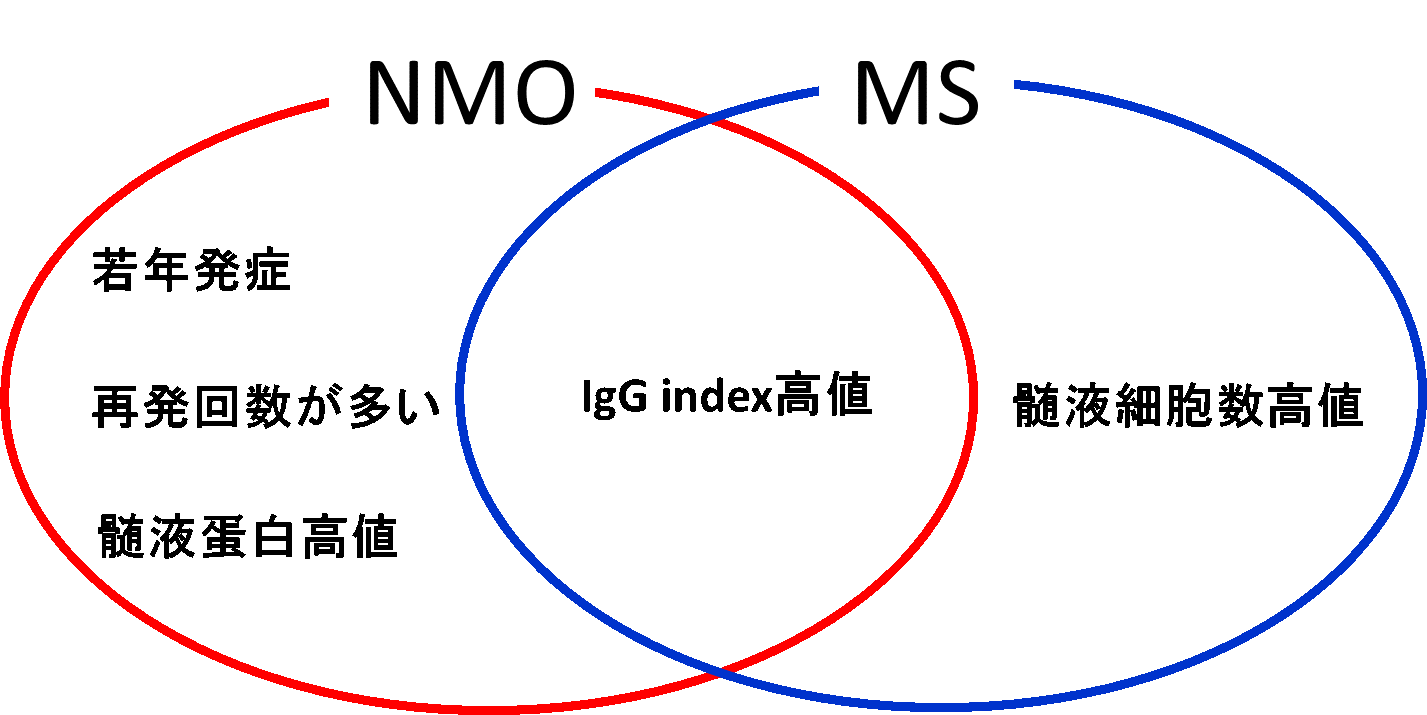
多発性硬化症、視神経脊髄炎
多発性硬化症(multiple sclerosis, MS)は、若年の患者さんに好発し、多彩な神経症状を発症しながら、脳や脊髄に多発した病変が蓄積していくことで、症状が進行してゆく疾患です。その根本的治療法はまだ確立されていませんが、疾患の病勢をコントロールするための複数の疾患修飾療法(disease modifying therapy, DMT)が使用可能となっています。MSの疾患活動性やDMTへの応答は、患者さんごとに大きく異なっていますが、これらを短期間で正確に評価することは現状では困難です。
一方、MSに似ているが異なる疾患として視神経脊髄炎(Neuromylelitis Optica, NMO)があります。NMOでは、視神経や脊髄のみならず、脳内にも炎症が起き、中枢神経に病変が蓄積していきます。NMOの治療として免疫抑制療法が使用されることが一般的ですが、NMOの疾患活動性や免疫抑制療法への反応性を、短期間に正確に評価することは現状では困難です。
我々は、MSやNMOの疾患活動性を正確に評価し、かつ、日常臨床の一環としても実施可能で実用的なバイオマーカーの確立を目指しています。そのために、MSやNMOの患者さんを対象にマルチモーダル脳画像、歩行解析、認知機能評価などを用いた詳細な臨床評価をおこなうデータベースを確立しようとしています。
こうした研究の成果として、MSやNMOの疾患活動性がより正確に把握できるようになり、適切にDMTや免疫抑制療法を使用することで、疾患の再発を抑え、症状の進行を抑止できるようになることが期待されます。
脳のシステムとしてのネットワーク解析:グラフ理論
我々は、脳全体のネットワークを包括的に解析しています。具体的には、MRIなどから得られる3次元T1強調像、拡散テンソル画像、機能的MRI画像、脳血流などのデータからそれぞれ脳の各領域間の解剖学的、機能的な結合度(connectivity)の情報を抽出します。
ネットワークを解析する手法として、主にグラフ理論を用いています。グラフ理論とは、脳を数百の細かい領域(ノード)に分割をして、その領域間が結合しているときには線分(エッジ)で結ぶことで作り出される幾何学的図形を数学的に解析します。その結果、ネットワークとしての機能を、機能的分離の程度、機能的統合の程度、ネットワークのクラスター化の程度などの観点から、定量的に評価することが可能となります。
神経変性疾患では、病気の原因となる異常タンパク質が、特定の進展パターンをとりながら、脳領域特異的に蓄積して行きます。したがって、全脳の構造的な障害パターンには、原因となる異常タンパク質の進展、蓄積が反映されていると推測しています。具体的には、アルツハイマー病やパーキンソン病の患者の3次元T1強調画像を用いて、脳の構造的ネットワークの変化をグラフ理論によって解析し、障害されている領域群をネットワーク論の観点から同定しようとしています。その障害パターンには、アミロイド、タウ、シヌクレインといった疾患特異的なタンパク質の進展、蓄積が反映されていると考えており、その証明を試みています。
将来的には、グラフ理論などのネットワーク解析を、マルチモーダル脳画像の解析に応用し、病態把握、治療によるネットワークの変化の把握、人工知能による学習と判断、へと応用していきます。
多モダリティーの情報から統合的に学習できる「人工知能」の開発
私たちは、先端的脳画像(神経ネットワーク、白質や灰白質の構造の評価、脳ドパミン前終末の画像など)に加えて、歩行解析、動画解析、包括的認知機能評価を、脳の各システムが障害された疾患群を対象に行っており、薬剤の投与前後の評価も含むデータベースを構築し、脳の障害されたシステムの同定や薬剤による治療効果を推定する「マルチモーダル学習」を実装した人工知能の基盤を開発しています。
マルチモーダル脳画像の深層学習による病態把握
我々が集積している先端的脳画像の中には、障害された脳のシステム、発症前の顕在化しない病態、治療効果などの膨大な情報が含まれていることが想定されます。
近年、人工知能が急速に発達し、なかでも特に深層学習を利用した画像分類の精度が飛躍的に向上しています。そこで私たちは、先端的脳画像を入力データとして、疾患名、行動学的指標などを教師データとして与える「教師あり」学習モデルを構築し、未知の患者の先端的脳画像を入力すると、高い精度での病態把握が可能となる人工知能の確立を目指しています。
深層学習に脳MRI画像に適用して解析するには、複数の課題がありますが、下記のように解決しながら進めています。
① 限られたデータ数からの深層学習:転移学習
深層学習は複雑な画像のようなデータを入力とし、高い精度での予測を実現していますが、その性能を発揮するには大量のデータが学習に必要となります。しかしながら医療施設では、そのように大量のデータを集めることは簡単ではありません。そこで、「転移学習」という手法を利用して、目的の画像とは異なる画像を用いて事前に学習させたモデルを用いて、目的の画像を後で追加学習させています。
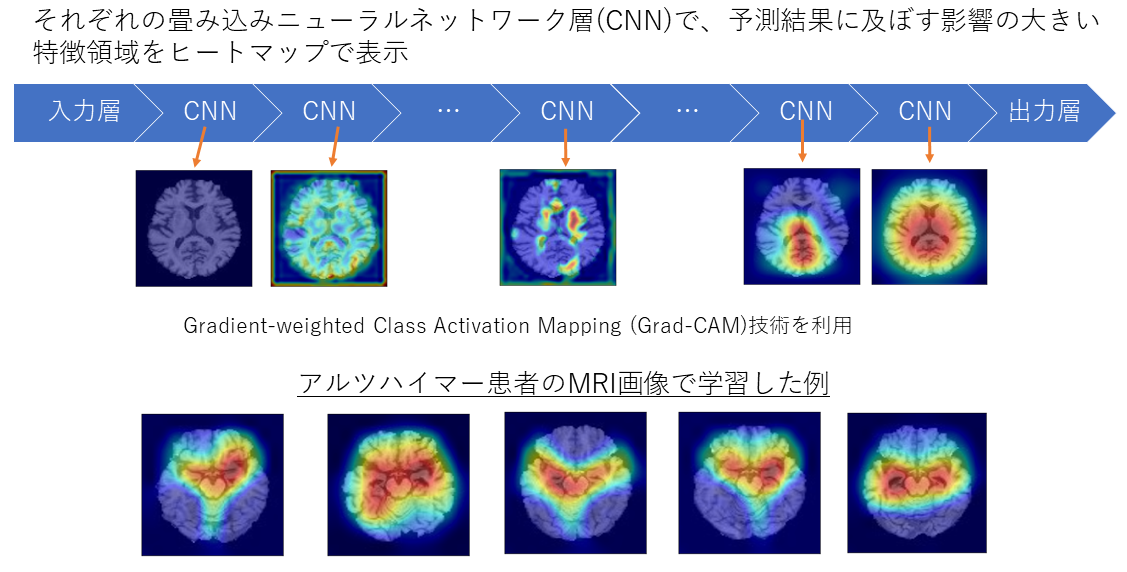
② 深層学習の可視化:Grad-CAM
畳み込みニューラルネットワークを利用した深層学習は、画像認識の領域で高い性能を発揮していますが、判断の過程が不透明であることが課題となっています。そこで、人工知能の判断根拠を可視化するために、私たちは、Grad-CAM (Gradient-weighted Class Activation Mapping)技術を採用しています。これによって、深層学習がMRI画像でどの領域に注目して判断をしたかを可視化しています。
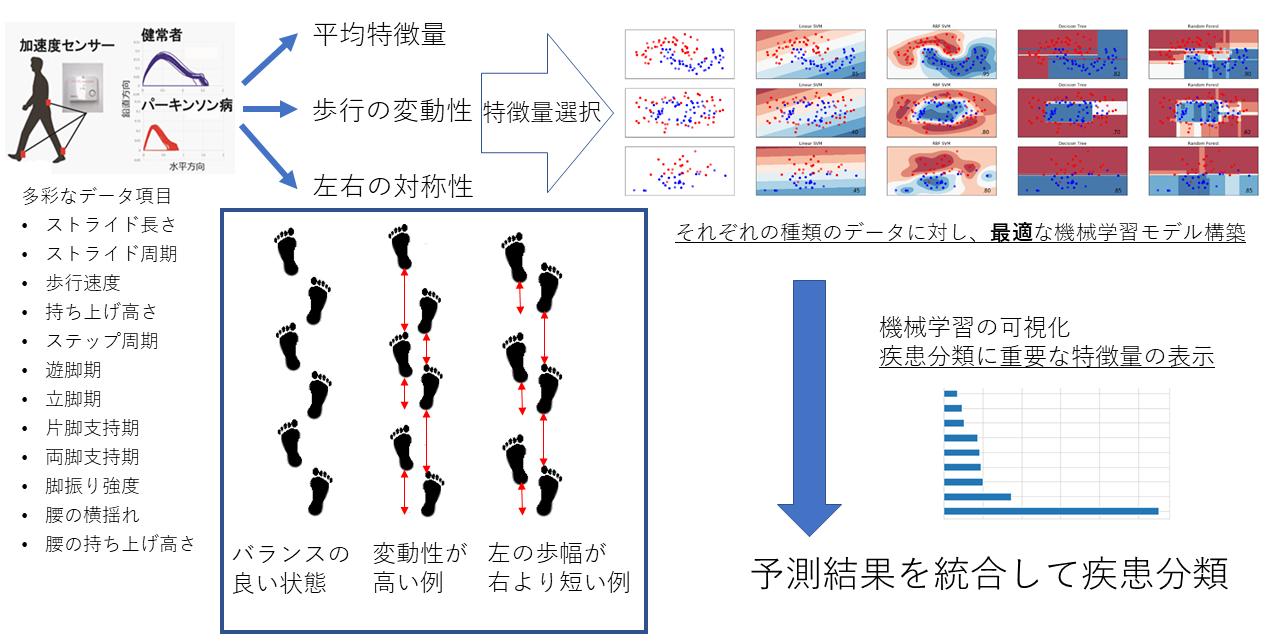
歩行データの機械学習による疾患予測
先行研究でも、ストライド長および歩行速度などの代表的な歩行解析データは、すでに検討されています。一方、私たちのシステムでは、より多くの特徴データを収集しており、病態を反映する有益な情報が含まれていると考えています。現在、歩行解析データからは合計50項目以上の指標が得られていますが、変数間の関係も複雑で統計解析も容易ではないので、機械学習を利用した包括的な解析を進めています。
歩行解析データは、大きく分けると平均値、変動性、左右対称性の3種類に区分されます。それぞれは独立したデータと考えられるため、それぞれに最適な学習モデル(サポートベクターマシン、ランダムフォレスト等)が異なる可能性があります。そのデータごとに最も優れた学習モデルを用いて分析をして、最後に多数決などの方法で疾患および病態の予測を結論します。
脳MRI画像、歩行、認知機能データを統合したマルチモーダル機械学習
私たちは、先端的脳画像、歩行解析、動画解析、包括的認知機能評価を相互に比較しながら、データ駆動方式で学習し、新たな知を創出できるマルチモーダル機械学習の実現を目指しています。具体的には、先端的脳画像に対して、歩行解析、動画解析、包括的認知機能評価を教師データとする「教師あり学習」とすることで、先端的脳画像のみから運動機能や認知機能などを予測できるようにします。こうしたデータベースを構築することで、先端的脳画像のみから、障害された脳のシステム、病態の把握、薬剤による治療効果などの臨床的に重要な情報を引き出せるようになることを目指しています。
さらには、包括的認知機能評価のみから障害された脳のシステムを推測したり、歩行解析や動画解析のみから障害された脳のシステムや認知機能を推測できるようにすることを目指しています。こうした技術開発の結果として、先端的脳画像、歩行解析、動画解析、包括的認知機能評価の一部からでも他のデータを補完的に推測できたり、患者に起きている病態を把握できるようになることを目指しています。
3. 神経疾患の体液バイオマーカーの検索
当教室では、神経疾患のバイオマーカーとなるマイクロRNA(miRNA)の検索を行ってまいりました。2014~2018年度まで独立行政法人新エネルギー・産業技術総合開発機構(NEDO)における「体液中マイクロRNA測定技術基盤開発」に参加し,同開発事業で得られたバイオマーカー候補のmiRNAについて、各種の神経疾患における比較検討を行い、疾患特異度の検討を行うこと、病態生理上の意義付けを検討する役割を担当いたしました。
神経疾患では血液と脳脊髄液中のmiRNAの対比が重要であると考えられますが、脳脊髄液中のmiRNAはその発現量が少ないため、網羅的なアレイ解析方法や定量的評価方法がいまだ確立されていません。私たちは、神経疾患のバイオマーカーとしての脳脊髄液中miRNAの網羅的解析方法を確立することを目標の一つとしています。
臨床の教室としての強みを活かし、運動ニューロン疾患やアルツハイマー病をはじめとする神経変性疾患、多発性硬化症、免疫介在性ニューロパチーなど多様な神経疾患を対象に、臨床情報とRNAデータベースを有機的に統合し、神経疾患の診断、治療に有用なRNAバイオマーカーの研究を進めています。
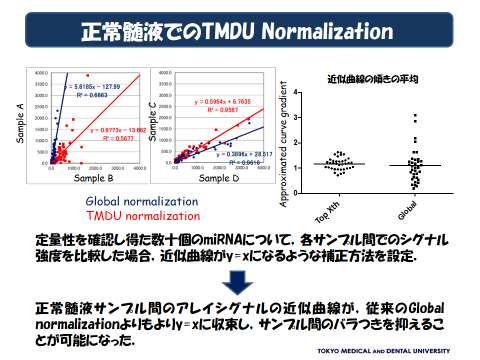
2017年には、髄液および血清のエクソソーム分画のmiRNAに着目し、次世代シークエンサー (NGS)を用いてmiRNA発現のプロファイルを解析・報告しています(Yagi Y, Ohkubo T, Kawaji H, et al. Neurosci Lett. 2017;636:48-57. doi: 10.1016/j.neulet.2016.10.042.)。
4. アルツハイマー病の病態解明と治療薬の開発
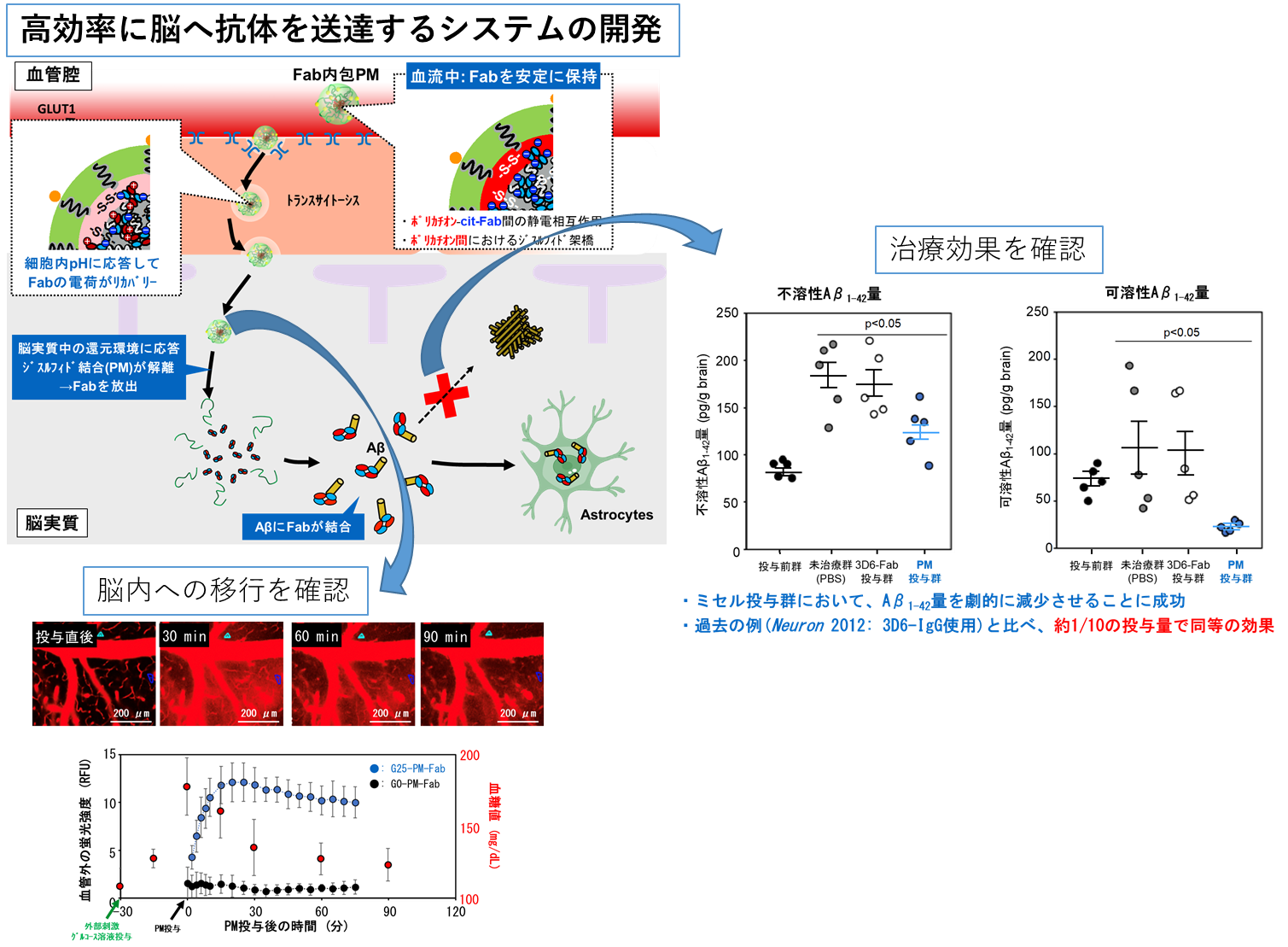
厚生労働省の発表によると、日本国内において、2012年時点で65歳以上の高齢者の15%が認知症であり、認知症の高齢者は約462万人(7人に1人)であり、前段階である軽度認知機能障害が約400万人です。その約半数がアルツハイマー病であると考えられています。アルツハイマー病は65歳以降にその発症率が急増するため、効果的な開発が急務となっています。アルツハイマー病はアミロイドβタンパク質(Aβ)の凝集・沈着した老人班、異常タウタンパク質からなる神経原線維変化、神経細胞の脱落を病理学的特徴としています。近年、アミロイドβ蛋白(Aβ)の低分子重合体であるオリゴマー(AβO)が強い神経毒性を有し、アルツハイマー病発症前の初期病態に強く関わっていることが明らかとなり、AβOやfibrilと呼ばれる線維状凝集体に対する抗体(aducanumab)を用いた臨床研究で、抗体療法の有効性は用量依存性であることが示されました。そこで、当グループでは、新たな血液脳関門通過技術による高効率に脳へ抗体を送達する技術と抗体の遺伝子工学的技術により分子量の小さいフラグメント抗体(Fab)を用いて、抗体そのものを投与した場合よりも高効率に脳内に抗体を送り込むことで、治療効果を発揮する技術を開発しました。マウスに投与した所、Fab抗体単体投与と比べて、約42倍の抗体が脳内に移行しました(下図)。さらに、治療効果を確認するために、アルツハイマー病・モデルマウスに投与して、マウスの脳内の凝集したアミロイドと凝集していないアミロイドを測定したところ、どちらも減少した(下図)ことより、脳内でFab抗体が機能していることが明らかとなりました。今後、この技術を用いて、AβOに対する抗体を効率的に脳内へ導入した際のアルツハイマー病の初期病態への有効性を評価し、臨床応用へ向けて研究を進めてゆきます。
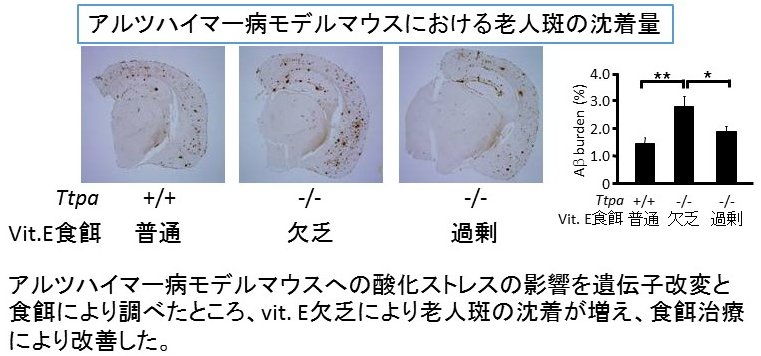
さらに、我々はアルツハイマー病に関係深い酸化ストレスによる病態メカニズムについても研究をすすめています。我々が独自に作製した慢性酸化ストレスモデルマウスである a-TTP ノックアウトマウスを用いて、2006年にアルツハイマー病モデル・マウスの症状が酸化ストレスにより増悪すること(Nishida et al, BBRC 2006)、2009年にはその増悪する機序がアミロイドβ蛋白の脳内からのクリアランス低下によることを報告しました(Nishida et al, JBC 2009)。さらにマイクロアレイ解析などダイナミックに進化し続ける遺伝子や蛋白の網羅的な解析技術を駆使し、老化や酸化ストレスに着目したアルツハイマー病の病態メカニズムに関与する新役者として、Phospholipase A2 group 3 (Pla2g3)を発見しました。Pla2g3が増加することによりアミロイドβ分解酵素であるIDEが減ることを報告しました(Yui et al, PLoS One 2015)。
以上のように社会からの要望に応えるべく、我々は新たなアルツハイマー病の治療法開発に向けて基礎研究に励んでいます。
5. 筋萎縮性側索硬化症(ALS)の原因究明と治療法開発研究
① ALS病態解明に向けて 世界初のALS霊長類モデルの作製
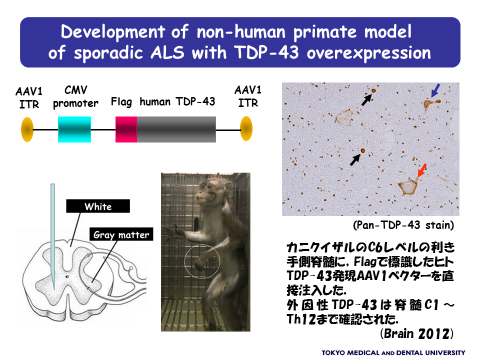
ALSで障害される運動神経細胞の細胞質に形成される異常凝集体の主要成分がTar-DNA binding protein 43 (TDP-43)であることが報告されて以来、ALSの基礎研究は飛躍的に進んでいます。ALSでは本来核内に存在するTDP-43が細胞質に異常局在した上で細胞質内凝集体を形成し、リン酸化、ユビキチン化といった修飾を受け、断片化されることが分かっています。我々の研究室では、TDP-43がどのような機序でALSの病態に関与しているかを調べるために、野生型TDP-43発現アデノ随伴ウイルス(AAV)ベクターを利用しALS霊長類モデルを作製しました(Uchida A. et al, Brain 2012)。このモデルではALS様の運動症状がみられるだけでなく、これまで他の動物モデルでは十分再現できなかったALS患者の病理所見を再現することに成功しており、ALSの病態解明や新規薬の開発に役立つと考えています。
② ALS病変の進展形式 multifocal hits and local propagation hypothesis
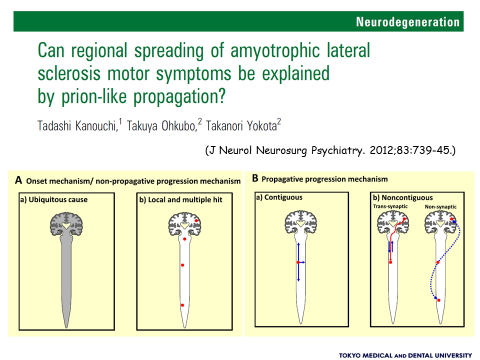
代表的な神経変性疾患であるアルツハイマー病やパーキンソン病では、プリオン病のように疾患に関連するタンパク(タウやαシヌクレイン)がある一定のパターンをもって隣接した領域へ広がっていくことが報告されています。我々はALS患者を対象に経時的な電気生理学的検査を行い、ALSにおける病変の進展形式を評価し、その特徴を考察しました。その結果、ALSにおいては、隣接した領域への単純な進展(single seed and simple propagation hypothesis)のみでなく、遠隔領域への非連続的な進展(multifocal hits and local propagation hypothesis)を示す患者群が存在することが明らかになりました(Sekiguchi T. et al. J Neurol Neurosurg Psychiatry 2013)。
ALSにおける特徴的な病変の進展を担う因子として、我々は細胞外小胞(Extracellular vesicles: EVs、特にexosome)という微小胞に着目して研究を行っています。Exosomeは細胞表面から放出される微小胞であり、その内部にはタンパクだけでなく脂質、microRNAやmRNAなどの核酸が存在することが分かっており、細胞間の情報伝達や不要物の排泄を担っていると考えられています。我々はこのEVの中にTDP-43断片が含まれていることを培養細胞レベルで証明しました。また培養細胞から回収したEVをマウス大脳に接種すると、EV内に存在するTDP-43は神経細胞に取り込まれるだけでなく、神経回路に沿って別の部位へ伝播されることが判明しました。この研究によりALSの疾患進行の機序が明らかになれば、ALSひいてはその他の神経変性疾患の進行を抑制する新たな治療方法の開発が可能となると我々は考えています。
③ ALSの治療法開発 核酸医薬による最先端治療の確立に向けて
ALS1などの常染色体優性遺伝性の神経変性疾患は、原因遺伝子産物のgain of toxic functionにより発症すると考えられています。このような疾患では、変異したRNAやタンパクの発現を抑制することにより、疾患の発症、進行を抑制することが期待できます。我々はsiRNAトランスジェニックマウスを用いてsiRNAでSOD1変異によるALSの発症を大幅に遅延させることに成功し、siRNAで常染色体優性遺伝性神経変性疾患が治療可能であることを示しました(Saito Y. et al. J Biol Chem 2005)。家族性ALSと孤発性ALSは、臨床症状や経過、病理所見に類似点が多く、ある段階からは病態生理を共有している可能性が高いと考えられます。このような家族性ALSで有効な核酸医薬による治療はALSのうち多くを占める孤発性ALSでも効果がある可能性があります。我々は、最先端の核酸創薬の技術を利用しALSの遺伝子治療の開発に取り組んでいます。
6. 脳血管障害の研究
① 臨床研究
(1)側副血行路の研究
脳梗塞を対象に、近年発展を遂げている急性再開通療法(血栓溶解療法や血栓回収療法)の適応決定や機能的転帰の改善に大きく影響する側副血行路に着目し、画像を中心とした臨床研究を行っております。また、当院血管内治療科と共同で行なっている脳梗塞の急性再開通療法時の側副血行路評価などにも応用し、脳梗塞の最適な血行動態制御を目指しています。
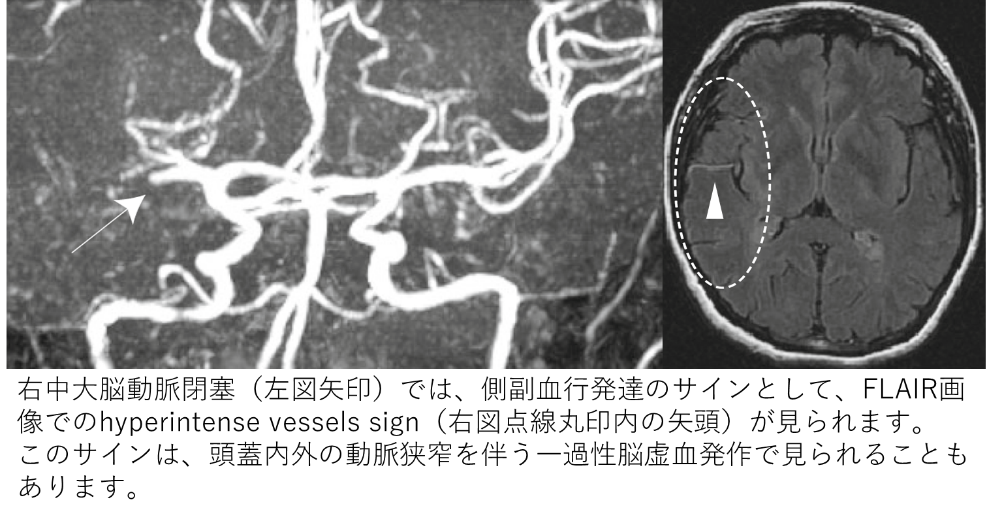
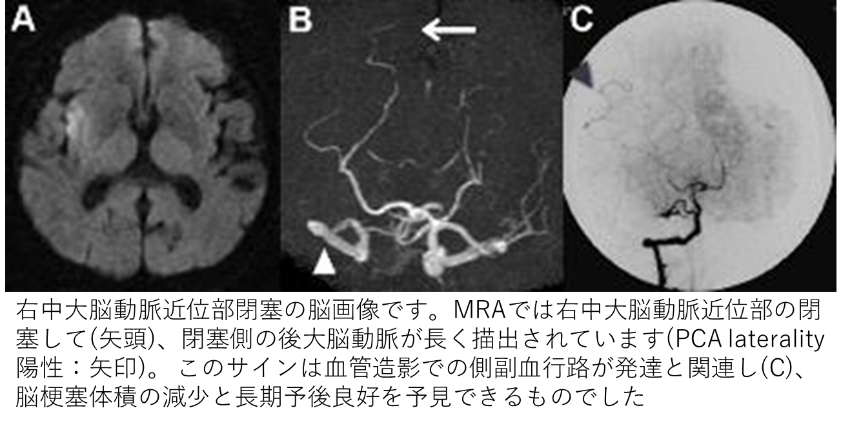
我々は、この側副血行路をMRIや脳血管造影検査で評価し、血栓溶解療法施行例において、側副血行発達が良好な転帰と強く関連していることや、閉塞した血管が血栓溶解療法により再開通すると側副血行路サインが明瞭に変化し、その変化は神経症状の改善と関連することも報告しました(Ichijo M, et al. Stroke. 2013;44: 512-515.、Ichijo M, et al. AJNR Am J Neuroradiol. 2015;36:1839-45.)。また、脳梗塞だけではなく、頭蓋内外の動脈狭窄を伴う一過性脳虚血発作でも側副血行路の発達が観察されることも報告しました(Yoshioka K, et al. Neuroradiology. 2013;55:165-169.)。このように、良好な転帰と関連し、臨床的に重要な側副血行路ですが、その発達の程度は個人差が大きく、側副血行発達に影響を与える因子を解析した結果、慢性的な高血圧症に罹患している患者さんでは、この側副血流が発達しにくいことを報告しました(Fujita K, et al. Stroke. 2019;50:1751-1757.)。
(2)発作性心房細動の予測スコアの開発
原因不明の脳梗塞における主要因である発作性心房細動の予測因子を前向き・多施設で検討し、発作性心房細動を予測する簡便な臨床スコアとして“iPAB スコア(identified by Past history of arrhythmia or antiarrhythmic agent use, Atrial dilation, and BNP elevation)”を開発しました。このスコアを用いることで、原因不明の脳梗塞の再発予防に向けた、より適切な抗血栓薬の選択を目指しています。
以上のように、我々は、脳卒中の適切な診断、機能的転帰の改善、最適な治療方針決定に繋がるような、実際の臨床へ生かすことのできる脳血管障害の臨床研究に取り組んでいます。
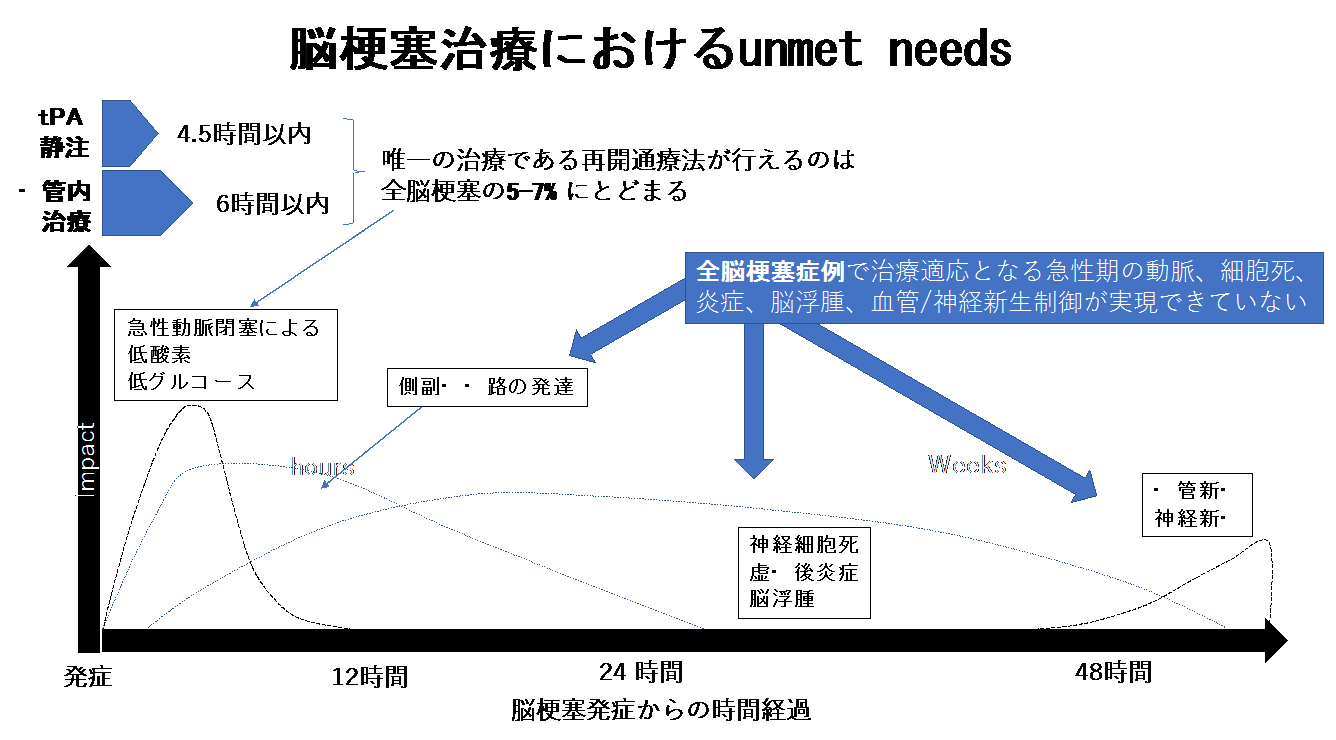
② 基礎研究
近年、rt-PA静注療法や血管内治療による超急性期治療が可能となり閉塞血管を再開通させることで、脳梗塞の症状の軽減が期待できます。しかし、時間的制約などの理由で適応となる症例は限られています。一方で、脳梗塞のすべての症例で起きる細胞死、炎症、脳浮腫、また血管/神経新生といった病態を制御するについては、今後の治療適応となりえますが実現できておりません。我々は、これらをターゲットにした治療法開発に取り組んでいます。主に脳梗塞モデルマウス及び、細胞脳虚血モデルを使って臨床応用へむけた新たな治療法を開発しています。
a. 新世代核酸医薬を用いた新規治療薬の開発
我々は、抜群の遺伝子抑制効果を持つヘテロ核酸(核酸グループの研究内容を参照)を使用し、脳梗塞に対する新規治療の確立を目指しています。我々は、脳梗塞急性期で脂質関連受容体が血管内皮細胞に強く発現することを見出し、脂質ライガンドを結合させたヘテロ核酸を用いて非常に高い効率で送達されることを明らかにしました。脂質ライガンド結合型ヘテロ核酸を用いて脳梗塞の遺伝子制御を行い、臨床応用へと発展させることを目標としています。
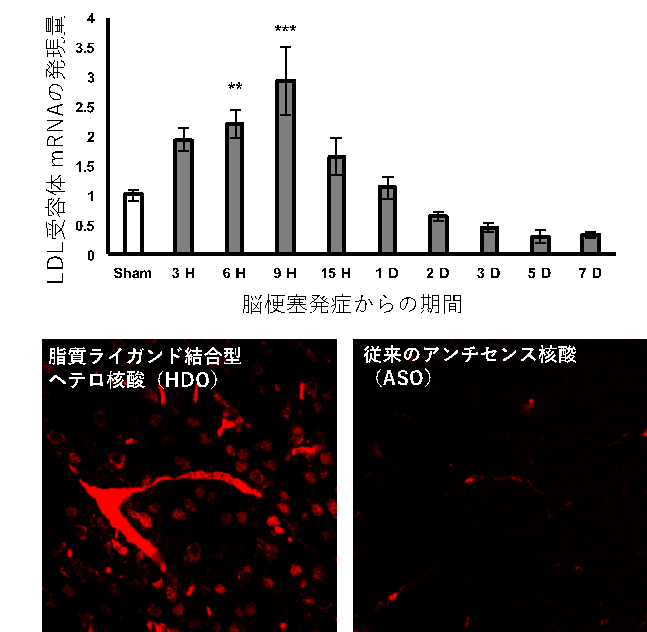
下段:脂質ライガンド結合型HDOはASOと比較して脳梗塞部位でのデリバリー効率が著明に上昇する(赤いシグナルは蛍光色素を結合した核酸)。
b. 側副血行路に関する基礎研究
臨床的に見出した側副血行路による脳保護効果を人為的に発揮させるための手段の開発として、S1PR1(Sphingosine 1-phosphate receptor 1)シグナルに注目しました。マウスの慢性低灌流モデルを作成し、S1PR1アゴニストを投与すると、側副血行路の発達を促すことを見出しました(Ichijo M, et al. PLoS One. 10: e0138029, 2015)。さらに、脳梗塞発症後の急性期でS1PR1アゴニストを投与することにより梗塞巣の減少、神経症状の改善が得られることを示しました。さらにその背景として側副血行路の発達に加えて、梗塞周囲の血管新生や、脳血流関門の破綻を制御することが関与していることを示しました(Iwasawa E, et al. J Stroke Cerebrovasc Dis. 27:1237-51, 2018)。
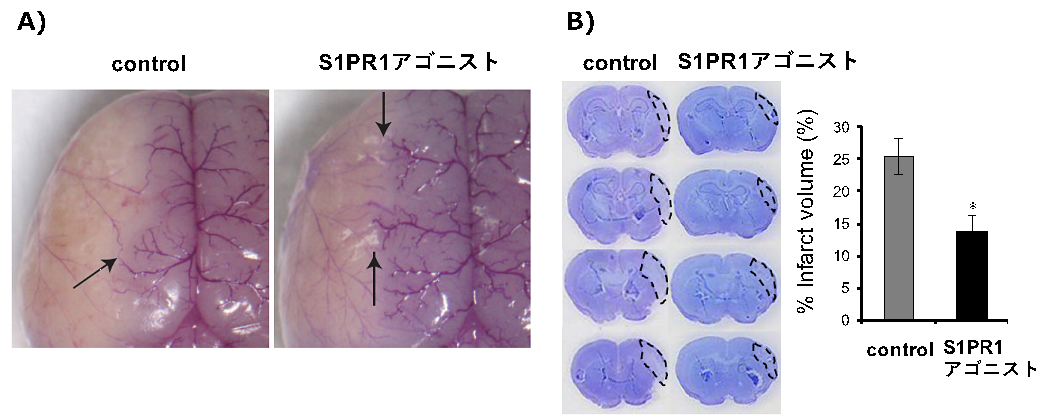
B)SEWを投与すると、対照群(左)と比較して脳梗塞巣体積は減少しています。
7. 脊髄小脳変性症の分子遺伝学的方法による病態解明、及び治療法開発
分子遺伝学・病態科学研究室
①脊髄小脳変性症の病態解明と治療法開発のための研究
②多系統萎縮症(MSA)の病態解明
③臨床試験
④バイオインフォマティクスを活用した分子遺伝学的な病態研究
① 脊髄小脳変性症の病態解明と治療法開発のための研究
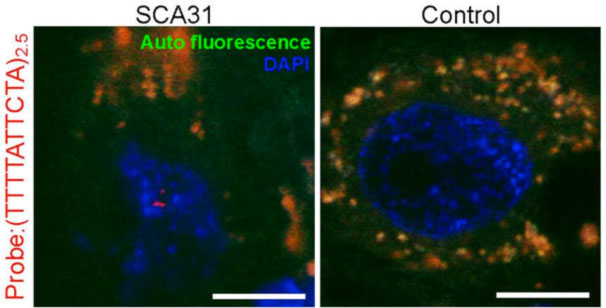
当研究グループは1997年4月に発足し、α1A-カルシウムチャネル遺伝子の3塩(CAG)繰り返し配列の異常伸長で起きるSCA6と、非コード型5塩基繰り返し配列が2方向に転写されて起きるSCA31という2つの疾患について研究をしてきました。 SCA6については、遺伝子座解明と臨床症状と遺伝子変異との関係(Ishikawa et al. AJHG, 1997; Takahashi H. et al. J Hum Genet, 2003)、患者脳内でカルシウムチャネルが凝集することの世界的発見(Ishikawa K. et al. Hum Mol Genet, 1999; Ishikawa K. et al. Neurology, 2001; Ishiguro T. et al. Acta Neuropathol, 2010)(図1)などを行い、
脳統合機能研究センター渡瀬啓准教授と共同して動物モデル作製・解析にも貢献しました (Watase K. et al. PNAS, 2008; Unno T. et al. PNAS, 2012)。現在でも患者脳で蛋白凝集が起こす病態の研究を継続しており(Takahashi M et al, 2013, PLoS One)、世界中からSCA6の標本を受け入れて独自の特異抗体で免疫染色を行っております。 SCA31については、2000年に原因遺伝子座を発見し (Nagaoka U, et al. Neurology, 2000)、ヒトゲノムがまだ未解読の時代に独自で物理地図絞り込みを行い (Li M, et al. J Hum Genet, 2003),候補遺伝子puratrophin-1の発見と創始者ハプロタイプの解明 (Ishikawa K & Toru S et al. AJHG, 2005; Amino T et al. J Hum Genet, 2007)を経て、遂に2009年に原因が2つの遺伝子BEANとTK2の共有するイントロン内に存在する5塩基繰り返し配列であることを突き止めることができました (Sato N & Amino T et al, AJHG, 2009)。その成果はNHKニュース「おはよう日本」でも報道されました。SCA31の病態は、SCA6と異なり非コード型RNAリピートの存在が重要です。患者脳では、図2のようにRNAの異常凝集が見えます。なぜこのような凝集体が形成され、それがどのような意味を持つのか、異常RNAの配列やRNAに結合する蛋白の解明などについてモデルマウスやモデル培養細胞を用いて研究し、培養細胞でもRNAの高次構造異常が確認され、それが細胞寿命に影響することも報告しました(Niimi Y. et al., Neuropathology,2013)。共同研究の体制は、国内だけでなく、海外(アメリカ、ドイツ、フランス、カナダなど)の一流研究者とも盛んに行っております。
今後も私たちはこれらの疾患の根本的な治療法開発を目指して研究を進めたいと思っております。
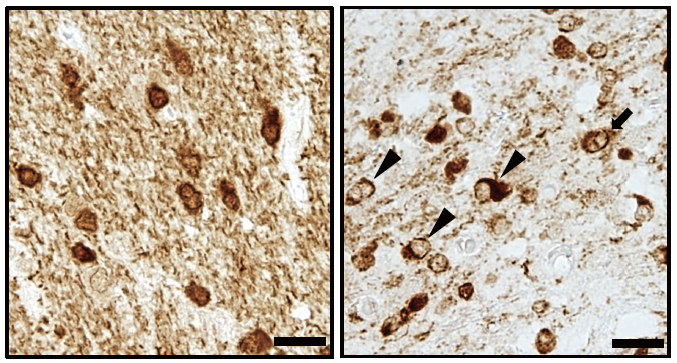
② 多系統萎縮症(MSA)の病態解明
多系統萎縮症(MSA)は、脊髄小脳変性症の中でも最も多く、かつ最も多彩で重症な症状を取り易い疾患です。私達は、α-シヌクレイン蛋白が凝集するというこの病気の特徴的な変化(図4)が生じる前段階で、神経細胞や神経膠(グリア)細胞にどのような異常が起きているのか?という疑問を持って研究を開始し、TPPP/p25αというタンパク質がα-シヌクレインの凝集よりも早期に核内から細胞質に移動し、病態の発生に関連している可能性があることを突き止めました(Ota et al, Acta Neuropathol. Commun. 2014)。TPPP/p25αはミトコンドリアにも局在する蛋白で、ミトコンドリアとGCIの関係についての研究も続けております。
③ 臨床試験
2015年度、多系統萎縮症についての多施設共同研究の予定でおります。そのほか、脊髄小脳変性症の一部についての臨床試験の計画もございます。詳細は、本学医学部付属病院臨床試験センターホームページに2015年7月以降に順次公開する計画です。
④バイオインフォマティクスを活用した分子遺伝学的な病態研究
現代は、情報過多とも言えるデータベースなどの充実とともに、情報科学的な病態研究の方法が分子生物学のデータ解釈におけるあらゆる局面において重要性を増してきております。まだこれ単独では具体的な業績につながっておりませんが今後も継続して注力していきます。
8. 血液脳関門の機能制御を目指した研究
血液脳関門は、多発性硬化症・アルツハイマー病・脳梗塞といった様々な疾患において病態形成に関わる多くの分子を発現しており、近年その重要性が広く認識されています。血液脳関門の機能を制御する技術を確立することは、これらの疾患の画期的な治療法として大きく展開する可能性を秘めています (Kuwahara H, et al. Ther Deliv 3: 417-420, 2012)。また、血液脳関門に主に発現しているグルコーストランスポーターtype1 (GLUT1) がアルツハイマー病の病態に深く関わっていることを発見し、報告しています (Winkler EA, Nishida Y, Sagare AP, et al. Nat Neurosci 18: 521-30, 2015)。
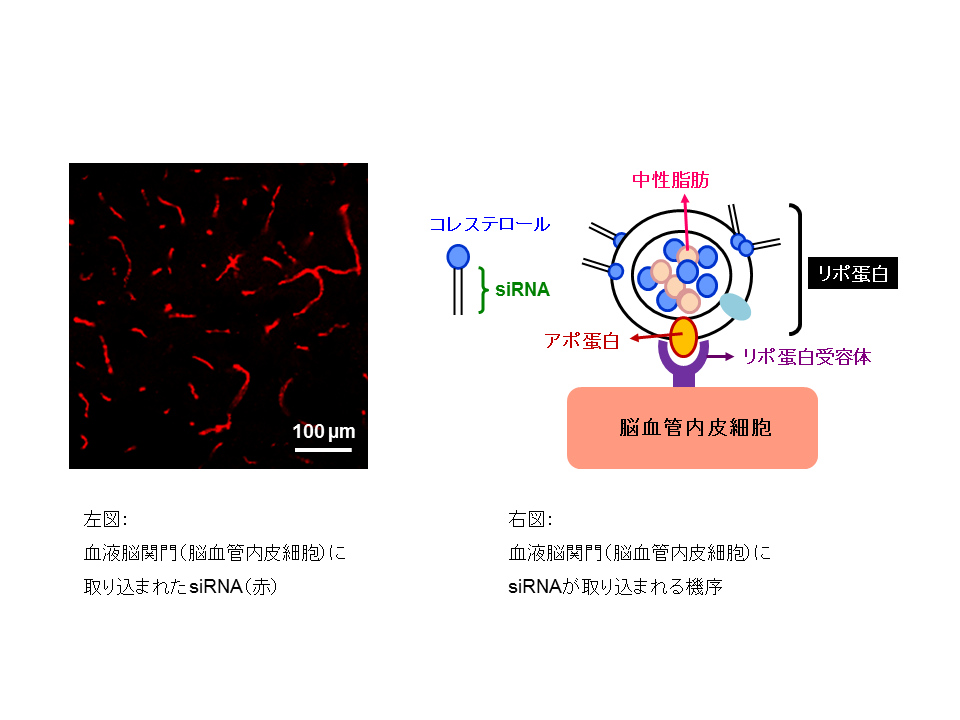
我々は、RNA干渉を誘導するshort-interfering RNA (siRNA) をマウスへの全身投与にて血液脳関門に送達し、血液脳関門の遺伝子発現を制御する研究において、これまでに世界で先駆的な成果を遂げています。RNA干渉は、遺伝子発現抑制法の強力なツールとして臨床応用への期待が大きいですが、生体内における効率的かつ安全なsiRNAのデリバリー法の確立が最大の課題となっています。まず開発に着手したハイドロダイナミクス投与法による血液脳関門へのsiRNAのデリバリーは、世界で初めて血液脳関門の遺伝子発現制御を可能にした報告となりました (Hino T, et al. Biochem Biophys Res Commun 340: 263-7, 2006) が、圧負荷や容量負荷が大きいデリバリー法のため、臨床応用できる新たな方法が必要でした。次に、コレステロールがリポ蛋白によって血中から血液脳関門に輸送されている生理学的特徴に着目し、コレステロールを結合させたsiRNAを内在性リポ蛋白に取り込ませた上で、通常の静脈内投与にて血液脳関門の遺伝子発現制御を実現する方法を開発しました (図参照、Kuwahara H, et al. Mol Ther 19: 2213-21, 2011) 。
現在は、さらに効率的かつ安全な血液脳関門の機能制御を目指すべく、最近我々の研究室で開発した有効性の高いヘテロ核酸および脳への指向性を向上させる新たなデリバリー戦略を取り入れた研究を進めています。また、各種神経疾患のモデル動物に対する治療効果を検証する研究を予定しており、最終的には難治性神経疾患に対する臨床応用へと発展させることを視野に入れています。
9. 神経生理学的な臨床研究
臨床的な小脳機構評価法の開発
小脳は、バランスを取る機能だけでなく、「体で覚える」ことや「体が記憶する」ことを可能にしている脳です。たとえば、昔乗れた自転車に、何十年経っても体が覚えている、というのも小脳が関わっていると言われています。ですので、どんな人にも小脳の働きが必須です。
私達は、このような「秘められた脳機能」の一つである小脳の運動学習機能(別名:適応機能)を正確に定量的に評価できる装置を、理研脳科学(BSI)と共同開発しました(特許出願済;文部科学省受託研究 脳科学研究戦略推進プログラム(課題E))。
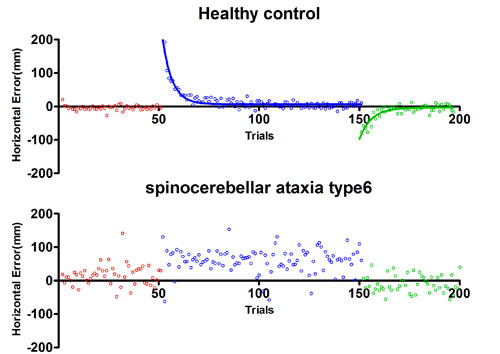
この研究成果はPLoS ONE誌より2015年3月に公開されました(Hashimoto Y. & Honda T. et al. PLoS ONE, 2015)。 この機器を用いて、小脳のどの部分で学習しているのかを明らかにし、例えば薬でどのように改善するかを明らかにしたいと考えています。
10. 脱髄性中枢神経疾患における神経変性プロセスの解析
多発性硬化症(Multiple sclerosis, MS)や視神経脊髄炎(Neuromyelitis Optica Spectrum Disorders, NMOSD)における脳萎縮に関して、脳の萎縮、記憶力障害、注意障害などを、日本人の患者さんにおいて評価し、関連性を調べています(下図)。
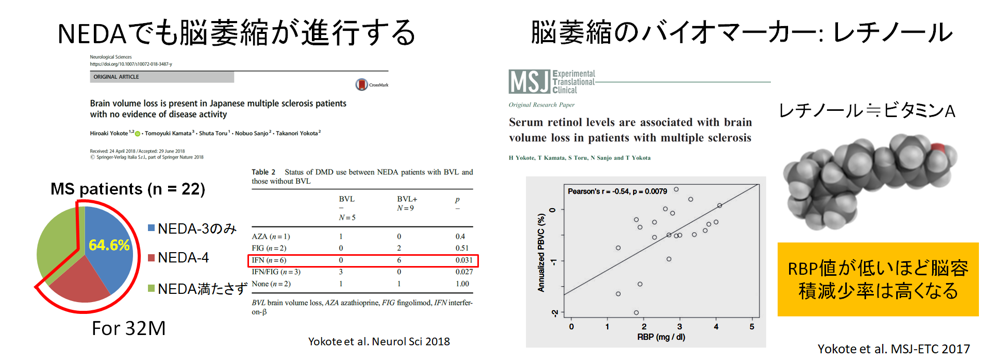
近年、MS/NMOSD分野では次々に新薬が開発、発売され、no evidence of disease activity-3(NEDA-3; 再発なし、MRI活動なし、障害進行なし)とよばれる状態をゴールとして治療を行うことが提唱されています。しかしながら、これらを満たしていても脳萎縮が進行しうることが知られてきています。我々は、日本人患者さんにおいてもNEDA-3を満たしていても脳萎縮がみられることが高率にあることを日本人のデータとしてはじめて示しました(Yokote et al, 2018)。また、脳萎縮を予測するバイオマーカーとしては血液中ニューロフィラメント軽鎖(neurofilament light)が有望ですが、神経細胞の破壊があれば他の神経変性疾患でも上昇がみられ疾患特異性が低いことが問題です。我々は、免疫調整能をもつレチノールに注目し、血液中レチノール濃度(レチノール結合蛋白で代用)が低いほど年間脳萎縮率が高くなることを示しました (Yokote et al. 2017)。
さらに、最近ではMSにおける脳萎縮の病態の根底にある“inflammation”に注目し様々なサイトカインやケモカイン、リンパ球サブタイプとの関連を調べています。
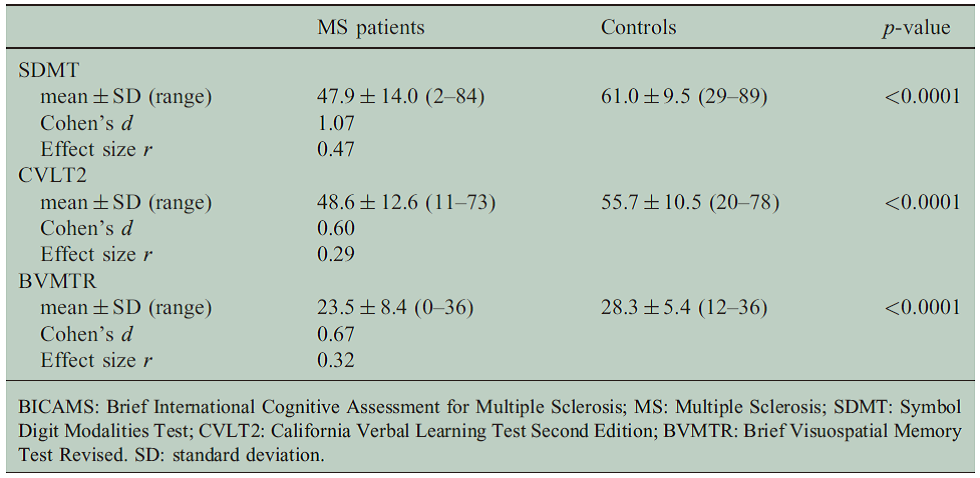
他施設とも共同研究を進めており、脳細胞の変性を写すことのできる脳MRI撮影や、脳脊髄液や血液中のバイオマーカーを測定・解析することにより、脳萎縮のリスク因子の解析を行っています。また、多発性硬化症の患者さんにおける簡易型認知機能評価であるBrief International Cognitive Assessment for MS (BICAMS)の日本語版のバリデーションに協力しています(Niinoら, 2017)。
多発性硬化症 (MS)、視神経脊髄炎関連疾患 (NMOSD)、ギラン・バレー症候群 (GBS)、フィッシャー症候群、慢性炎症性脱髄性多発根ニューロパチー (CIDP)、多巣性運動性ニューロパチー (MMN)、重症筋無力症 (MG)、炎症性筋疾患といった免疫性神経疾患は、自己免疫機序による神経難病です。 これら免疫性神経疾患では、主に副腎皮質ステロイド薬、血漿浄化療法、大量免疫グロブリン静注療法 (IVIg)、各種免疫抑制剤による治療が行われています。
大量免疫グロブリン静注療法 (IVIg)は広く安全に行われている治療ではありますが、問題となる合併症の一つに血栓塞栓症が挙げられます。当教室では、これまでに大量免疫グロブリン静注療法 (IVIg)を施行した免疫性神経疾患患者の診療経過を解析し、血栓塞栓症のリスク因子を検討する研究を行っています。
11. 神経病理学的研究
病理部門では大きく2つの役割を担っています。1つは臨床診断で、当研究室では大学病院をはじめ、関連施設から年間100~150例の末梢神経・筋生検組織が届けられ、標本作製から診断までという大変重要な部分を行っています。
もう1つは実験病理や剖検脳の検討で、難治性疾患の多い神経疾患の病態を解明し、新たな治療法開発を目指しています。
虚血性末梢神経障害モデルマウスを使用した末梢神経再生療法の開発
血管炎や糖尿病による虚血性末梢神経障害は、しばしば強い神経障害の原因となって自力歩行が難しくなる方が多くいます。しかしながら、障害された末梢神経は再生能力が弱く、後遺症が永続します。
我々は、虚血性末梢神経障害モデルマウスを用いて末梢神経障害の再生治療を開発しています。我々は、内因性の未分化シュワン細胞が虚血により増殖し、髄鞘の再生を促すことを確認しました。またその際に、p75NTRという受容体の発現が未分化シュワン細胞で亢進することを発見し、この受容体のシグナルを制御することにより末梢神経の再生を促せることが出来ると考え、検討を続けています。
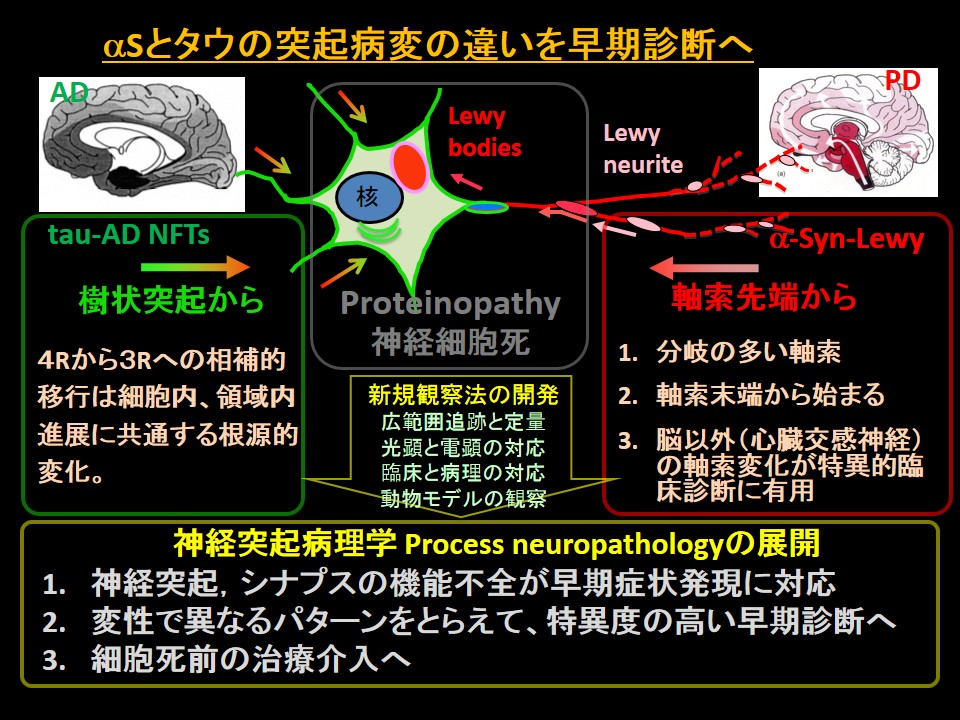
アルツハイマー病のタウやパーキンソン病のαシヌクレイン等の疾患関連蛋白が神経細胞体内に凝集物を作り、神経細胞死を起こすという Proteinopathyパラダイムは神経変性疾患の分子病態の理解を深めてきました。我々は凝集体形成や細胞死が起こる前に樹状突起や軸索に病変や機能障害が起こることを明らかにしています。細胞死に先行する突起病変に注目するこの「神経突起病理学」は突起病変に関連する疾患特異的な早期症状に基づく、特異度の高い診断に結びつき、細胞死が起こる前の治療介入へと道を拓く新たな視点を提供します。
研究業績
順次、業績リストを更新します
東京科学大学 研究情報データベースへのリンクはこちら
