A01
応答ゾーン、連携ゾーンの解析
小胞体・ミトコンドリア連関に着目した運動神経変性機序の解明
研究概要
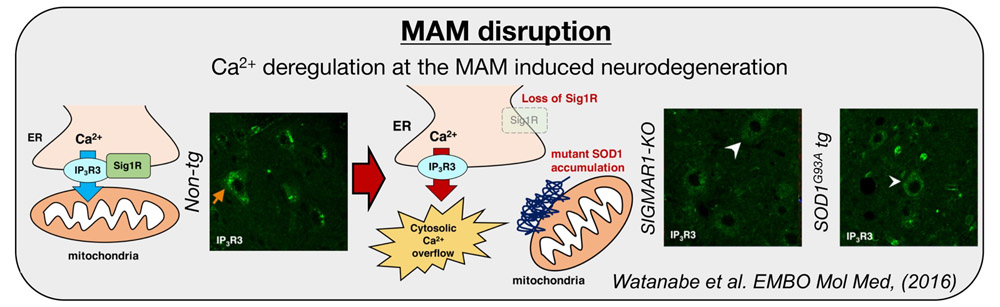
小胞体、ミトコンドリアの異常が運動神経の変性機序として知られている筋萎縮性側索硬化症(ALS)において、オルガネラゾーンとしての小胞体・ミトコンドリア接触部(MAM: mitochondria-associated membrane)の関与は、それぞれのオルガネラ異常仮説を統合的に説明できる病態機序として注目されている。我々は、これまでにMAMに局在するタンパク質、Sigma1受容体(Sigma1R)がMAMの構造維持やIP3受容体3型を介した細胞内カルシウム代謝の制御に極めて重要であることを見出し、Sigma1RをコードするSIGMAR1遺伝子上の新たな変異を若年性ALSの原因として同定した。さらに、モデルマウスを用いて、SOD1遺伝子の優性遺伝によるALSにおいてもSigma1R の異常を介してMAMの破綻が生じ、細胞内カルシウム代謝の異常化を介して神経変性に至るメカニズムも見出した。SIGMAR1、SOD1と異なる2つの遺伝子を原因とするALSモデルで共通してMAMの破綻が観察されたことから、我々はMAMの破綻が運動神経変性に広く共通する分子メカニズムとなる可能性を提唱してきた。このような背景から、本研究課題では、1) ALSの運動神経細胞において MAMの破綻に至る分子機構の解明、2)MAM破綻の下流イベントの解明:神経変性に関わる分子カスケードの同定を目指す。
代表的な原著論文
- Watanabe, S., Komine, O., Endo, F., Wakasugi, K., Yamanaka, K. (2018) Intracerebroventricular administration of Cystatin C ameliorates disease in SOD1-linked amyotrophic lateral sclerosis mice. J. Neurochem. 145, 80-89.
- Watanabe, S., Ilieva, H., Tamada, H., Nomura, H., Komine, O., Endo, F., Jin, S., Mancias, P., Kiyama, H., Yamanaka, K. (2016) Mitochondria-associated membrane collapse is a common pathomechanism in SIGMAR1- and SOD1-linked ALS. EMBO Mol. Med. 8, 1421-1437.
- Austin, J.A., Wright, G.S., Watanabe, S., Grossmann, J.G., Antonyuk, S.V., Yamanaka, K., Hasnain, S.S. (2014) Aggregation resistant TDP-43 RRM domain disease mutants have increased stability and half-life. Proc. Natl. Acad. Sci. USA. 111, 4309-14.
- Israelson, A., Arbel, N., Da Cruz, S., Ilieva, H., Yamanaka, K., Shoshan-Barmatz, V., Clevalend, D.W. (2010) Misfolded Mutant SOD1 Directly Inhibits VDAC1 Conductance in a Mouse Model of Inherited ALS. Neuron 67, 575-87.