核小体オルガネラゾーンにおけるストレス制御機構や癌の発症進展機構
研究概要
リボソーム生合成は、細胞内の最大のエネルギー消費過程であるため、細胞にとって最重要なイベントである。リボソーム生合成低下の監視システムは核小体に存在すると言われているものの、その機構は未だ十分解明されていない。
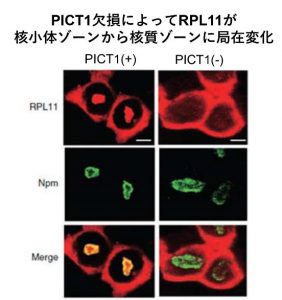
我々はこれまでに、「リボソーム生合成低下」によって核小体に局在するPICT1が速やかに消失すること、それによってRPL11が核小体ゾーンから核質ゾーンに局在変化して、細胞死をきたすことを報告してきた。
本研究では、リボソーム生合成障害によって引き起こされる、(1)核小体オルガネラゾーンにおけるストレス感知・制御機構や、(2)癌の発症進展制御機構などの解明を目指す。
代表的な原著論文
-
Omori, H., Nishio, M., Masuda, M., Miyachi, Y., Ueda, F., Nakano, T., Sato, K., Mimori, K., Taguchi, K., Hikasa, H., Nishina, H., Tashiro, H., Kiyono, T., Mak, T.W., Nakao, K., Nakagawa, T., Maehama, T., Suzuki, A. (2020) YAP1 is a potent driver of the onset and progression of oral squamous cell carcinoma. Sci Adv. 18;6(12):eaay3324.
-
Goto, H., Nishio, M., To, Y., Oishi, T., Miyachi, Y., Maehama, T., Nishina, H., Akiyama, H., Mak, T.W., Makii, Y., Saito, T., Yasoda, A., Tsumaki, N., Suzuki, A. (2018) Loss of Mob1a/b in mice results in chondrodysplasia due to YAP1/TAZ-TEADs-dependent repression of SOX9. Development 145(6), pii: dev159244.
-
Nishio, M., Sugimachi, K., Goto, H., Wang, J., Morikawa, T., Miyachi, Y., Takano, Y., Hikasa, H., Itoh, T., Suzuki, S.O., Kurihara, H., Aishima, S., Leask, A., Sasaki, T., Nakano, T., Nishina, H., Nishikawa, Y., Sekido, Y., Nakao, K., Shin-ya, K., Mimori, K., Suzuki, A. (2016) Dysregulated YAP1/TAZ and TGF-beta signaling mediate hepatocarcinogenesis in Mob1a/1b-deficient mice. Proc. Natl. Acad. Sci. USA 113(1), E71-80.
-
Nishio, M., Hamada, K., Kawahara, K., Sasaki, M., Noguchi, F., Chiba, S., Mizuno, K., Suzuki, S.O., Dong, Y., Tokuda, M., Morikawa, T., Hikasa, H., Eggenschwiler, J., Yabuta, N., Nojima, H., Nakagawa, K., Hata, Y., Nishina, H., Mimori, K., Mori, M., Sasaki, T., Mak, T.W., Nakano, T., Itami, S., Suzuki, A (2012) Cancer susceptibility and embryonic lethality in Mob1a/1b double-mutant mice J. Clin. Invest 122(12), 4505-18.
-
Sasaki, M., Kawahara, K., Nishio, M., Mimori, K., Kogo, R., Hamada, K., Itoh, B., Wang, J., Komatsu, Y., Yang, Y.R., Hikasa, H., Horie, Y., Yamashita, T., Kamijo, T., Zhang, Y., Zhu, Y., Prives, C., Nakano, T., Mak, T.W., Sasaki, T., Marehama, T., Mori, M., Suzuki, A. (2011) Regulation of the MDM2-P53 pathway and tumor growth by PICT1 via nucleolar RPL11. Nat. Med. 17(8): 944-951.
総説
-
Nishio, M., Maehama, T., Goto, H., Nakatani, K., Kato, W., Omori, H., Miyachi, Y., Togashi, H., Shimono, Y., Suzuki, A. (2017) Hippo vs. Crab: Tissue-specific functions of the mammalian Hippo pathway Genes Cells 22(1):6-31
-
Nakatani, K., Maehama, T., Nishio, M., Goto, H., Kato, W., Omori, H., Miyachi, Y., Togashi, H., Shimono, Y., Suzuki, A. (2016) Targeting the Hippo Signaling Pathway for Cancer Treatment. J. Biochem., pii: mvw074.
-
Nishio, M., Goto, H., Suzuki, M., Fujimoto, A., Mimori, K., Suzuki, A. The Hippo Signaling Pathway: A Candidate New Drug Target for Malignant Tumors (2015) INNOVATIVE MEDICINE : Basic Research and Development, Springer, 79-94
- Suzuki, A., Kogo, R., Kawahara, K., Sasaki, M., Nishio, M., Maehama, T., Sasaki, T., Mimori, K., Mori, M. (2012) A new PICTure of the nucleolar stress Cancer Sci 103(4), 632-637.
- 河原康一、西尾美希、佐々木雅人、前濱朝彦、佐々木雄彦、古後龍之介、三森功士、森正樹、鈴木聡. (2012) PICT1による核小体ストレス経路を介したp53と腫瘍進展制御~腫瘍予後マーカーや今後の創薬応用にむけて~ 遺伝子Mook22号 最新疾患モデルと病態解明、創薬応用研究、細胞医薬創製研究の最前線、メディカルドゥ社 260-65.