小胞体―ミトコンドリア連携ゾーンにおけるII型膜タンパク質CKAP4の機能解析
研究概要
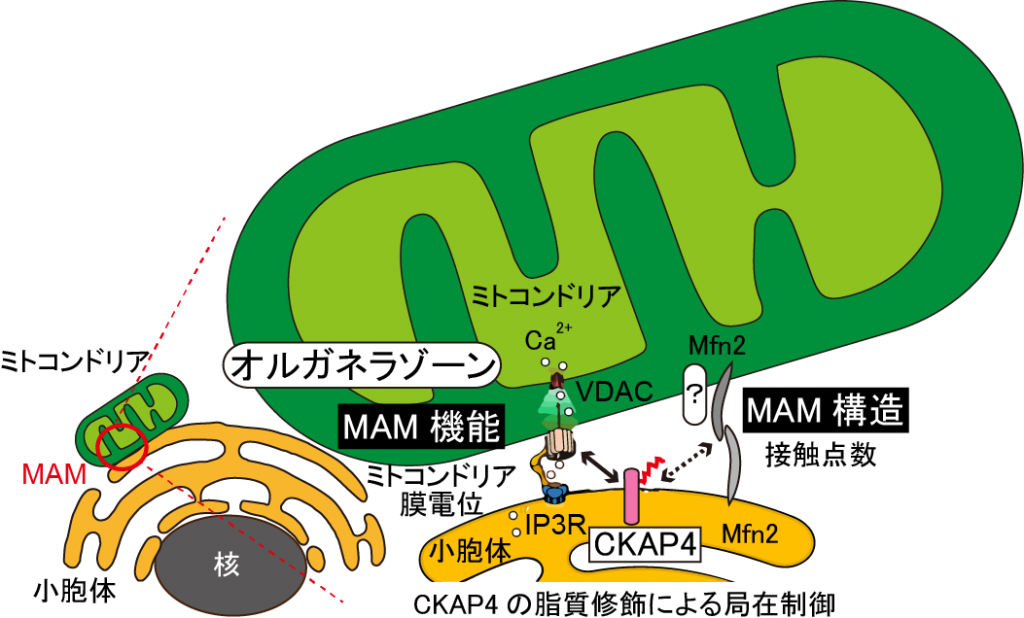
小胞体は核膜からはじまり細胞の全体に広がる構造であり、小胞体上には他のオルガネラと接触するサブドメイン(連携ゾーン)が存在することが明らかになりつつあります。しかし、小胞体と他のオルガネラとの接触点の形成機構や生理的な意義については依然として明らかになっていません。CKAP4 (cytoskeleton-associated protein 4)は主として小胞体に局在し、N端側を細胞質側に、C端側を小胞体内腔側に向けるII型膜タンパク質であり、微小管を束化して小胞体に係留させ、小胞体の構造維持に関与することが報告されていますが、その分子基盤は確立していません。私共は、CKAP4の新規結合タンパク質を探索する過程で、CKAP4がミトコンドリア外膜に存在するチャネルタンパク質VDAC2と結合することを見出しました。CKAP4とVADC2の結合には、CKAP4の細胞質領域に存在する100番目のシステイン残基 (Cys100)のパルミチン酸化修飾が必要でした。CKAP4をノックアウトすると、小胞体の構造異常に加えて、ミトコンドリアの膜電位が低下するとともに、小胞体とミトコンドリアとの接触領域であるMAM(mitochondria-associated membrane)が増加しました。そこで本研究では、CKAP4のMAM形成における役割や、CKAP4がVDAC2との相互作用を介して、ミトコンドリアの機能を制御する新規の分子機構を明らかにすることを目的としています。一方、私共はCKAP4が細胞膜にも局在して、細胞増殖制御因子DKK1の新規受容体として機能し、PI3K-AKT経路を活性化することにより、膵癌や肺癌、食道癌の悪性化を促進することを明らかにしました。CKAP4の小胞体から細胞膜への輸送に関してA02「選別輸送ゾーン」とも連携して解明することを目指したいと考えています。
代表的な原著論文
- Shinno, N., Kimura, H., Sada, R., Takiguchi, S., Mori, M., Fumoto, K., and Doki, Y., and Kikuchi, A. (2018) Activation of the Dickkopf1-CKAP4 pathway is associated with poor prognosis of esophageal cancer and anti-CKAP4 antibody may be a new therapeutic drug. Oncogene, doi: 10.1038/s41388-018-0179-2
- Fumoto, K., Takigawa-Imamura, H., Sumiyama, K., Kaneiwa, T., and Kikuchi, A. (2017) Modulation of apical constriction by Wnt signaling is required for lung epithelial shape transition. Development 144, 151-162
- Kimura, H., Fumoto, K., Shojima, K., Nojima, S., Osugi, Y., Tomihara, H., Eguchi, H., Shintani, Y., Endo, E., Inoue, M., Doki, Y., Okumura, M., Morii, E., and Kikuchi, A. (2016) CKAP4 is involved in tumor progression as a Dickkopf1 receptor. J. Clin. Invest. 126, 2689-2705
- Matsumoto, S., Kurimoto, T., Taketo, M., Fujii, S., and Kikuchi, A. (2016) Wnt-Myb pathway suppresses KIT expression to control the timing of salivary proacinar differentiation and duct formation. Development 143, 2311-2324
- Fujii, S., Matsumoto, S., Nojima, S. Morii, E., and Kikuchi, A. (2015) Arl4c expression in colorectal and lung cancers promotes tumorigenesis and may represent a novel therapeutic target. Oncogene, 34, 4834-4844
総説
- Kikuchi, A., Fumoto, K., Kimura, H. (2017) The Dickkopf1-cytoskeleton-associated protein 4 axis creates a novel signalling pathway and may represent a molecular target for cancer therapy. Br. J. Pharmacol. 174, 4651-4665
- Matsumoto, S., Fujii, S., and Kikuchi, A. (2017) Arl4c is a key regulator of tubulogenesis and tumourigenesis as a target gene of Wnt-β-catenin and growth factor-Ras signaling. J. Biochem. 161, 27-35
- 山本英樹、菊池 章 (2016) WntシグナルにおけるFrizzled受容体の活性化機構:医学のあゆみ GPCR研究の最前線2016 256, 421-429
- 菊池 章 (2015) DNA複製(分担翻訳):生化学第4版 (BIOCHEMISTRY 4th Edition) 西村書店出版 928-965
- Kikuchi, A., Matsumoto, S., Fumoto, K., and Sato, A. (2014) Modulation of Wnt Signaling by Endocytosis of Receptor Complexes. Wnt signaling in Development and Disease Chapter 8, Edited by Stefan Hoffer and Randol Moon, John Wiley and Sons, Inc