カルシウム増感剤による拡張型心筋症の発症予防FINDING / PRESS
木村彰方教授らの研究で、心不全発症の遅延、生存期間の延長、心筋線維化抑制、およびリモデリング関連遺伝子発現是正が観察されました。
「カルシウム増感剤による拡張型心筋症の発症予防」
有村卓朗助教、木村彰方教授ほか(難治病態研究部門分子病態分野)
“Improvement of left ventricular dysfunction and of survival prognosis of dilated cardiomyopathy by administration of calcium sensitizer SCH00013 in a mouse model”
Arimura T, Sato R, Machida N, Bando H, Zhang DY, Morimoto S, Tanaka R, Yamane Y, Bonne G, Kimura A.
J Am Coll Cardiol. 2010; 55(14): 1503-1505.
拡張型心筋症は、明らかな誘因がなく心室拡大、心筋細胞脱落、心筋線維化を来たし、突然死や難治性心不全の原因となる難病(厚生労働省特定疾患)です。拡張型心筋症の20―35%は家族性に発症することから、それらの病因は遺伝子変異であると考えられます。このため世界的に原因遺伝子の探索がおこなわれ、これまでに心臓の筋肉を構成するタンパク、とくに細胞膜(例えば、ディストロフィンなど)、Z帯(例えば、テレトニンなど)、収縮タンパク(例えば、アクチンやトロポニンTなど)、I帯タンパク(例えば、FHL2やCARPなど)、さらには核膜タンパク(例えば、ラミンA/Cなど)の遺伝子異常が原因となることが判明しています。すなわち、拡張型心筋症の原因遺伝子はこれまでに約30種発見されていますが、そのいずれに異常が生じても拡張型心筋症の病態を呈します。これらの遺伝子異常が拡張型心筋症を引き起こすメカニズムについては不明な点が多いですが、一部の遺伝子異常は心筋収縮のカルシウム感受性を低下させることが報告されています。また、心不全状態でも心筋収縮のカルシウム感受性が低下しているとの報告がありますが、カルシウム感受性低下と心不全との直接の因果関係は明らかではありません。
一方、拡張型心筋症の治療法としてはβブロッカーやACE阻害剤などが用いられており、薬剤治療が効を奏しない場合には心臓移植がおこなわれます。また、心不全治療法としてフォスフォジエステラーゼ(PDE)阻害剤が使用されることがありますが、短期的には心筋収縮力を増強するものの、長期的な生存予後の改善は認められていません。さらに、最近ではカルシウム増感剤による心不全治療も試みられていますが、既存の薬剤にはPDE阻害作用があり、短期的には心不全症状を軽快させるものの長期的な改善効果は得られていないのが現状です。遺伝子変異による拡張型心筋症の多くは成人期以降に発症しますが、発症を予防する方法は確立していません。このため、ことに遺伝性拡張型心筋症では、発症予防法の開発が待たれています。
拡張型心筋症の病態研究や治療研究には動物モデルが用いられますが、ラミンA/C遺伝子を改変したマウス(ラミン変異ノックインマウス)は生後5―6カ月程度から心不全を発症し、心筋細胞の脱落や心筋の線維化を来たすとともに、12―13カ月までに死亡するため、重症拡張型心筋症の動物モデルとして研究に使われています。
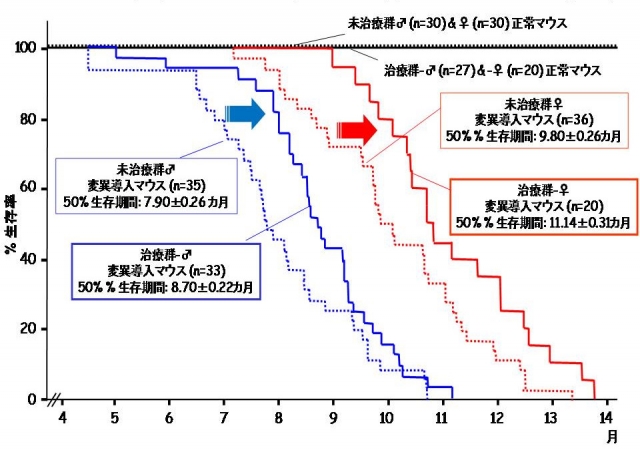
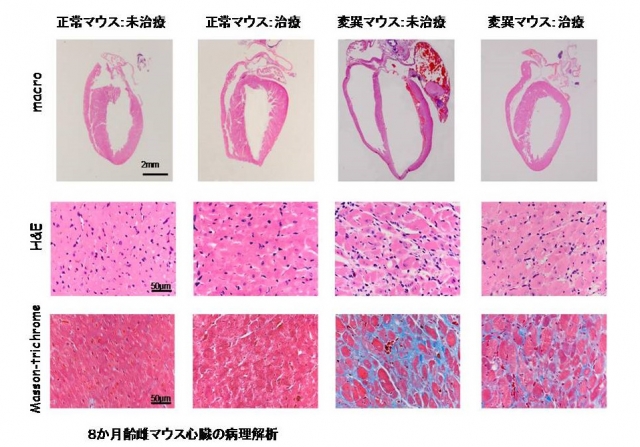
我々は、東京農工大学獣医学部、九州大学医学部、フランス筋疾患研究所などとの国際共同研究によって、拡張型心筋症モデル動物であるラミンA/C遺伝子改変マウスを用いて、PDE阻害作用のないカルシウム増感剤(SCH00013、全薬工業)による拡張型心筋症の発症予防効果を検討しました。その結果、発症前(2カ月齢)からカルシウム増感剤を投与することで、心不全の発症遅延と生存予後の改善が認められました(図1)。また、カルシウム増感剤を投与したラミンA/C改変マウスでは、心筋の病理変化(心筋細胞の脱落と線維化)の抑制(図2)ならびに心筋リモデリング関連遺伝子の発現異常が是正されました。一方、ラミンA/C改変マウスでは発症前にはカルシウム感受性が低下していませんでした。すなわち、カルシウム感受性が低下していない時期からカルシウム増感剤を投与することで、拡張型心筋症・心不全の発症を抑制できました。このことは、カルシウム増感作用に着目した心不全の発症予防法の開発が可能になることを示します。
Arimura T, Sato R, Machida N, Bando H, Zhang DY, Morimoto S, Tanaka R, Yamane Y, Bonne G, Kimura A.
J Am Coll Cardiol. 2010; 55(14): 1503-1505.
拡張型心筋症は、明らかな誘因がなく心室拡大、心筋細胞脱落、心筋線維化を来たし、突然死や難治性心不全の原因となる難病(厚生労働省特定疾患)です。拡張型心筋症の20―35%は家族性に発症することから、それらの病因は遺伝子変異であると考えられます。このため世界的に原因遺伝子の探索がおこなわれ、これまでに心臓の筋肉を構成するタンパク、とくに細胞膜(例えば、ディストロフィンなど)、Z帯(例えば、テレトニンなど)、収縮タンパク(例えば、アクチンやトロポニンTなど)、I帯タンパク(例えば、FHL2やCARPなど)、さらには核膜タンパク(例えば、ラミンA/Cなど)の遺伝子異常が原因となることが判明しています。すなわち、拡張型心筋症の原因遺伝子はこれまでに約30種発見されていますが、そのいずれに異常が生じても拡張型心筋症の病態を呈します。これらの遺伝子異常が拡張型心筋症を引き起こすメカニズムについては不明な点が多いですが、一部の遺伝子異常は心筋収縮のカルシウム感受性を低下させることが報告されています。また、心不全状態でも心筋収縮のカルシウム感受性が低下しているとの報告がありますが、カルシウム感受性低下と心不全との直接の因果関係は明らかではありません。
一方、拡張型心筋症の治療法としてはβブロッカーやACE阻害剤などが用いられており、薬剤治療が効を奏しない場合には心臓移植がおこなわれます。また、心不全治療法としてフォスフォジエステラーゼ(PDE)阻害剤が使用されることがありますが、短期的には心筋収縮力を増強するものの、長期的な生存予後の改善は認められていません。さらに、最近ではカルシウム増感剤による心不全治療も試みられていますが、既存の薬剤にはPDE阻害作用があり、短期的には心不全症状を軽快させるものの長期的な改善効果は得られていないのが現状です。遺伝子変異による拡張型心筋症の多くは成人期以降に発症しますが、発症を予防する方法は確立していません。このため、ことに遺伝性拡張型心筋症では、発症予防法の開発が待たれています。
拡張型心筋症の病態研究や治療研究には動物モデルが用いられますが、ラミンA/C遺伝子を改変したマウス(ラミン変異ノックインマウス)は生後5―6カ月程度から心不全を発症し、心筋細胞の脱落や心筋の線維化を来たすとともに、12―13カ月までに死亡するため、重症拡張型心筋症の動物モデルとして研究に使われています。
我々は、東京農工大学獣医学部、九州大学医学部、フランス筋疾患研究所などとの国際共同研究によって、拡張型心筋症モデル動物であるラミンA/C遺伝子改変マウスを用いて、PDE阻害作用のないカルシウム増感剤(SCH00013、全薬工業)による拡張型心筋症の発症予防効果を検討しました。その結果、発症前(2カ月齢)からカルシウム増感剤を投与することで、心不全の発症遅延と生存予後の改善が認められました(図1)。また、カルシウム増感剤を投与したラミンA/C改変マウスでは、心筋の病理変化(心筋細胞の脱落と線維化)の抑制(図2)ならびに心筋リモデリング関連遺伝子の発現異常が是正されました。一方、ラミンA/C改変マウスでは発症前にはカルシウム感受性が低下していませんでした。すなわち、カルシウム感受性が低下していない時期からカルシウム増感剤を投与することで、拡張型心筋症・心不全の発症を抑制できました。このことは、カルシウム増感作用に着目した心不全の発症予防法の開発が可能になることを示します。