難治性不整脈の新規原因遺伝子の発見:SLMAP遺伝子変異はブルガダ症候群の原因となるFINDING / PRESS
木村教授、有村准教授、石川大学院生らの国際共同研究(日韓米伊)の成果がCirculation Arrhythmia and Electrophysiology誌(オンライン版)に掲載されるとともに、Faculty of 1000(Cardiovascular Disorder)に選ばれました。
難治性不整脈の新規原因遺伝子の発見:SLMAP遺伝子変異はブルガダ症候群の原因となる
木村彰方教授、有村卓朗准教授、石川泰輔大学院生(難治疾患研究所分子病態分野) 蒔田直昌教授(長崎大学大学院医歯薬学総合研究科内臓機能生理学分野) Jeong-Euy Park教授(Samsung Medical Center、韓国) Michael J. Ackerman教授(Mayo Clinic、米国) Peter J. Schwarts教授、Lia Crotti博士(Pavia大学、イタリア)
Ishikawa T, Sato A, Marcou CA, Tester DJ, Ackerman MJ, Crotti L, Schwartz PJ, On YK, Park JE, Nakamura K, Hiraoka M, Nakazawa K, Sakurada H, Arimura T, Makita N, Kimura A. A novel disease gene for Brugada syndrome: sarcolemmal membrane-associated protein gene mutations impair intracellular trafficking of hNav1.5. Circ Arrhythm Electrophysiol. Online publication Oct. 12, 2012. (doi: 10.1161/CIRCEP.111.969972)
ブルガダ症候群(BrS)は、右側胸部誘導のST上昇等の特徴的な心電図所見を示し、しばしば心室性不整脈を来し突然死の原因となる難治性不整脈疾患です。欧米白人におけるBrSの頻度は10,000人あたり1名と比較的稀ですが、わが国を含むアジア民族ではその5~10倍の頻度であり、不整脈疾患のうちでは比較的よくみられるものです。これまでの遺伝学的な解析から、心筋Naチャネル(Nav1.5)を構成する要素(SCN5A, SCN1B, SCN3B等)や機能修飾要素(GPD1-L, MOG1等)、心筋Caチャネル(CACNA1C,CACNB2)、あるいはKチャネル(KCNJ8, KCND3, KCNE3, HCN4等)の遺伝子変異がBrSの原因となることが報告されています。最も頻度が高く遺伝子変異が認められるのはSCN5A遺伝子ですが、病因変異の機能解析から、Nav1.5チャネル機能の低下が本症の病態と密接に関わると考えられます。しかしながら、既知の原因遺伝子に変異が見出されるのはBrS患者の約30%に過ぎませんので、これら以外の原因遺伝子が存在すると考えられていました。
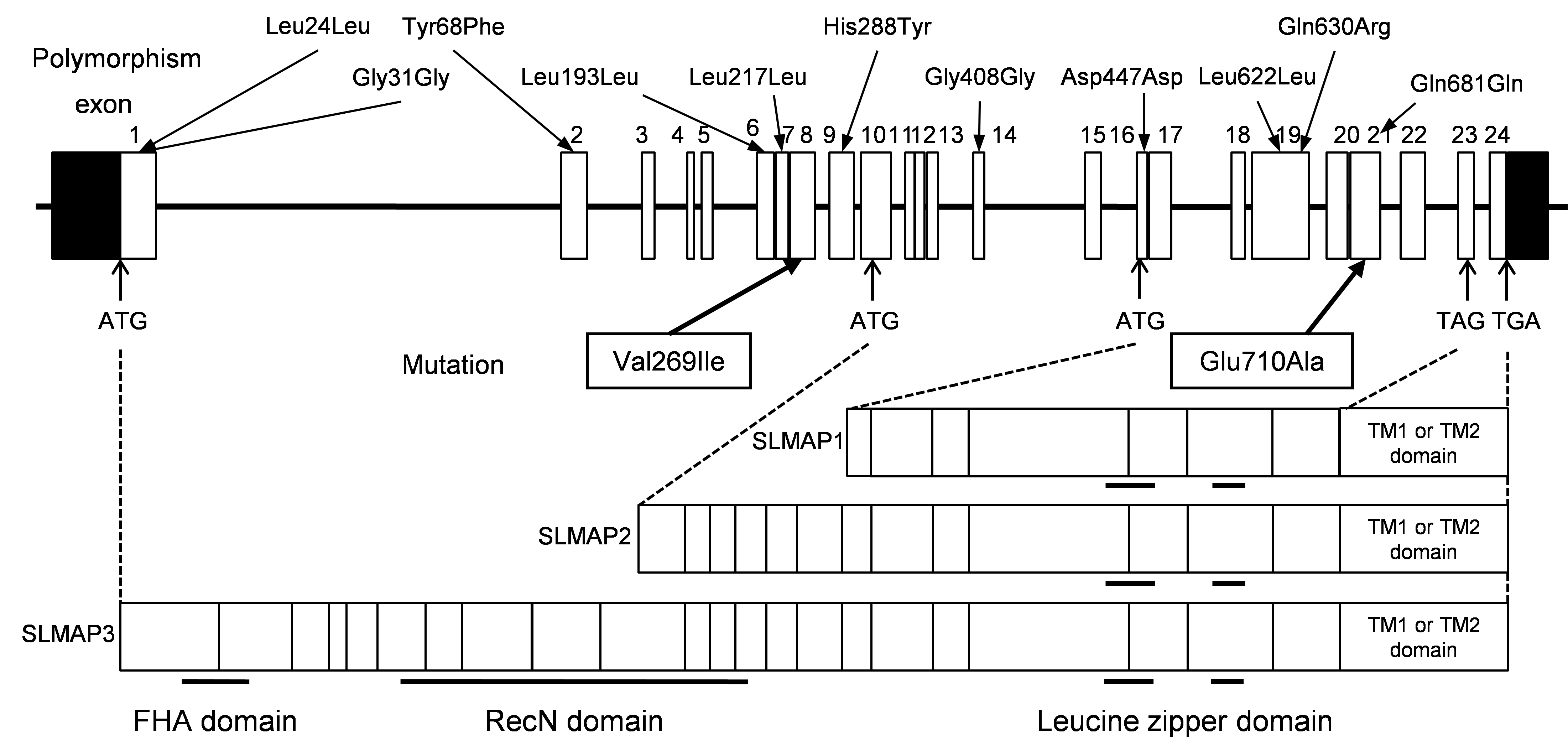
原因不明のBrS患者の原因遺伝子変異を解明することは、BrS病態形成機序の更なる理解を深めます。不整脈は心筋細胞の電気的興奮の異常ですが、この電気的興奮は心筋細胞膜(サルコレンマ)の機能に依存しています。そこで、サルコレンマやT管に存在する機能不明のタンパク(sarcolemmal membrane-associated protein、SLMAP)に着目しました。SLMAP遺伝子は24個のエクソンで構成され、種々のアイソフォームをコードしています(図1)。既知の原因遺伝子に変異がないBrS患者190名(日本人85名、韓国人3名、欧米白人102名)について、SLMAP遺伝子変異を検索したところ、種々の遺伝子多型とは別に、2名(いずれも日本人)の患者(日本人患者の2.4%)に健常人にはない遺伝子変異(V269IとE710A)が見出されました(図1)。
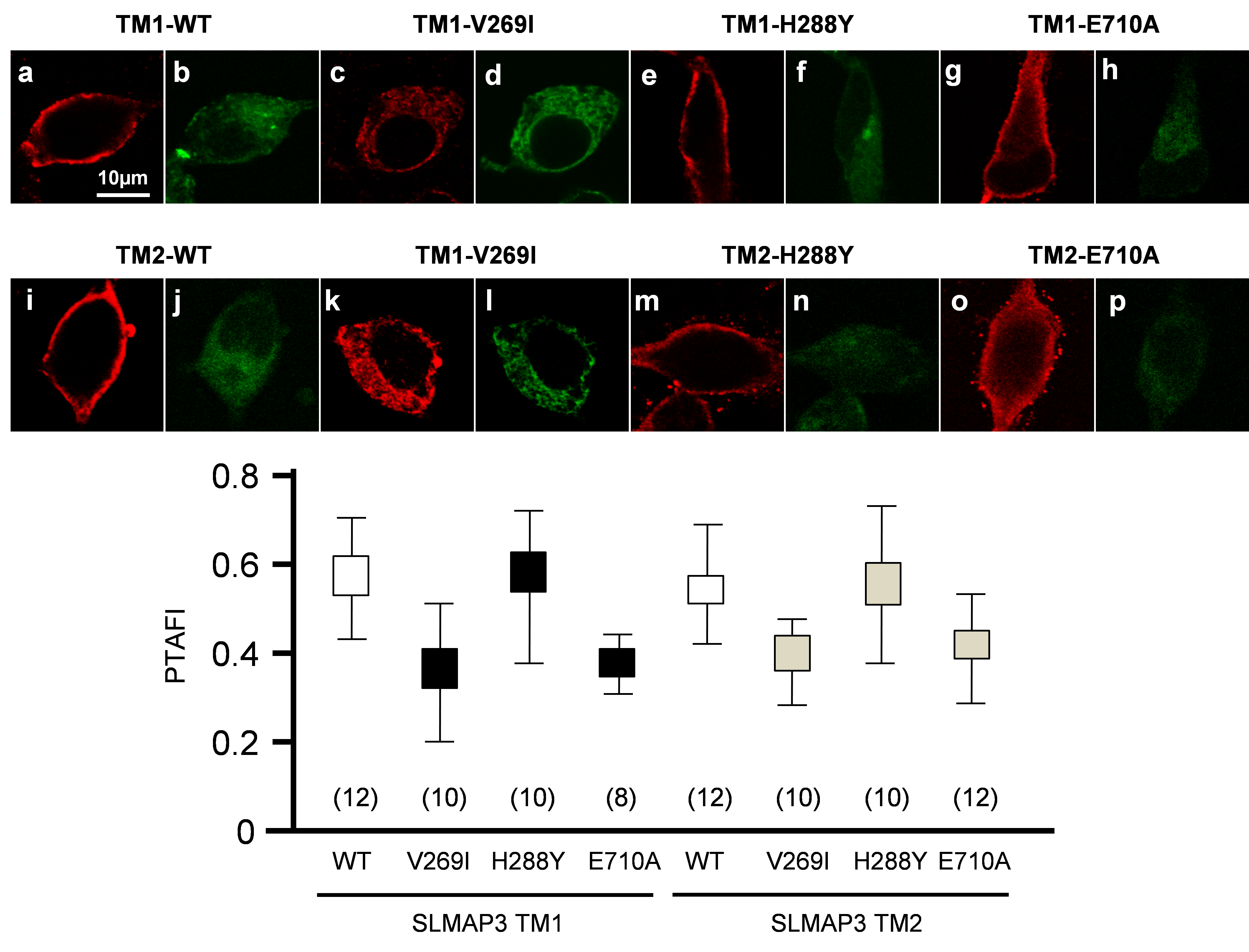
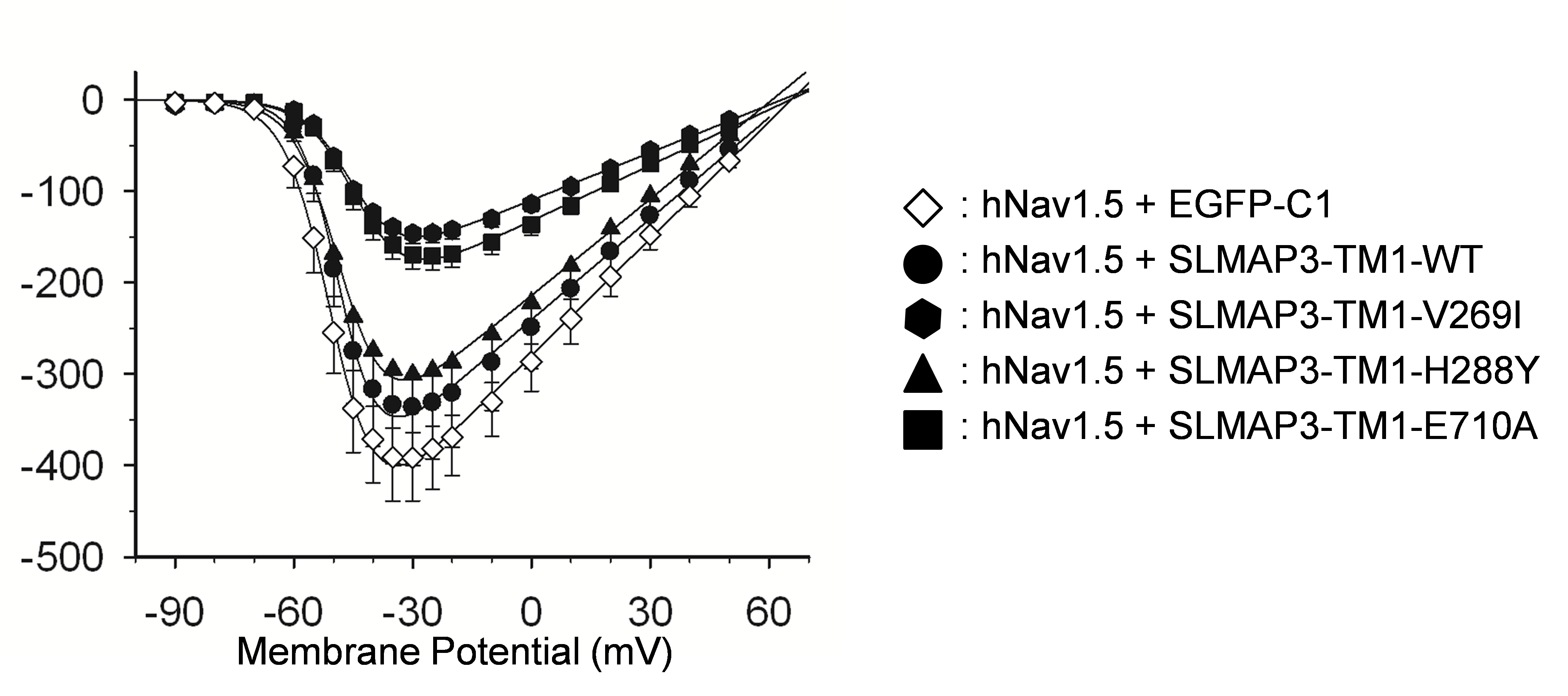
これら2種の変異と健常人にも認められた稀な多型(H288Y)がどのような機能異常を生じるかをHEK293細胞へのトランスフェクション実験で調べたところ、V269IとE710A はいずれもNav1.5チャネルの細胞内輸送を障害して細胞表面への発現量を著しく低下させました(図2)。また、Nav1.5チャネルの細胞表面発現が低下することに一致して、Nav1.5チャネル機能も低下していることが判明しましたが、正常人にも認められる稀な多型ではこのような異常は観察されませんでした。(図3)。さらに、これらの機能異常は正常SLMAP存在下でも認められること、変異SLMAPの発現をsiRNAで抑制するとNav1.5機能障害が解除されることから、変異SLMAPはdominant-negativeにNav1.5チャネルの機能障害をもたらすことでBrSの病態形成に寄与すると考えられました。これらの知見は、SLMAP変異が新規のBrS原因遺伝子であることを示すとともに、従来機能が不明であったSLMAPがNav1.5の細胞内輸送に関わることを示します。
本研究成果において重要なことは、SLMAP変異に起因するBrSではNav1.5自体の構造異常がないことから、例えばsiRNAを用いる等の方法で変異SLMAPを抑制することでNav1.5の細胞内輸送障害を解除すれば、BrSの治療が可能になることを示したことにあります。
ブルガダ症候群(BrS)は、右側胸部誘導のST上昇等の特徴的な心電図所見を示し、しばしば心室性不整脈を来し突然死の原因となる難治性不整脈疾患です。欧米白人におけるBrSの頻度は10,000人あたり1名と比較的稀ですが、わが国を含むアジア民族ではその5~10倍の頻度であり、不整脈疾患のうちでは比較的よくみられるものです。これまでの遺伝学的な解析から、心筋Naチャネル(Nav1.5)を構成する要素(SCN5A, SCN1B, SCN3B等)や機能修飾要素(GPD1-L, MOG1等)、心筋Caチャネル(CACNA1C,CACNB2)、あるいはKチャネル(KCNJ8, KCND3, KCNE3, HCN4等)の遺伝子変異がBrSの原因となることが報告されています。最も頻度が高く遺伝子変異が認められるのはSCN5A遺伝子ですが、病因変異の機能解析から、Nav1.5チャネル機能の低下が本症の病態と密接に関わると考えられます。しかしながら、既知の原因遺伝子に変異が見出されるのはBrS患者の約30%に過ぎませんので、これら以外の原因遺伝子が存在すると考えられていました。
原因不明のBrS患者の原因遺伝子変異を解明することは、BrS病態形成機序の更なる理解を深めます。不整脈は心筋細胞の電気的興奮の異常ですが、この電気的興奮は心筋細胞膜(サルコレンマ)の機能に依存しています。そこで、サルコレンマやT管に存在する機能不明のタンパク(sarcolemmal membrane-associated protein、SLMAP)に着目しました。SLMAP遺伝子は24個のエクソンで構成され、種々のアイソフォームをコードしています(図1)。既知の原因遺伝子に変異がないBrS患者190名(日本人85名、韓国人3名、欧米白人102名)について、SLMAP遺伝子変異を検索したところ、種々の遺伝子多型とは別に、2名(いずれも日本人)の患者(日本人患者の2.4%)に健常人にはない遺伝子変異(V269IとE710A)が見出されました(図1)。
これら2種の変異と健常人にも認められた稀な多型(H288Y)がどのような機能異常を生じるかをHEK293細胞へのトランスフェクション実験で調べたところ、V269IとE710A はいずれもNav1.5チャネルの細胞内輸送を障害して細胞表面への発現量を著しく低下させました(図2)。また、Nav1.5チャネルの細胞表面発現が低下することに一致して、Nav1.5チャネル機能も低下していることが判明しましたが、正常人にも認められる稀な多型ではこのような異常は観察されませんでした。(図3)。さらに、これらの機能異常は正常SLMAP存在下でも認められること、変異SLMAPの発現をsiRNAで抑制するとNav1.5機能障害が解除されることから、変異SLMAPはdominant-negativeにNav1.5チャネルの機能障害をもたらすことでBrSの病態形成に寄与すると考えられました。これらの知見は、SLMAP変異が新規のBrS原因遺伝子であることを示すとともに、従来機能が不明であったSLMAPがNav1.5の細胞内輸送に関わることを示します。
本研究成果において重要なことは、SLMAP変異に起因するBrSではNav1.5自体の構造異常がないことから、例えばsiRNAを用いる等の方法で変異SLMAPを抑制することでNav1.5の細胞内輸送障害を解除すれば、BrSの治療が可能になることを示したことにあります。