脊髄小脳失調症1型の原因がDNA損傷修復異常であることを解明FINDING / PRESS
岡澤教授らが東邦大学・曽根准教授らと実施した難治疾患共同研究拠点における共同研究の成果が英国科学誌「Human Molecular Genetics」にオンライン速報版で発表されました。
概要
東京医科歯科大学の岡澤 均 教授らは、神経変性疾患の脊髄小脳失調症1型(SCA1)の病態に重要な役割を果たす遺伝子を特定しました。 近年、神経変性疾患に共通の病態として、DNA損傷およびその修復のメカニズムに注目が集まっています。しかし、疾患ごとにたくさんあるDNA損傷修復の機能のうち、どれが重要で、また病態への影響の大きい遺伝子が何であるかについては分かっていませんでした。そこで、より詳細な分子メカニズムの解明とこれを応用した分子標的治療法の開発が望まれていました。 本研究グループは、遺伝学的解析に優れたショウジョウバエを変性疾患モデル動物として用い、病態に関与するDNA修復関連遺伝子を探しました。さらに、膨大な遺伝子データの中から相互に重要な関連性を拾い出すバイオインフォマティクスの解析を加えることで、「RpA1」、「Chk1」という主要な病態制御遺伝子を発見しました。また、これらの発現を調節することによって、ショウジョウバエモデルの寿命を顕著に延長させることにも成功しました。 今後は、これらの遺伝子を標的とする患者への遺伝子治療・薬物療法の開発が期待されます。
研究の背景
脊髄小脳失調症1型(SCA1)は優性遺伝性形式を取る遺伝病で、欧米では100,000人あたり2人の確率で起こる代表的な神経変性疾患です。運動失調や記憶・認知障害を伴い、発症から10~20年で死亡します。しかし、原因タンパクである変異型Ataxin1がどのような分子メカニズムで病態を引き起こすのか未解明な部分が多く残り、患者さんの症状改善あるいは寿命延長の出来るような有効な治療法は未だ確立されていません。 一方、岡澤均教授らのグループは神経変性疾患におけるDNA損傷修復機構に注目しており、これまでにハンチントン病やSCA1においてDNA損傷修復機構が不活性化していること、また結果としてDNA損傷が増加して症状を起こしてことを明らかにして来ました(Qi et al, Nat Cell Biol 2007; Enokido et al, JCB 2010; Fujita et al., Nature Commun 2013)。さらに、近年ではアルツハイマー病においても、脳活動依存性のDNA損傷増加が報告されており(Suberbielle et al, Nat Neurosci 2013)、DNA損傷とその修復は変性疾患の共通病態として注目を浴びています。しかし、SCA1において多種類のDNA 損傷修復機能のどれが重要か、また数あるDNA修復因子の中で病態への影響の大きい遺伝子は何か、など詳細な分子メカニズムは未解明でした。
研究の内容
今回の研究では、遺伝学に優れたショウジョウバエをモデル動物とし、バイオインフォマティクスのテクニックの一つであるネットワーク解析を応用することでSCA1のDNA損傷に重要な役割を持つ分子RpA1とChk1を世界で初めて発見しました。 ショウジョウバエは体が極めて小さく寿命も哺乳類、げっ歯類に比較して短いことなどから(平均5週間程度)、多数の遺伝子の効果を一度にスクリーニングすることに適しています。今回、岡澤均教授らの用いたSCA1モデルショウジョウバエは症状として、より一層の寿命短縮を示します(平均3週間)。この疾患モデルショウジョウバエにDNA修復関連遺伝子を発現するショウジョウバエライブラリーを掛け合わせることで、多数のDNA修復遺伝子の病態修飾効果をスクリーニングしました。この結果、複数の分子(8個)が寿命を回復することを認めました(図1)。一方、寿命をさらに短縮する遺伝子も複数見つかりました(図2)。次に、タンパク質間相互作用データベースやシステムズバイオロジー を利用して、寿命延長遺伝子・短縮遺伝子がそれぞれどのような病態ネットワークを形成しているかについて推定したところ、前者では複数のDNA損傷修復機構が機能していること、また後者ではDNA損傷シグナルの活性化が示されました。そして、それぞれのネットワークにおいてRpA1とChk1が中心的な役割を果たしていることが推定されました(図3、4)。 患者さんにとって、神経変性疾患の最大の問題点は寿命短縮ですが、その背景には神経細胞の機能障害と細胞死があります。神経細胞のDNA損傷修復が低下してDNA損傷が蓄積すると、神経細胞の機能は低下し、やがて細胞死が起こります。神経細胞のDNA損傷修復メカニズムは他の細胞とは異なる点があります。すなわち、神経 細胞は一般的には発生段階後に分裂をしないためと考えられています。したがって、DNA損傷修復機構も限定的であり、特にDNA二重鎖切断修復においてはnon-homologous end joiningという機構が使われると考えられています。ところが、今回のRpAは一本鎖DNAを保護するなどして、DNA複製を介したDNA二重鎖切断修復に関わる分子でした。DNA複製修復に関与する他の分子も同様に寿命延長効果を示したことから、通常は有り得ないDNA複製によるDNA損傷修復が起きていると推測されました。また、同時に行ったSCA1モデルマウスの神経細胞の免疫染色も、神経変性を最も強く示す小脳神経細胞においても、それらが異常な細胞周期状態にあることを示しており、RpA1補充によってDNA複製によるDNA損傷修復を促進することが神経細胞の機能回復に働きうる状況にあることを示していました支持する結果でした。 すなわち、モデルマウスにおいても、障害された神経細胞を回復させるためにDNA複製を用いることが同様に有効であることが予想されます。また、Chk1はこれらのDNA損傷修復不全によって引き起こされる細胞障害性シグナルを仲介していると考えられました。 さらに、RpA1の過剰発現は疾患モデルショウジョウバエにおいて神経細胞のDNA損傷も抑制していました(図5)。また、RpA1過剰発現あるいはChk1阻害剤はSCA1モデルショウジョウバエの寿命を顕著に延長しました(図6)。これらの結果は、今回用いた手法が病態遺伝子ネットワークの推定に適していることを示しています。これまでに、in vivoスクリーニングとバイオインフォマティクスの融合により神経変性疾患の分子メカニズムを解明した研究はなく、今後同様の手法を用いることで多くの変性疾患の病態解明の促進が期待出来ます。また、RpA1とChk1を用いてDNA損傷改善や寿命延長をショウジョウバエモデルで観察したことは、治療標的としてこれらの分子が期待出来るものであることを意味しています。 RpA1とSCA1疾患タンパク質(Ataxin-1)の関係についても検討を行いました。まず、免疫沈降法によりRpA1とAtaxin-1が直接的に結合することを示しました(図7)。次に、RpA1は疾患モデルマウスにおいて、神経細胞内の異常Ataxin-1の封入体に取り込まれていました(図8)。その結果、変異Ataxin-1はRpA1と直接的に結合して、凝集過程で封入体などに取り込み、RpA1の機能低下を起こすことが示されました。 RpA1はDNA損傷部位に集積してDNAを修復しますが、培養細胞を用いた実験からは、変異Ataxin-1がその動きを妨げていることも示されました(図9)。つまり、変異Ataxin-1はRpA1と直接的に結合して、凝集過程で封入体に取り込む、あるいは結合自体で分子動態を妨げることで、RpA1の機能低下を起こすことが示されました。
今後の展望
今回の研究では、SCA1病態におけるDNA損傷の原因としてRpA1の機能が阻害されることによることを明らかにし、また、Chk1阻害剤により治療効果があることを示しました。これらの成果は、遺伝子導入や薬剤投与によるヒト疾患患者を対象とした分子標的治療の開発につながるものと考えられます。 また、病態遺伝子ネットワークの推定に今回用いた新手法が適していることを示せた点も今回の成果の1つと言えます。これまでに、in vivoスクリーニングとバイオインフォマティクスの融合により神経変性疾患の分子メカニズムを解明した研究はなく、今後同様の手法を用いることで多くの変性疾患の病態解明を促進することも期待されます。
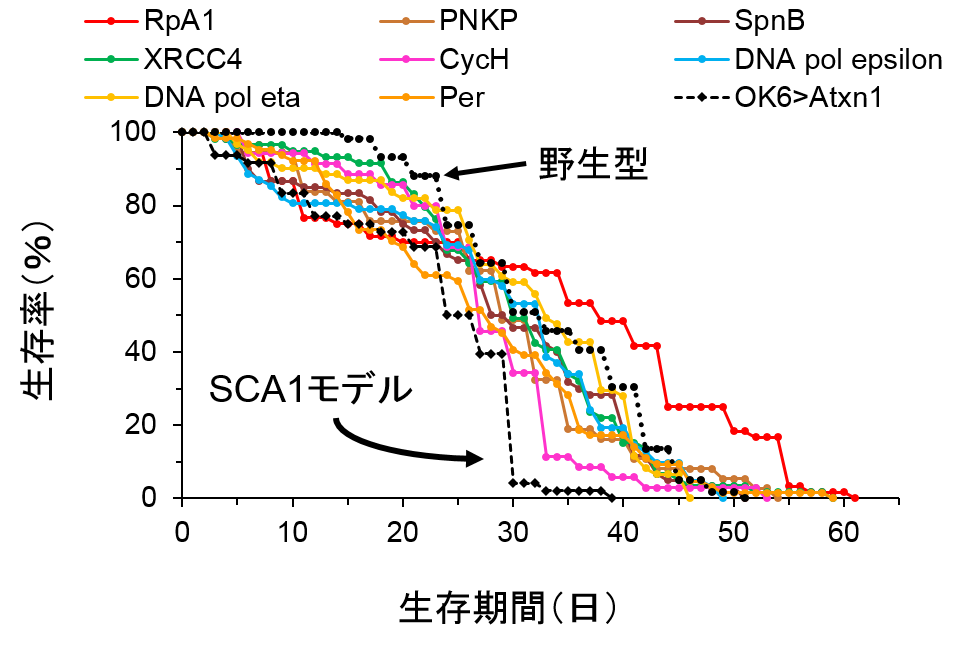
SCA1モデル(黒点線、平均寿命約21日)の寿命は野生型(図中にはない、平均寿命約35日)に比べて顕著に短い。RpA1(赤)を含む8種のDNA損傷修復遺伝子がこの寿命短縮を回復した。
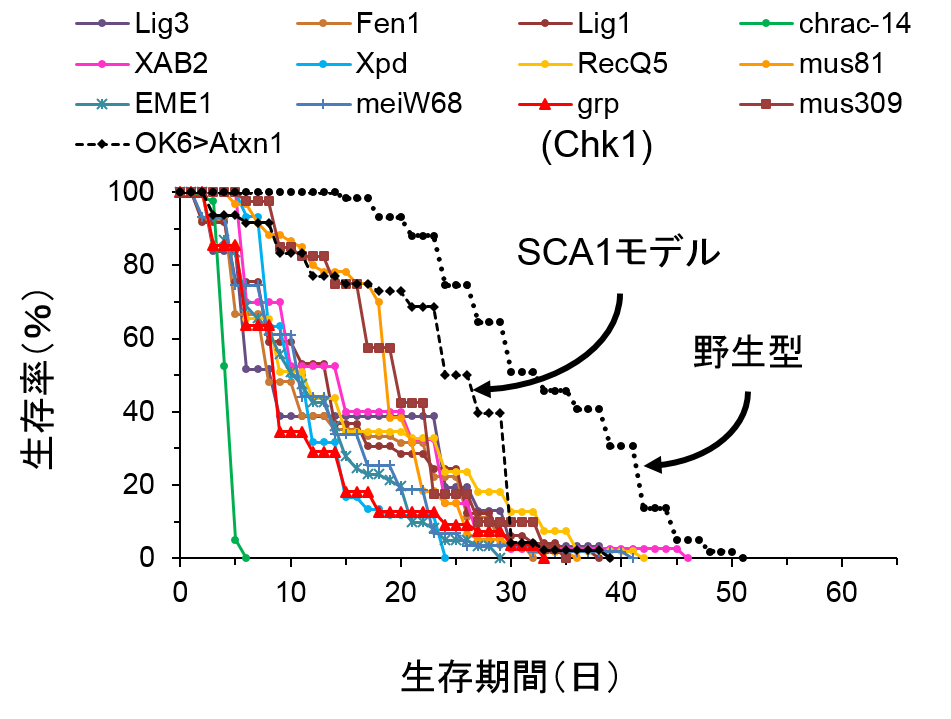
SCA1モデル(黒点線)の寿命は野生型(図中にはない)に比べて顕著に短い。
Chk1(grp赤)を含む12種のDNA損傷修復遺伝子がこの寿命短縮をさらに短縮させた。
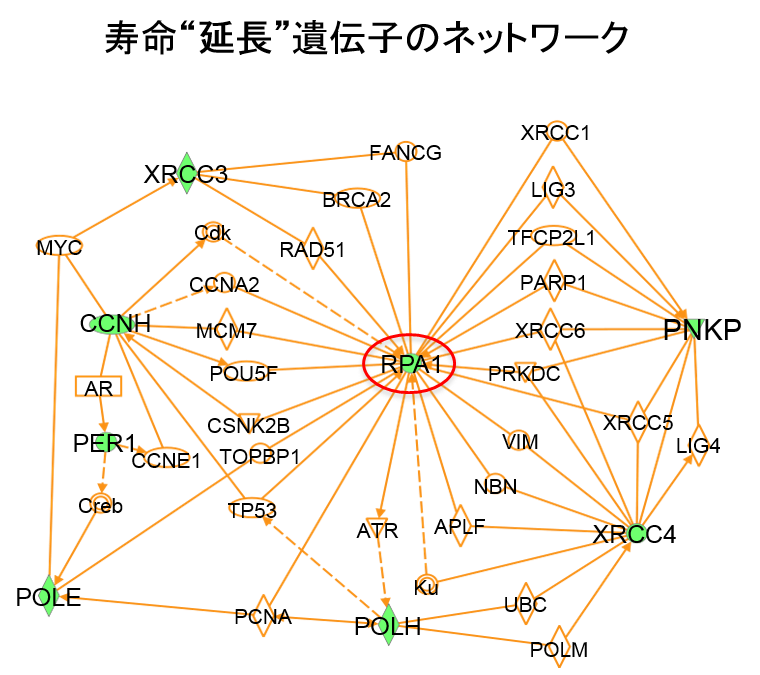
緑色の印をつけた遺伝子が図1で寿命を延長した遺伝子である。実線は直接的な結合の、点線は間接的な相互作用のあることを示す。ネットワーク解析によりこれらの遺伝子同士の新たな結びつきが明らかとなった。特にRpA1(赤丸)はこのネットワークの中心に存在し、重要な役割を持つことが推定される。
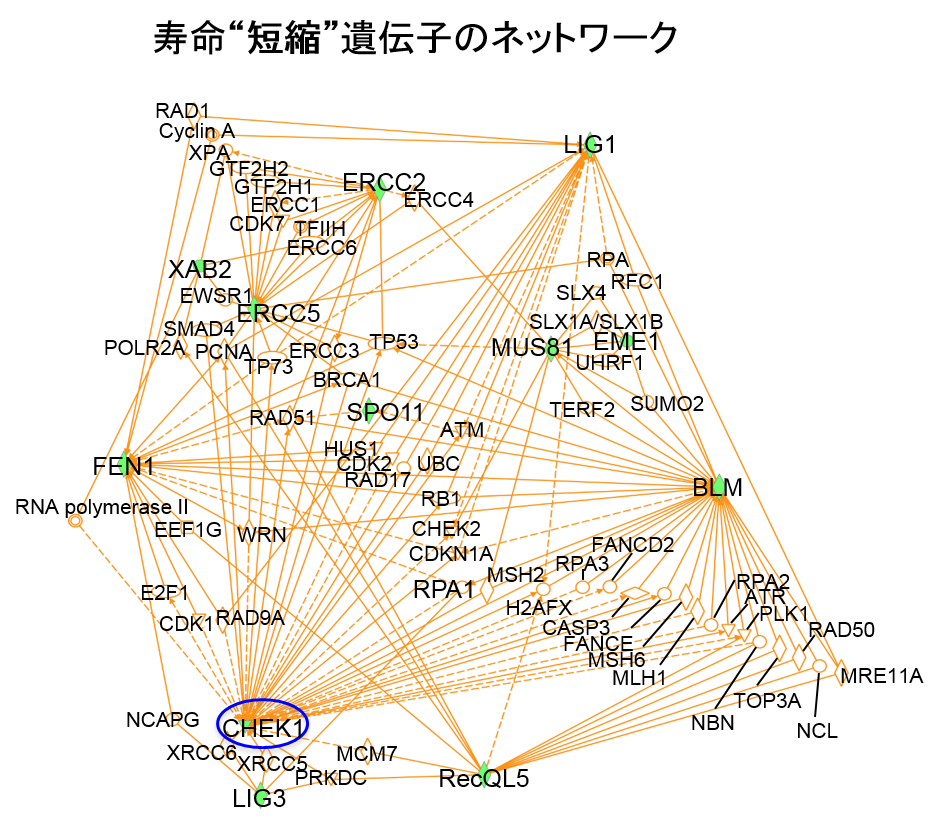
緑色の印をつけた遺伝子が図2で寿命を短縮した遺伝子である。実線は直接的な結合の、点線は間接的な相互作用のあることを示す。ネットワーク解析によりこれらの遺伝子同士の新たな結びつきが明らかとなった。特にChk1(青丸)はこのネットワークの中心に存在し、重要な役割を持つことが推定される。
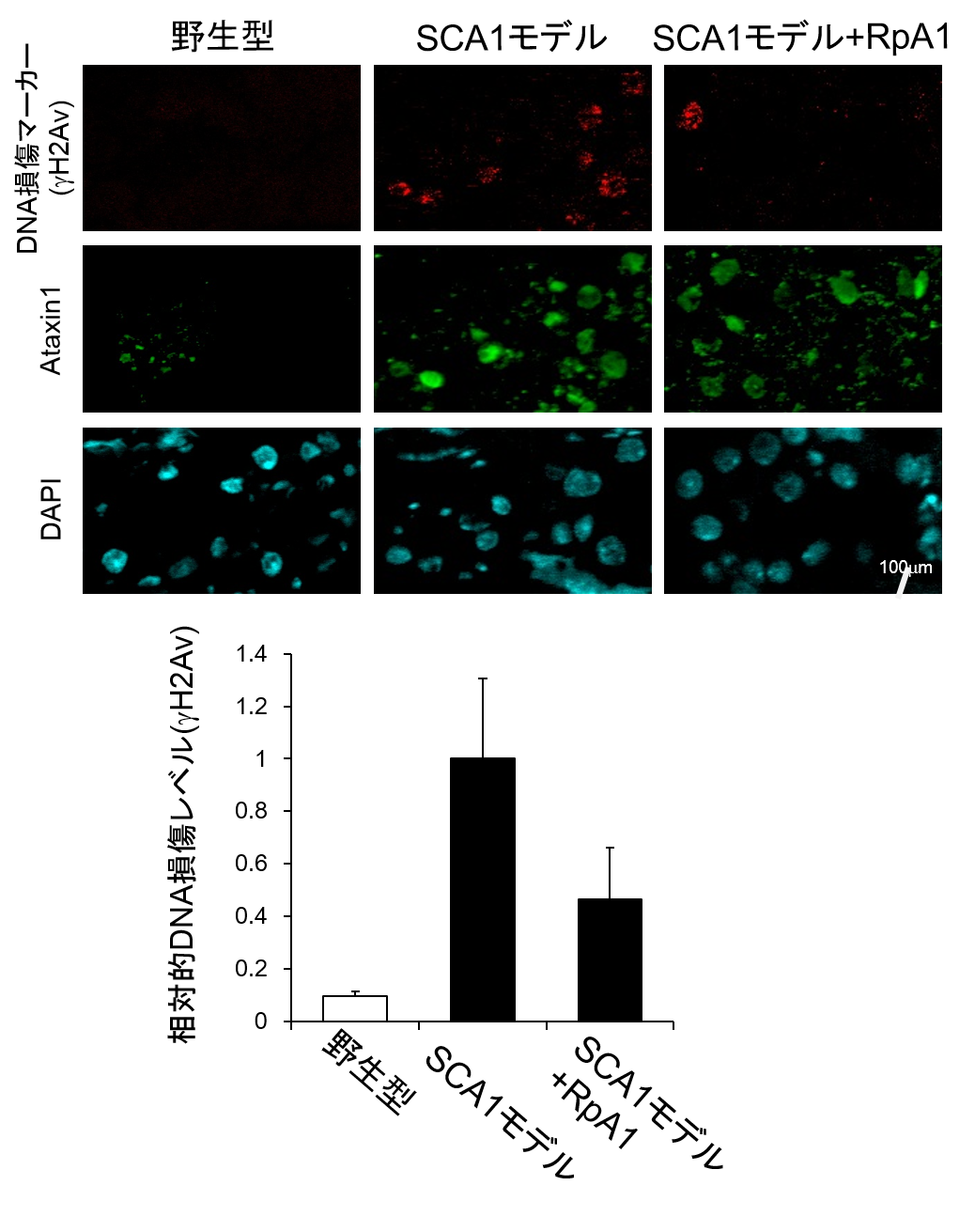
野生型(左)に比べ、SCA1モデル(中)ではDNA損傷(図上段)が亢進している。ここにRpA1を過剰発現させるとDNA損傷レベルは低下し、野生型に近づいた(右)。
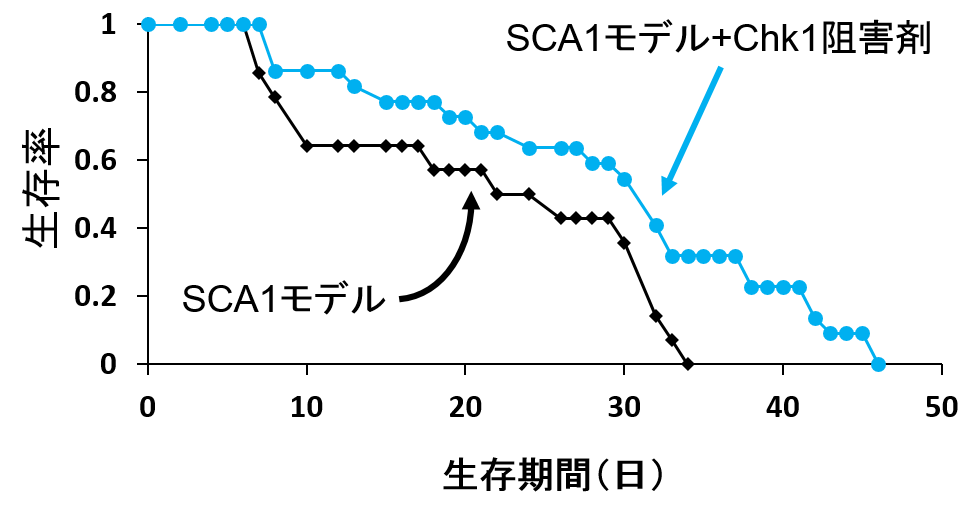
SCA1モデル(黒菱)に対し、Chk1阻害剤を投与すると(青丸)寿命の延長効果があった。

変異型Ataxin1を発現するSCA1モデルマウスでは、Ataxin1抗体での免疫沈降でRpA1の共沈が見られた(右端)。また、野生型においても弱い共沈は見られている(右から2番目)。
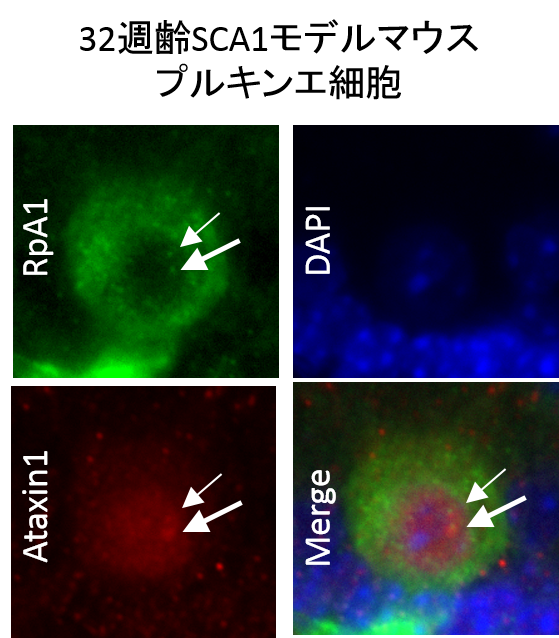
32週齢のSCA1モデルマウス小脳のプルキンエ細胞では核内におけるAtaxin1の封入体にRpA1も共局在していた(矢印)。
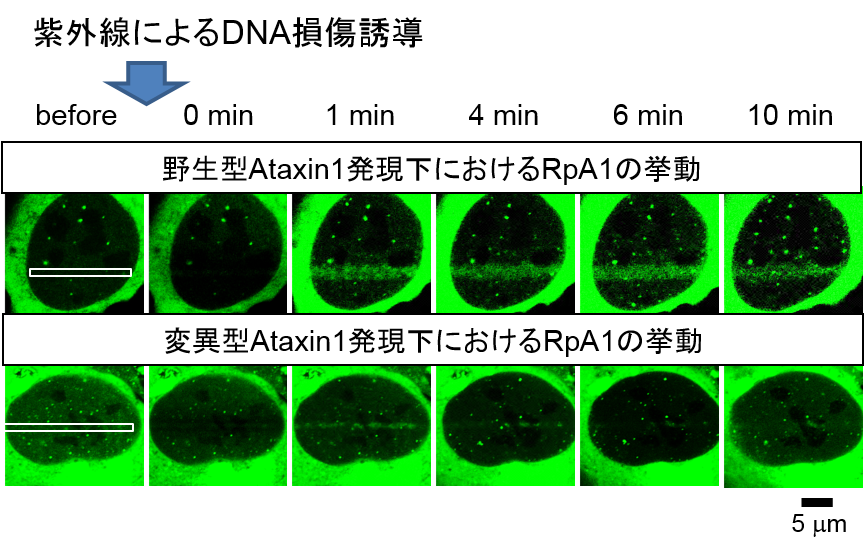
野生型Ataxin1を発現する培養細胞(上段)においては、DNA損傷後に損傷部位(白枠)にRpA1が速やかに集積する。変異型Ataxin1を発現する培養細胞(下段)ではDNA損傷後のRpA1の損傷部位(白枠)への集積が著しく低下している。
