カルモジュリン遺伝子の新生変異は先天性不整脈を引き起こすFINDING / PRESS
先天性不整脈の分子病因解明に関する国際(日米伊独仏)的な多施設共同研究(研究代表者:長崎大学 蒔田教授)の成果が、米国循環器学会誌(Circulation Cardiovascular Genetics)にオンライン速報版で発表(2014.6.10)されました。この多施設国際共同研究には、木村教授が参加しています。
先天性不整脈の新たな原因を究明【共同研究拠点:木村教授】
蒔田直昌 教授(長崎大学医学部)、八木原伸江 大学院生(新潟大学医学部)、Lia Crotti博士(Pavia大学、伊)、Christopher N. Johnson博士(Vanderbilt大学、米)、木村彰方 教授(東京医科歯科大学難治疾患研究所)、田中敏博 教授(東京医科歯科大学疾患バイオリソースセンター)、Peter Schwartz博士(IRCCS研究所、伊)、Thomas Meitinger教授(München工科大学、独)、Stefan Kääb博士(Ludwig-Maximilians大学、独)、Pascale Guicheney博士(Paris第6大学、仏)、清水渉 教授(日本医科大学)、Walter J. Chazin教授(Vanderbilt大学、米)、Alfred L. George教授(Vanderbilt大学、米)他
*Makita N, Yagihara N, Crotti L, Johnson CN, Beckmann BM, Roh MS, Shigemizu D, Lichtner P, Ishikawa T, Aiba T, Homfray T, Behr ER, Klug D, Denjoy I, Mastantuono E, Theisen D, Tsunoda T, Satake W, Toda T, Nakagawa H, Tsuji Y, Tsuchiya T, Yamamoto H, Miyamoto Y, Endo N, Kimura A, Ozaki K, Motomura H, Suda K, Tanaka T, Schwartz PJ, Meitinger T, Kääb S, Guichney P, Bhuiyan ZA, Shimizu W, Watanabe H, Chazin WJ, *George AL. Novel calmodulin (CALM2) mutations associated with congenital arrhythmia susceptibility. Circulation Cardiovascular Genetics (*corresponding author)[Epub ahead of print, June 10, 2014]( doi:10.1161/CIRCGENETICS.113.000459)
成果のポイント
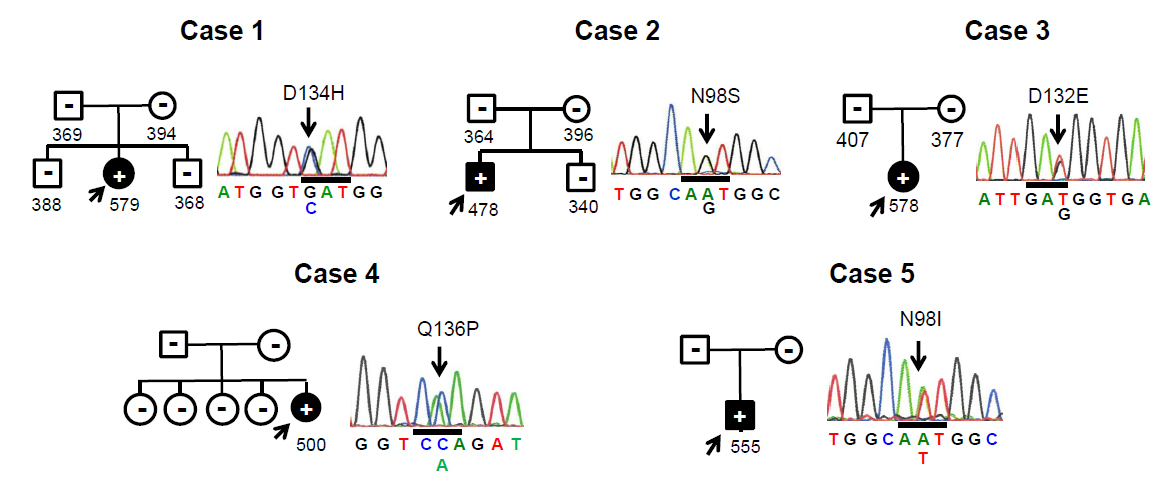
- 原因不明の先天性不整脈(QT延長症候群)患者5名にカルモジュリン遺伝子(CALM2)の変異を見出しました。
- これら5名の先天性不整脈患者は、いずれも家族歴がない孤発例でした。
- 患者に見出されたCALM2変異は、両親のどちらにも存在せず、患者に初めて生じた新生(de novo)変異でした。
- CALM2変異を有する患者5名のうち2名は、QT延長症候群にカテコラミン感受性多形心室頻拍を合併する臨床的な特徴を示しました。
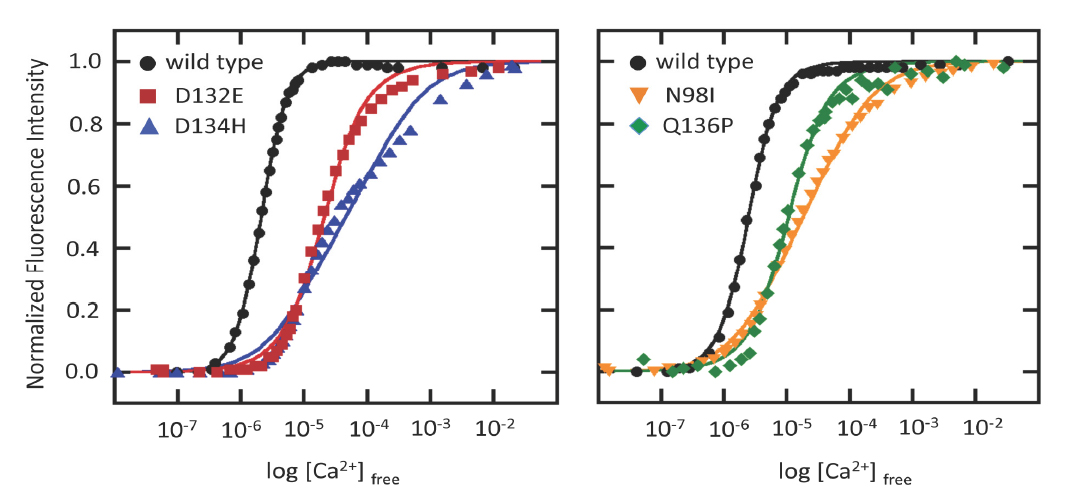
- 5種類の変異は、いずれもカルモジュリンのカルシウム結合性を低下しました。
研究の背景
先天性QT延長症候群(先天性LQT)は、特徴的な心電図波形を示し、乳幼児や若年者の突然死をもたらす疾患です。近年の分子遺伝学的研究により、先天性LQTには3つのサブタイプがあり、それぞれは心筋イオンチャネルであるKCNQ1, KCNH2, SCN5Aの遺伝子変異によることが分かっています。また、これらの遺伝子変異によるLQTでは臨床予後や薬物療法の効果などがそれぞれ異なっており、個々の患者での遺伝子変異の特定は臨床的に有用な情報をもたらすため、遺伝子診断が行われています。さらに、KCNQ1, KCNH2, SCN5Aの他にもSCN1B、SCN2Bなどの変異もLQTの原因となることが報告されています。一方、LQTとは心電図所見や臨床的な特徴が異なりますが、やはり突然死をもたらすカテコラミン感受性多形心室頻拍(CPVT)や特発性心室細動(IVF)という不整脈疾患があり、これらも遺伝子変異が原因となることが知られています。しかしながら、LQT患者のうち遺伝子変異が見出されるのは約半数程度に過ぎず、まだ知られていない原因遺伝子が存在すると考えられています。ごく最近、CPVTや重症LQT患者の一部にカルモジュリンの遺伝子変異が報告されました。カルモジュリンの遺伝子は3種(CALM1, CALM2, CALM3)あり、いずれもまったく同じアミノ酸配列のカルモジュリンをコードしていますが、CPVTではCALM1変異が2種、重症LQTではCALM1、CALM2変異がそれぞれ1種のみ報告されているのみで、先天性LQTにおける大規模な変異検索は行われていませんでした。
本研究の成果
本研究は、国際多施設共同研究によって、LQTにおけるカルモジュリン変異を探索し、変異による機能異常と臨床的な特徴を解明する目的で実施されたものです。まず、これまでに知られている原因遺伝子(KCNQ1, KCNH2, SCN5A, SCN1B, SCN2B, SCN3B, SCN4B, KCNE1, KCNE2, KCNJ2, CAV3)のいずれにも変異が見つからなかった“原因不明”の日本人LQT患者12名を対象として240個の不整脈関連遺伝子のターゲットエクソン解析を行い、さらに日本人LQT患者190名を対象として全エクソーム解析を行ったところ、それぞれ1名の患者にCALM2遺伝子のミスセンス変異(D134H, N98S)が見つかりました。ついで、欧米人LQT患者を対象とした解析によって3種類のCALM2ミスセンス変異(D132E, Q136P, N98I)が見つかりました。また、変異がみつかった患者の家族を調べたところ、いずれの患者とも両親には変異がないため、これの変異は患者で初めて生じた新生変異(de novo変異)でした(図1)。CALM2変異が見出された5名の患者はいずれも一般的なLQT(重症LQTではない)ですが、うち2名の患者(D132E, Q136P変異)はCPVTを合併していました。カルモジュリンは細胞内のカルシウムイオン(Ca2+)センサーであり、Ca2+を結合して、多くのタンパク質の機能制御を行いますが、今回の研究でみつかったCALM2変異(図2中で赤で示した変異)は、以前にCPVTや重症LQTで報告されているCALM1もしくはCALM2変異(図2中で緑で示した変異)と同様に、カルモジュリンのCa2+結合に直接関与しているアミノ酸の置換をもたらすものでした。そこで、これらの変異(CALM2-N98I, D132E, D134H, Q136P変異)がカルモジュリンのCa2+結合親和性にいかなる影響を与えるかを検討したところ、いずれも結合親和性を低下させることが判明しました(図3)。なお、N98S変異については、以前にCPVT患者にみいだされたCALM1変異(CALM1-N98S)で結合親和性の低下が報告されていること、CALM1とCALM2はアミノ酸配列が同一であることから、CALM2-N98S変異も結合親和性を低下させると考えられました。大変興味深いことCPVTを合併する患者に見出された変異(D132E, Q136P)は、その他の変異(N98I, D134H)に比べ、結合親和性の低下効果が小さいものでした(図3)。カルモジュリン変異が不整脈(LQT, CPVT)を引き起こすメカニズムについては不明な点が残されていますが、カルモジュリンが制御するL型カルシウムチャネルの不活化やリアノジンレセプターからのカルシウム放出の異常を介して、心電図異常および不整脈を来すことが推定されます。
謝辞
本研究の一部は、難治疾患共同研究拠点共同研究経費(共同研究者:長崎大学医学部・教授 蒔田直昌、平成25年度~)の助成を受けて実施しました。