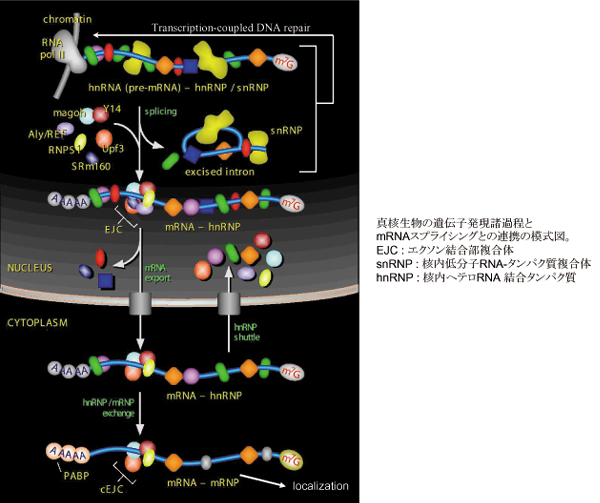
高等真核生物では、核にコードされる遺伝子の多くはイントロンによって分断化されている。さらにヒトでは、RNAポリメレースIIによって転写される一次転写産物のうち実に95%以上がイントロンである。これらのことは、イントロンを除く反応、すなわちmRNAスプライシングが遺伝子発現には必須であり、除去されたイントロンが核内できちんと代謝されることが必要であることを示している。このイントロン代謝過程を明らかにしたいと考えている。また、 mRNAスプライシングは単にイントロンを除去するだけの反応ではなく、エクソンとエクソンとの連結部近傍に、EJCという特異的な複合体を付加し、mRNAスプライシングと他の細胞内遺伝子発現過程との連携を行う過程であることが明らかになってきた。中でも神経細胞における細胞内mRNA局在や、転写と共役したDNA修復(TCR)との連携を示唆するデータを得ており、mRNAスプライシングとこれらの過程の新たな連携を明らかにしていきたいと考えている。
世界中の死因のうち、悪性腫瘍による死亡は13%を占めるため(2006年度WHO)、悪性腫瘍の画期的な治療法の確立は最優先で行われるべき研究のひとつである。悪性腫瘍では様々な選択的スプライシング異常が起き、その異常が悪性腫瘍の増殖を促進していることがわかっている。そのため、異常なスプライシングを正常細胞で起きているスプライシングに近づけることができれば有用な抗がん剤になり得ると考えられる。我々は、がん細胞におけるRNA選択的スプライシング制御機構の解明とその機構を利用した革新的抗がん剤を開発することを目標としている。現在、悪性腫瘍増殖に関わる重要な遺伝子の選択的スプライシング制御機構を培養細胞やin vitroスプライシングなどを用いて解析している。さらに、蛍光タンパク質を融合させたスプライシングレポーターにより、スプライシングアイソフォームの切換えを培養細胞レベルでイメージングすることに成功している。このレポーターと低分子化合物ライブラリーを組み合わせることにより抗がん剤のスクリーニングを行う予定である。
ヒトゲノムの解読により、518種類に上るタンパク質リン酸化酵素の存在が予想されている。これらのリン酸化酵素は生命現象の多彩な局面で重要な役割を果たし、また、幾つかのリン酸化酵素に対する特異的阻害剤が、既に臨床の場で主要な治療薬として使用されている。しかし、依然として多くのリン酸化酵素においては、その生理的・病的な機能は解明されていない。また、機能が判明している物においても、臨床的に有用な阻害剤や活性促進剤が得られている物はごくわずかにすぎない。
我々は先に SR protein kinase (SRPK) family、cdc2-like kinase (Clk) family の特異的な阻害剤を世界に先駆けて開発し、これらの化合物が生命現象を解明する上で有用なツールになりうる事を示した。特に前者については、SRPK阻害剤が抗ウイルス剤の有望な創薬シーズである事を見いだしている。
この成功を基に、阻害薬開発の対象とするリン酸化酵素を拡大して、さらなる探索を進めている。SRPK family と Clk family はそれぞれ近縁のリン酸化酵素ファミリーであるが、他にも dual-specificity tyrosine-(Y)-phosphorylation regulated kinase (DYRK) family、Homeodomain interracting protein kinase (HIPK) family、human pre-messenger RNA processing 4 protein kinase (PRP4) が近縁に位置し、全体としてより大きなリン酸化酵素ファミリーを形成している。これらのリン酸化酵素は、中枢神経系の発生および機能維持、アポトーシスの制御、pre-mRNA スプライシング等に関与している。我々はこれらの分子を総称してPSYCHIK ファミリー (PRP4、SRPK、DYRK、Clk、HIPK Family)と呼ぶ事を提唱し、それぞれのファミリーに対する特異的阻害剤を開発している。現在、既に得られている新規化合物に対して、リン酸化酵素と阻害剤の共結晶構造解析を行うと同時に、その研究ツールとしての有用性及び、創薬シーズとしての可能性について検討中である。
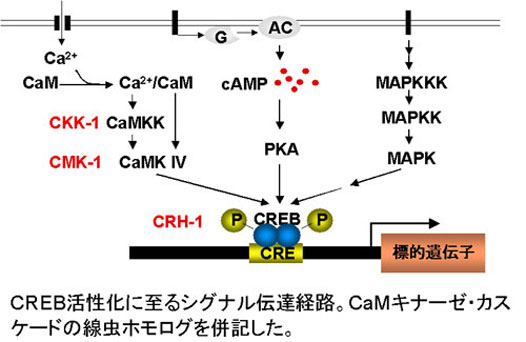
転写因子CREBはcAMPに応答する認識配列(CRE)に結合する転写因子として同定され、動物界に広く保存されており、マウスではCREBが空間認識・記憶などの脳の高次機能に重要な働きを持つことなどが示されている。一方、生化学的・細胞生物学的解析から、CREB活性化に至る細胞内シグナルとして、MAPKカスケード、CaM-Kカスケード、cAMP-PKA経路などが同定されている。しかし、各組織に普遍的に発現するCREBが、それぞれの細胞でどのような刺激に応答してどの経路で活性化され、どの遺伝子の発現制御を通じて生物個体全体に影響を及ぼすかの全体像は明らかになっていない。
我々は線虫(C. elegans)のCREB/crh-1の遺伝子を単離し、遺伝子破壊株を作製して、この変異体が高温耐性幼虫様幼虫誘導構成性の表現型を示すことを見出した。耐性幼虫は高温・飢餓・高フェロモンの環境条件により誘導される特殊な形態を持った休眠状態の幼虫である。近年、耐性幼虫形成は線虫のXXX細胞から内分泌されると考えられるステロイド・ホルモンの作用により負に制御されていることが明らかとなってきた。我々は体細胞で普遍的に発現しているCREB/crh-1が耐性幼虫形成制御において機能する組織を特定するためにさまざまな組織特異的プロモーターでCREB/crh-1を発現してcrh-1変異体のレスキューを試み、XXX細胞で発現させた場合のみ耐性幼虫様幼虫誘導構成性の表現型がレスキューされることを見出した。また、このレスキュー活性にはCREBの活性化時にリン酸化されるSerが必要であることがわかった。このことは、CREB/CRH-1が線虫の内分泌細胞で機能して、変体を制御する重要な情報伝達経路の一部を担っていることを示している。現在、XXX細胞においてCREB/CRH-1をリン酸化し活性化するプロテイン・キナーゼの同定を遺伝学的手法で進めている。