1.生体内選択的スプライシング・レポーターによる組織特異的
・発生段階依存的選択的スプライシング制御機構の解明


 |
 |
| 大学院入試情報 | アクセス・連絡先 |
1.生体内選択的スプライシング・レポーターによる組織特異的
・発生段階依存的選択的スプライシング制御機構の解明 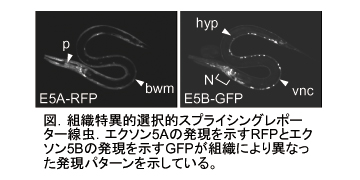 mRNA前駆体の選択的スプライシングはヒトの全遺伝子の3分の2に見られる普遍的な機構で、高等生物の限られた数の遺伝子から多様なmRNA・タンパク質を産生するのに大きく寄与しており、組織特異的あるいは発生段階依存的な制御が数多く知られている。しかし、選択的スプライシング制御機構は主に培養細胞系を用いて解析されてきたために、生体における組織特異的・発生段階依存的な制御機構の全貌は未だ明らかではない。 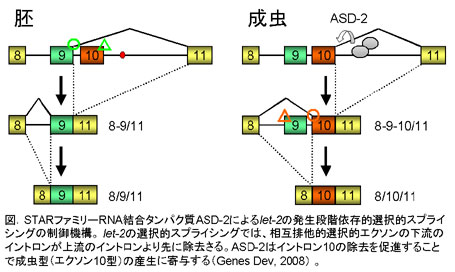 生体内での選択的スプライシングの制御機構を解析するために、我々はモデル生物である線虫を用いて、選択的スプライシングをモニターするレポーター系を開発した(nature methods, 2006)。このレポーター系では、エクソンの選択的使用に応じてGFP, RFPなどの異なる蛍光タンパク質が発現するようデザインされたミニ・ジーンを作製して線虫に導入しており、生体内における細胞ごとの選択的スプライシング・パターンを解析できる。
生体内での選択的スプライシングの制御機構を解析するために、我々はモデル生物である線虫を用いて、選択的スプライシングをモニターするレポーター系を開発した(nature methods, 2006)。このレポーター系では、エクソンの選択的使用に応じてGFP, RFPなどの異なる蛍光タンパク質が発現するようデザインされたミニ・ジーンを作製して線虫に導入しており、生体内における細胞ごとの選択的スプライシング・パターンを解析できる。我々はこのレポーター系を用いて、線虫のFGF受容体遺伝子egl-15の組織特異的なエクソン選択性を可視化し、組織特異性に異常を示す突然変異体を単離・解析して、スプライシング制御因子として新規のFox-1ファミリーRNA結合タンパク質ASD-1 (Alternative-Splicing-Defective-1)と、別のファミリーのRNA結合タンパク質SUP-12が協同してegl-15の組織特異性を制御することを見出した(Mol Cell Biol, 2007)。 我々はまた、線虫のコラーゲン遺伝子let-2の発生段階依存的なエクソン選択性を可視化し、発生段階依存性の変異体を単離・解析して、スプライシング制御因子として新規のSTARファミリーRNA結合タンパク質ASD-2を同定した。さらに、一部のイントロンのみが除去されたプロセシング中間体を変異体から検出することにより、選択的スプライシングによるmRNA前駆体の運命決定に重要なイントロン除去の順序を明らかにした(Genes Dev, 2008)。 これらの成果は、選択的スプライシング・レポーターを用いることで、これまで解析されていなかった生体内における選択性制御機構を明らかにできることを示している。さらに、我々が線虫で同定したスプライシング制御因子が哺乳類にまで保存されていることから、選択的スプライシングによる遺伝子発現制御そのものが進化的に保存されていることが明らかとなりつつある。 2.マウスの中枢神経系におけるプロテオームの多様化創出と部位特異的発現制御メカニズムの解明
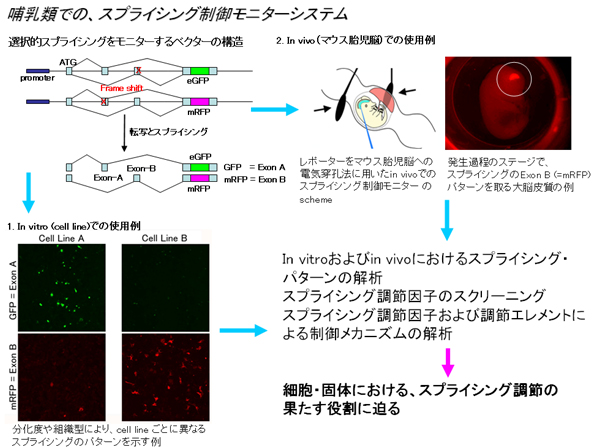 哺乳類の臓器の中で特に高度で複雑な構造と機能を持つ神経系では、神経細胞が発現している神経伝達物質の受容体、神経細胞の相互のコネクションを制御する細胞接着因子、神経発生プログラムや機能発現を制御する転写因子など、脳の機能に必須のさまざまな重要な分子が選択的スプライシングによりそれぞれの遺伝子機能の発現を調節さていることが知られている。またこれらの遺伝子の選択的スプライシングの異常により、神経変性疾患、痴呆、精神疾患、筋萎縮性および緊張性の変性疾患、および脳腫瘍などが起こることが報告されており、実際にヒトの中で、選択的スプライシング制御が非常に重要な役目を担っていることが分かって来ている。 しかしながら発生時期や臓器や細胞ごとに、個々の遺伝子がどのような内部の状況や外部刺激に反応して、またどのようなスプライシング制御因子の相互作用からなる調節を受けて、細胞や臓器全体としていかに機能発現を調節されているかについては、実際まだほとんど分かっていないのが現状である。 そこで我々は、マウスの初代培養神経細胞、さらには個体の中での選択的スプライシングの状態を、発生過程の神経系や成体脳の部位ごとに、シングルセルのレベルでモニターするスプライシング・モニター系を作成することにより、哺乳類の個体発生、とくに神経系の形成過程および成体の脳の中でのスプライシング制御のダイナミズムを明らかにする。このレポーター系を用いて、In Utero electroporation, mouse geneticsなどを用いて、選択的スプライシングの制御機能を持つことが想定されている分子群の機能解析および、それらの神経発生、神経機能調節、大脳形成の制御機構を解明することにより、in vivoからin vitroまでのスプライシング調節機構とその機能の解明を目指す。 3.ウイルスRNAのスプライシング制御機構の解明とその治療への応用
ウイルスは、その小さなゲノムDNAから多彩な蛋白質を発現する必要があり、mRNAスプライシングや、プロテアーゼによる切断を行い種々の蛋白質を発現する。特にウイルスRNAのプロセシングでは、感染細胞のRNA結合蛋白質は不可欠な存在である。RNA結合蛋白質であるSR蛋白質は発見当初、選択的スプライシングを制御する因子として同定されたが、その機能は多彩であり、mRNAの輸送や蛋白質の翻訳にも関わる因子であることが証明されている。SR蛋白質ファミリーはSer−Arg反復配列からなるRSドメインを共通に持ち、このRSドメインは細胞内でSRPKs, CLKs等により高度にリン酸化されている。
我々はSR蛋白質の一つであるSRp75とそのリン酸化酵素SRPK2がHIV-1の産生を亢進することを見出している(PNAS, 2006)。このことから、細胞因子であるSR蛋白質とそのリン酸化酵素SRPKsはウイルスの増殖に必須な因子と考えられる。我々はこれらウイルスの増殖メカニズムに注目し、SRPKs特異的阻害剤としてSRPIN340を得ることに成功した。 SRPIN340はヘルペスウイルス、サイトメガロウィルス、シンドビスウィルス、SARSウィルス等に対しても増殖抑制能を有することから、適応範囲の広い抗ウイルス剤であることが明らかになり抗ウイルス薬として開発を進めている。さらに基盤的な研究として、ヘルペスウイルス由来のタンパク質に注目し、宿主の遺伝子発現にどのように干渉しているのか、その機能解析を行うことで新たなウイルス増殖機構の解明を試みている。 また、SRp75がアデノウイルスE1A遺伝子の選択的スプライシングの調節を行うこと、そしてその調節がClksによるリン酸化で増強されることを見出した。現在、SRp75によるスプライシング制御機構について解析を行っており、SRp75がウイルス増殖や発生・分化に関わる機構の解明を進めていく予定である。 |
| Copyright (C) 2005-2008 Department of Functional
Genomics, Tokyo Medical and Dental University Medical Research Institute & School of Biomedical Science. All Rights Reserved. |