Research
We aim to understand the biological functions of cells. Abnormalities in critical cellular processes are always associated with the development of disease. We conduct research to identify genes and molecules that are "actually" involved in cellular functions through non-bias screening using forward genetics and biochemistry and to clarify the functions of the identified molecules in vivo and their pathological significance through mutation analysis in mouse models and humans. We are currently conducting the following research.
1. Mechanisms for Phospholipid Asymmetry & Phospholipid Homeostasis
細胞は、細胞膜により外界と隔離されています。細胞膜はリン脂質の二重層を主体とした構造体であり、通常、リン脂質は非対称に分布します。アミノリン脂質であるホスファチジルセリン(PtdSer)やホスファチジルエタノールアミン(PtdEtn)は細胞の内側に限局しますが、ホスファチジルコリン(PtdCho)やスフィンゴミエリン(SM)は表面の外層に多く存在します。一方、細胞はさまざまな局面でリン脂質の非対称分布を崩壊させます。例えば、死をとげたアポトーシス細胞は、ホスファチジルセリン(PtdSer)を細胞表面に露出することでマクロファージに特異的に貪食されます。この場合のPtdSerはマクロファージに食べられるためのシグナルとして機能することから、“eat me”シグナルと呼ばれます。活性化した血小板は、PtdSerを表面に露出することで血液凝固反応を促進させます。その他にもさまざまな局面において、細胞がPSを露出することが知られています。
リン脂質の非対称性はどのように維持され、そしてどのように崩壊するのでしょうか?
リン脂質の中でもPtdSerの非対称性を樹立する分子はフリッパーゼ(Flippase)と呼ばれていました。私たちは、哺乳類細胞の細胞膜で機能するFlippaseとしてP4-ATPaseファミリーに属するATP11AとATP11Cを同定しました(Segawa K et al., Science 2014; Segawa K et al., J Biol Chem 2016; Segawa K et al., J Biol Chem 2018 )。ATP11AとATP11Cは細胞膜におけるPtdSerを移層する活性のほぼすべてを担います。ATP11Aが存在しないマウスは胎生致死となり、ATP11Cが存在しないマウスは重度B細胞減少症、貧血、胆汁うっ滞、難産などさまざまな表現型を呈します(Segawa K et al., Trends Cell Biol 2015; Segawa K et al., PNAS 2018)。また最近、重度心身障害の患者さんにATP11Aの点変異を見出し、その病態を明らかにしました(Segawa K et al., J Clin Invest 2021)。一方、PtdSer以外の膜脂質の非対称分布がどのように樹立・維持されているのかその分子機構や生命機能については不明な点が多く残されています。現在、リン脂質だけでなくさまざまな細胞膜の膜脂質やオルガネラ膜脂質の分布を制御する分子機構を明らかにする研究、リン脂質の状態を感知・応答する分子機構の研究、その生理・病態学的な意義を明らかにする研究を進めています。特に、膜にかかる力(The force-from-lipids principle)とその応答のメカニズムに興味をもっています。
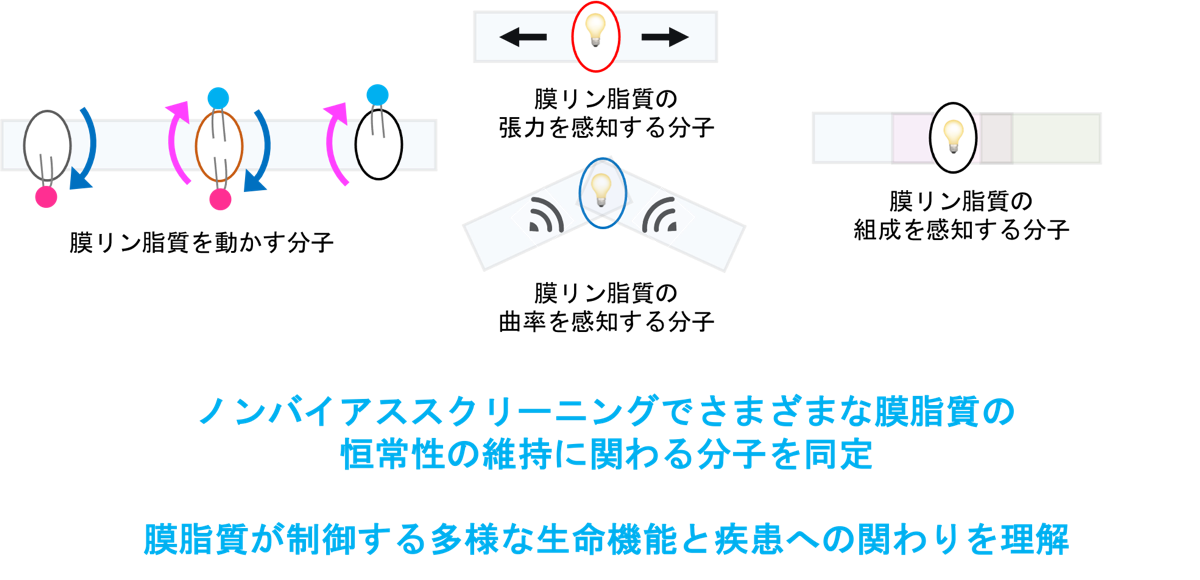
2. P4-ATPases in Diseases
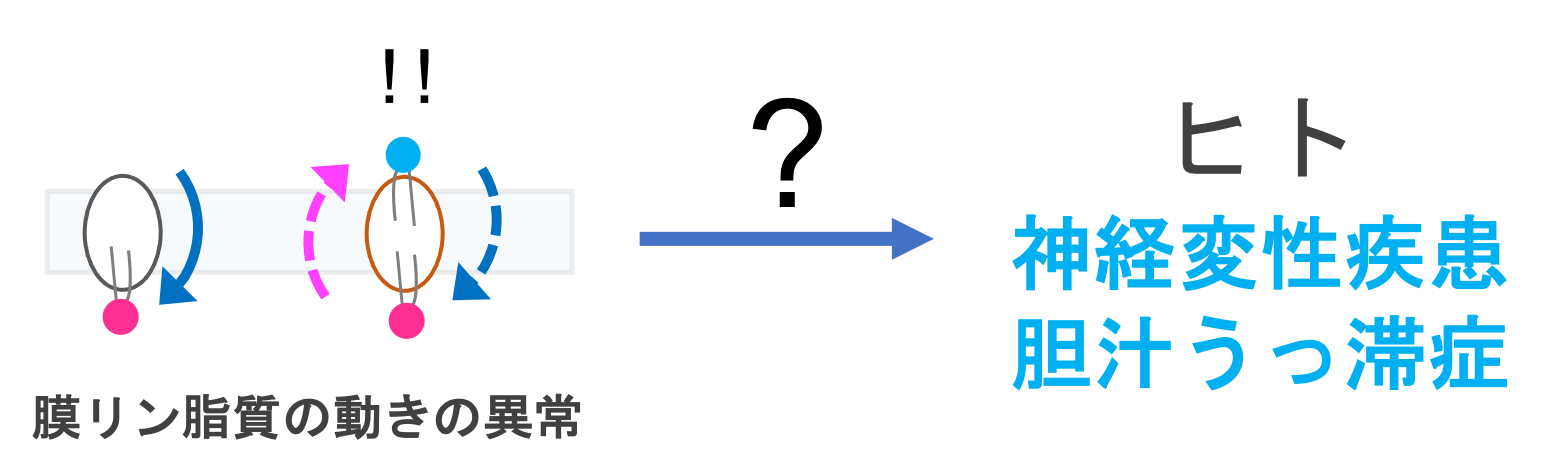
ATP11AとATP11Cが属するType IV P-type ATPase (P4-ATPase)ファミリーは、ヒトでは14種類のメンバー (ATP8A1, 8A2, 8B1-8B4, 9A, 9B, 10A, 10B, 10D, 11A-11C)で構成されます。マウスにおいて、各メンバーの変異がさまざまな疾患を引き起こすことが明らかにされています。ヒトにおいても、ATP8A2, ATP8B1の変異は、それぞれ小脳失調・精神遅滞および平衡障害症候群(CAMRQ)と進行性家族性肝内胆汁うっ滞(PFIC)の原因となります。いずれも、根本的な治療法が存在しません。また最近、私たちはATP11Aの点変異がヒトに重度の発生異常と神経障害を引き起こすことを見出しました(Segawa K et al., J Clin Invest 2021)。これらのP4-ATPaseの異常はリン脂質の動態の異常を引き起こしますが、その動態の異常がどのように各種疾患を引き起こすのか、疾患発症メカニズムはわかっていません。これらのP4-ATPase変異マウスを用いて疾患発症メカニズムを明らかにし、フリッパーゼに変異をもつ患者さんに貢献することを目指しています。現在は、なぜリン脂質の動態異常が神経疾患を引き起こすのか、また他の神経変性疾患との関連はあるのかに焦点を当てた研究を行っています。東京医科歯科大学という臨床に近い環境を活かし、実際の治療を念頭においた研究が可能です。
3. Aging and Cell Fate Control
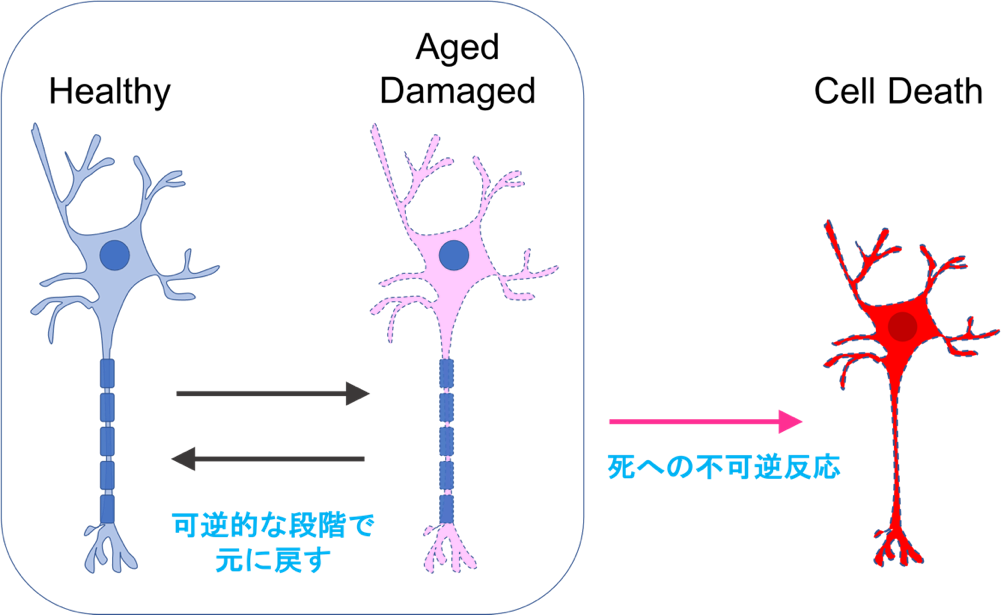
これまで上述のリン脂質膜動態の研究とマクロファージによるアポトーシス細胞(死細胞)の貪食メカニズムの研究を行ってきました(Segawa K et al., PNAS 2011; Toda S et al., Blood 2014; Yanagihashi Y et al., PNAS 2017; Nagata S et al., Curr Opin Immunol 2021)。2021年の独立を機に、新しいプロジェクトを始めます。目標は、“老い”の理解です。流行りの研究内容ではあるのですが、やはり不思議です。なぜ、生命は老いるのか、そのスピードはなぜ種によって異なるのか?また、“老い”はがんや神経変性疾患など社会的に大きな影響を及ぼす疾患の最大のリスク因子です。なぜ、多くの疾患のリスクとなるのか?しかも、誰もが老いを避けることはできません。もはや老化を“病”と捉える研究者もいます。私たちは、非増殖細胞の老化に焦点を当てます。特に、老化状態に陥った非増殖細胞を特異的に若返りさせる手法の樹立を目指しています。独自のノンバイアススクリーニングの系を立ち上げて、非増殖細胞の老化にチャレンジします。
4. And beyond
上述の3つのプロジェクトを遂行していきますが、研究はどの段階でどのような発見につながるか予測できません。また、楽しんでこその研究だと思います。本当に面白いと思える結果やアイデアに対しては、失敗を恐れずチャレンジしようと思います。
