Core Concepts
�����̋Z�p�ƃo�C�I�E��Â̗Z��
�i�m���[�^�[�T�C�Y�A���q���x�����������Ƃ��ł���V���ȋZ�p�̓������}���ɓW�J������A�����̊w�╪��̘g���ăo�C�I�E��w����ƍH�w�Ƃ̗Z������������Ă��܂��B �o�C�I�g�����W�X�^�Z�p�͔����̔����H�Z�p��p���邱�Ƃɂ��W�ω��E�����x�����\�ł���A�����ڂɓd�C�M���ɕϊ����邱�Ƃ��ł���̂ŁA��ʐ��A�ȕ��ɗD�ꂽ��͂������ł��܂��B ���q�d�ׂ̒��ڌ��o�Ƃ��������Z�p�Ƃ͂܂������قȂ錴���Ɋ�Â��Ă���A�u�����o�̂悤�Ƀ��[�U�[����w�n���s�v�ł���A���^�̐��̕��q��̓V�X�e�����\�z����̂ɗL���ł��B ���������āA���E���a�@��f�Ï��Ȃǐg�߂Ȉ�Ë@�ւō��x�Ȉ�Â���邱�Ƃ��ł��A�Ⴆ��DNA����z��̈Ⴂ�Ɋ�Â���܂̗L�����E����p�̌l�����ȕւɒ��ׂ邱�Ƃ��\�ƂȂ�܂��B �K��f�Â�ݑ�P�A�ł͊��҂̋߂��Ō����E�f�f���s����悤���^�E�ȕւȌ������u�����߂��Ă���A�o�C�g�����W�X�^�̓�����傫�����������Ƃ��ł��܂��B ����A��p�ޗ��E���邢�͉��ϕi�̕���ł́A���������̑�ւƂ��Ĕ|�{�זE��p������͋Z�p���d�v�ɂȂ�ƍl�����܂��B �|�{�זE��p������͂ł́A���������V�K�������͋M�d�ł��邽�߁A���ʂ̎����ł���͉\�ł��邱�Ƃ��]�܂����A������A���o��̔��������K�v�ł��B �����̂ƍזE��Z���������u�זE�g�����W�X�^�v�́A�����̃j�[�Y�ɍ��v�����V�X�e���̃L�[�Z�p�ɂȂ�ƍl���܂��B �܂��A�Đ���Â̕���ł͐��̓��ɃC���v�����g����זE��g�D�̈��S���̊m�F�����߂��Ă��܂��B���҂̎��Ƒg�D��p���邽�߁A���ʂ̑g�D�̈��S�����N�P�ŕ]������K�v������A�זE�g�����W�X�^��p���ĕ]���p�����[�^�[��T�����邱�Ƃɂ��A��N�P�̍זE�]���������\�ł���܂��B �זE�����w�Ȃǂ̊�b�Ȋw����ł́A�o�C�I�g�����W�X�^�ł̓Q�[�g�≏���\�ʋߖT�Ő�����d�ז��x�ω������o�ł��邽�߁A���^���p�N����g�����X�|�[�^�[�̔������x�_�I��́A�זE�����Ȃǂɔ����d�C���ۂ̃��j�^�����O�ȂǐV���Ȓm����������Ɗ��҂���܂��B �ȏ�̂悤�Ƀo�C�I�g�����W�X�^�̓}�C�N���E�i�m�e�N�m���W�[�ƃo�C�I�E��Õ���̋Z�p��Z�������Ď�������܂��B �}�C�N���E�i�m�e�N�m���W�[�̐����ɐ��䂳�ꂽ�����H�Z�p�A�����x�v���Z�p�Ɛ����̎��I�𐫂̍��������A���q�F�����i�m���[�^�[���瓝�����邱�Ƃɂ��A�V���Ȋw��̈�̌`���A�V�K�Y�Ƒn�o����������ƍl���܂��B
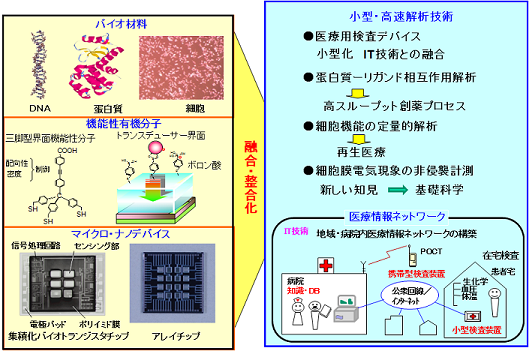
�o�C�I�g�����W�X�^
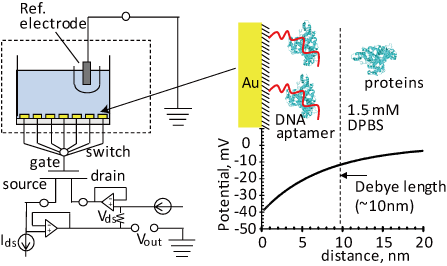
�����̃o�C�I�Z���T�A�o�C�I�`�b�v�A���邢�͐��̍ޗ��́A�ޗ��\�ʂƐ��̕��q�E�זE�E�g�D�Ƃ̑��ݍ�p�𗘗p���Ă���A�ړI�ɉ������ޗ��\�ʂ̋@�\�v�E���䂪�d�v�ƂȂ�܂��B �o�C�I�g�����W�X�^�̃Q�[�g�≏����ɂ����Đ��̕��q�F���������f�U�C�����邱�Ƃɂ��A��͑Ώۂɑ�����ِ���t�^���邱�Ƃ��ł��܂��B �Ł^�t�E�ʂ̉��w�C���E�i�m�\���n���ɂ��A��\�ʂɂ����鐶�̕��q�F�������������I�ɍs�킹��i�m�E�ʂ�n�����܂��B DNA�A�^���p�N���A�זE�Ȃǐ��̂��\������ޗ��̋@�\�ƁA�����̍ޗ��E�f�o�C�X�@�\�Ƃ̑��ݍ�p�𖾂炩�ɂ��A���̕��q�Ƃ��̋@�\�����o���錴���A�M���ϊ��̃��J�j�Y���𖾂炩�ɂ��邱�Ƃ���ł��B �܂��A�o�C�I�g�����W�X�^�̓d�ʉ����̓Q�[�g�≏���^�n�t�E�ʂ̓d�C��d�w�iDebye���j�ɑ傫���ˑ����܂��B Debye���̓����ŗU�N�����d�ז��x�ω������o�ł������ADebye���O���ɂ�����d�ז��x�ω��̓J�E���^�[�C�I���ɂ��V�[���h����AFET�Ō��o���邱�Ƃ͂ł��܂���B Debye���͒ʏ�̓d���t���ł�1nm����10nm���x�ł���A�Q�[�g��ɌŒ艻����鐶�̕��q�̑傫���͐�nm����10nm���x�ł��B �^�[�Q�b�g���q�̑傫���ɂ���Ă�Debye�����z����ꍇ������A�ɏՉt�Z�x�Ɛ��̕��q�̑傫���̍œK�����d�v�ƂȂ�܂��B
IBB Journal Reports
- �O�����C�ђˑ��C�������C�{���T��C�g�{�����_�U���̂ɂ��s�������_�̑I��I�F���h, ���̍ޗ��H�w�������N��, 2014, 48, 26-29.
PDF�Ō��� (1.24 MB) - ���c�B�Y�C�{���T��C�g���̖͕�E�ʂ����������ǐ��`�����̕��q���ԁh, ���̍ޗ��H�w�������N��, 2013, 47, 22-25.
PDF�Ō��� (1.79 MB) - ���c�B�Y�C�{���T��C�g�z���^���p�N���̓d���o�Ɣz���]���h, ���̍ޗ��H�w�������N��, 2012, 46, 16-19.
PDF�Ō��� (2.06 MB) - �������C�{���T��C�g�����^�C���X�������^�f�o�C�X�̊J���\���S�����^�̐l�H�X���\�h, ���̍ޗ��H�w�������N��, 2011, 45, 41-44.
PDF�Ō��� (1.82 MB)

Research Topics
�����^�C���X�������^�f�o�C�X�̊J��-���S�����^�̐l�H�X��-
���A�a���Â̂��߂̎����^�C���X�������^�V�X�e�����w�������A���S�����i��^���p�N�j�^�̃O���R�[�X�������Q���̑n�o��ڎw���Ă��܂��B �����ʼn𗣂����t�F�j���{�����_�iPBA�j��̐ϑ��]�ڐ��̍����q�Q���l�b�g���[�N���ɓK���Ȋ����œ�������ƁA�O���R�[�X�Z�x�ω��ɉ��������i�𗣕��t�V�t�g�ɔ����C�I���Z�����ω��ɂ���āj�t�I�ȃQ���̑̐ϑ��]�ڂ������N������܂��B ���̃Q���ɃC���X���������Ă����A�����l�ω���ǐ������C���X�����̋������䂪�\�ƂȂ�܂��B ���Ȃ킿�A���O���R�[�X���Ŗc�������Q�����O���R�[�X���ֈڂ��ƁA�Q���\�ʂɁu�X�L���w�v�ƌĂ�锖���E�����k�w���������܂��B �X�L���w���`�������ƁA�Q����������O���ւ̃C���X�������q�̊g�U���W�����A���̕��o�ʂ��������������܂��B �܂��A�X�L���w�̓Q���\�ʋߖT�݂̂Ő������A���������݂����������߁A�Ăъ����̃O���R�[�X�Z�x����������ƁA���ꂪ�v���ɏ������ăC���X�����̕��o�ʂ����܂��B PBA�Q���͊��S�����n�i��^���p�N�ޗ��j�ł���A�]���̐��̗R���ޗ��ɂ��u�����^�C���X�������^�f�o�C�X�v�ƈقȂ�A�^���p�N�ϐ��ɂ�钷���s���萫�⋭���Ɖu�Ő��Ƃ������ۑ�����ɉ�������|�e���V������L���Ă��܂��B

References
- A. Matsumoto et al., Angew. Chem. Int. Ed., 2012, 51(9), 2124. Check,
- B. Beier et al., Sensors, 2011, 11, 409. Check,
- A. Matsumoto et al., Chem. Commun. , 2010, 46, 2203. Check,
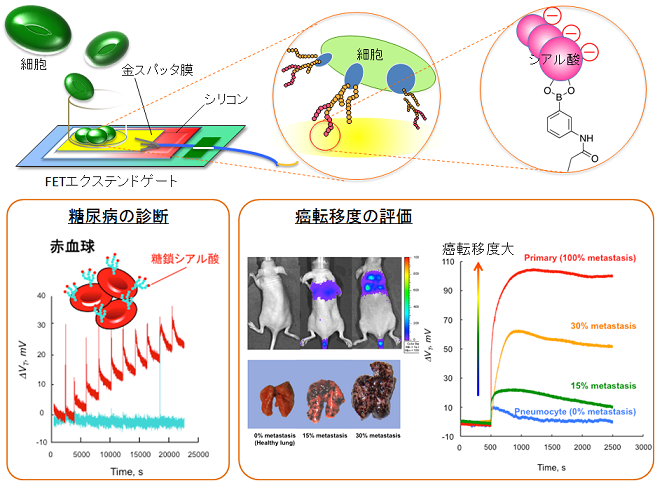
�����V�A���_���v�������N�P�ȍזE�f�f
�d�E���ʃg�����W�X�^�iFET�j��p������N�P�E��W���v���\�ȓ������o�f�o�C�X��n�o���܂����B �V�A���_�́A�������ɍł����p�x�A���������[�ɑ������݂��镪�q�ł���A���̖��x�╪�z�́A�זE�̎��a�i���A�]�ځA���A�a�A���ȖƉu�a�j�A�����A�����ȂǁA�l�X�ȍזE���ۂƊW���ĕω����邱�Ƃ��m���Ă��܂��B �����ŁA�V�A���_���q����ٓI�ɔF������t�F�j���{�����_��ܗL��������FET�Q�[�g�\�ʂɌŒ艻�����u�V�A���_�F���g�����W�X�^�v���\�z���A�Q�[�g��ɔd�킵���זE���瓾����d�C�M�����u�זE�̏�ԁv�ɑ��鑊�֎w�W�Ƃ��ėp���錟���������Ȃ��܂����B �����I��pH7.4�t�߂ɂ����ẮA�Q�[�g�\�ʂ̃t�F�j���{�����_�͔�𗣏�Ԃő��݂��A���̌��ʁA�V�A���_���q����ٓI�ɔF�����܂��B �����̌��ʁA���炩���ߐ���ȍזE�ɂ��Ă̔Z�x-�������l�d��(VT)�v���t�@�C����������A�Ȍ�A���m�̔Z�x�̐Ԍ������Q�[�g��ɔd�킷�邾���ŁA���̃V�A���_�����ʂ����A���^�C���ɋ��߂��邱�Ƃ���������܂����B �܂��A�}�E�X���F��iB16-F10-Luc-G5�j��x�ɓ]�ڂ������g�D�ɂ��ē]�ړx���ʓI�ɕ]���ł��邱�Ƃ��������܂����B �ȏ�A�t�F�j���{�����_��ƃV�A���_���q�Ƃ̓��ٓI�ȔF�������𗘗p�����u�V�A���_�F���g�����W�X�^�v���\�z���A����ɂ��A�W���Ȃ��ɁA�זE�ɑ��Ĕ�N�P�ɂ��y�f������p�����ɍזE�\�ʂ̃V�A�����q�ڌ��o���邱�Ƃɐ������܂����B �זE�\�ʂ̃V�A���_�����ʕω���d�C�V�O�i���Ƃ��đ����A����𐳏�זE�Ɣ�r���邱�ƂŁA���A�a����̓]�ړx�̐f�f�ւ̓W�J�����҂���܂��B �܂��A�����ŗp����ꂽ�ޗ��E�f�o�C�X�`�Ԃ́A������CMOS�����v���Z�X�Ɗ��S�ɓK��������̂ł���A�����̐����Z�p�̊��p�ɂ���āA���^����W�ω����A�����ŗe�Ղɍs����Ƃ������݂�����܂��B
References
- A. Matsumoto et al., Angew. Chem. Int. Ed., 2010, 49, 5494. Check,
- A. Matsumoto et al., J. Am. Chem. Soc., 2009, 131, 12022. Check
- A. Matsumoto et al., Curr. Appl. Phys. 2009, 9, 214. Check
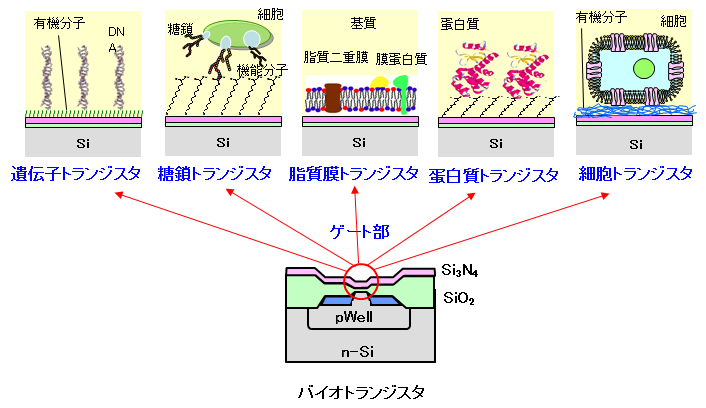
�o�C�I�g�����W�X�^�ɂ���`�q���
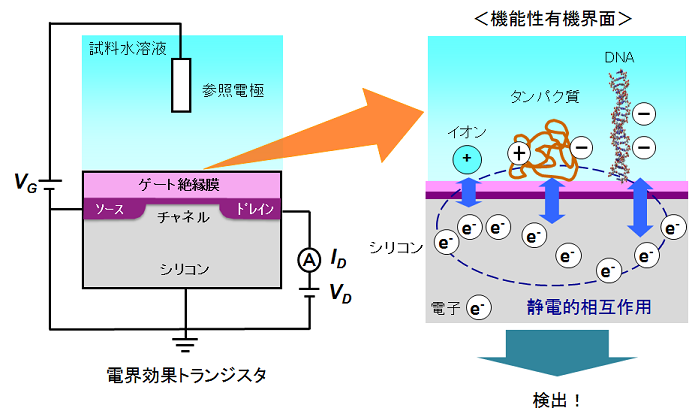
�d�E���ʃg�����W�X�^(FET)�̃Q�[�g�d�ɂ̕\�ʂ�DNA�v���[�u���Œ艻���A�^�[�Q�b�g��`�q�ƃQ�[�g�̕\�ʂŃn�C�u���_�C�[�[�V�������s�킹�A���̍ۂɐ�����\�ʓd�ז��x�̕ω���d�E���ʂ𗘗p���Č��o������@���Ă��܂����B �����̔����H�Z�p��p���邱�Ƃɂ��W�ω��E�����x�����\�ł���A�܂��L�������ڂɓd�C�M���ɕϊ����邱�Ƃ��ł���̂ŁA��ʐ��A�ȕ��ɗD�ꂽ����z���͂������\�ł��B �o�C�I�g�����W�X�^�ł�DNA���q�̓d�ׂڌ��o���邽�߁A�u�����o�̂悤�Ƀ��[�U�[����w�n���s�v�ł���A���^�̐��̕��q��̓V�X�e�����\�z����̂ɗL���ł��B ���̈�`�q�g�����W�X�^��p���A�Q�[�g��ŃA�������ٓI�n�C�u���_�C�[�[�V�����A�C���^�[�J���[�V�����Ȃǂ̕��q�F���������f�U�C�����A�ꉖ��̈Ⴂ�����o�ł��邱�Ƃ��m�F���܂����B ���̌����Ɋ�Â��ꉖ��^�iSNP�j��͂��s���A�R�̈قȂ�^�����ʂł��邱�Ƃ������܂����B ����ɁA�ꉖ��L�������ƕ��d�ב�����J��Ԃ��s�����Ƃɂ��ADNA�̉���z������肷�邱�Ƃ𐢊E�ɐ�삯�ĕ��܂����B �����4��ނ̃f�I�L�V�k�N���I�`�h�������Y������ƁA�^�[�Q�b�gDNA�̉���z��ɑ���I�ȏꍇ�̂݃V�O�i���������邱�Ƃɂ����̂ł��B
References- T. Sakata and Y. Miyahara, Biosens. Bioelectron., 2007, 22, 1311. Check
- T. Sakata et al., Langmuir, 2007, 23, 2269. Check
- T. Sakata and Y. Miyahara, Angew. Chem. Int. Edn., 2006, 45, 2225. Check
- T. Sakata and Y. Miyahara, Biosens. Bioelectron., 2005, 21, 827. Check
- T. Sakata and Y. Miyahara, ChemBioChem, 2005, 6, 703. Check
- T. Sakata et al., Japanese Journal of Applied Physics, 2005, 44, 2854. Check
- T. Sakata et al., Materials Science and Engineering C, 2004, 24, 827. Check
Projects
47�D�헪�I�n���������i���Ɓ@���������i�����̈�u���S�̂Ƃ��̏W�ς̂��߂̍ޗ��E�f�o�C�X�E�V�X�e���v�j
- �ۑ薼�F�C�I�m�G���N�g���j�N�X�Ɋ�Â����a�f�f�v���b�g�t�H�[���̊J��
- ���ԁF�ߘa3�N10���]�ߘa7�N3��
- ��\�ҁF�c�����K
46�DCOI ���A�g�����t�@���h
- �ۑ薼�F�P�̌����I�ȕߏW�ɂ��ȈՃE�B���X�j�_���o�t�B�����̊J��
- ���ԁF�ߘa3�N4���]�ߘa4�N3��
- ��\�ҁF�c�����K
45�D���Ɏq���c�u��������v
- �ۑ薼�F�i�m�|�A�f�o�C�X�ɂ��ċz��n�����ǂ̐V�K�v���f�f�Z�p�̑n�o
- ���ԁF�ߘa2�N4���]�ߘa3�N3��
- ��\�ҁF�x���@�g
- Link (PDF)
�������e�F�i�m�|�A�f�o�C�X�ƌĂ������q�̌ʌv���Z�p�����p���A�C���t���G���U���n�߂Ƃ����E�C���X���ċz�튴���ǂ̐v���f�f�Z�p���J������B
44�D�Ȋw������⏕���F��Ռ���(B)
- �ۑ薼�F�{�����_�̓��قȕ��q�F�������p�����u�l�H�g�����X�|�[�^�[�v�̊J��
- ���ԁF�ߘa2�N4���]�ߘa5�N3��
- ��\�ҁF������
- Link
�������e�F�k�N���I�V�h�[���̓��̖�܂��A�������̃g�����X�|�[�^�[�Ɉˑ������A����זE�֓��ٓI���������ɑ��B�\�ȁu�l�H�g�����X�|�[�^�[�v�̎d�g�݂��J������B
43�D�Ȋw������⏕���F��Ռ���(C)
- �ۑ薼�F�E�d�C��R�@�Ƌ@�\���i�m�o�C�I�E�ʂɂ��V��̔����q��͋Z�p�̑n�o
- ���ԁF����31�N4���]�ߘa4�N3��
- ��\�ҁF�x���@�g
- Link
�������e�F�E�d�C��R�@�ɂ�钴���ʔ����q���͉�͋Z�p�Ƌ@�\���i�m�E�ʋZ�p��Z�����A�V��Ȑ��̑��ݍ�p��͋Z�p�n�o�Ɍ�������b�I�Ȍ�����W�J����B
42�D�Ȋw������⏕���F��Ռ���(C)
- �ۑ薼�F�זEpH�ۓ����ۂƓd�E���ʃg�����W�X�^��p���������x���̃o���A�]���@�̊J��
- ���ԁF����31�N4���]�ߘa4�N3��
- ��\�ҁF���c�B�Y
- Link
�������e�F��_�E�㉖��̏u�ԓI�Ȗ\�I�ɂ��זE�ߖTpH����@�Ƃ�g�ݍ��킹�A�ŏ����q�ł���v���g���̘R�o���w�W�Ƃ������ɂ̊��x��L����in vitro�זE���^�זE�ԃo���A����@���m������B
41�D�c���M�������c�F�S�[���h��
- �ۑ薼�F�̓��Ǐ�pH�������������_���C���W�E�������d�ɂ̊J��
- ���ԁF����31�N4���]�ߘa2�N3��
- ��\�ҁF���c�B�Y
- Link
�������e�F�_���C���W�E���d�ɓ������^�f�o�C�X�ɂ��in vivo�Ǐ�pH�Z���V���O�V�X�e���̊J���������Ȃ��B����܂ŕs�\�ł������̓���pH���N�P�A�A���I�A����ԕ���\�Ɍv�����邱�Ƃɂ��A�����g�D�ُ̈�𑁊��Ɍ��o���邱�Ƃ�ڎw���B
40�DKISTEC�F�L�]�V�[�Y�W�J����
- �ۑ薼�F�u�\�邾���l�H�X���v�̊J��
- ���ԁF�ߘa1�N�]�ߘa4�N3��
- ��\�ҁF������
- Link
�������e�F�O���R�[�X�������Q���ƃ}�C�N���j�[�h�����̒�N�P�牺�����Z�p�ƗZ�����A��v�ŗ����A���҂̎g�p���S���i�i�Ɍy������u������^�̐l�H�X���v����u�\�邾���l�H�X���v�̊J����ڎw���܂��B
39�D�V�G�l���M�[�E�Y�ƋZ�p�����J���@�\�iNEDO)�F�헪�I�C�m�x�[�V�����n���v���O�����i�r�h�o�j��Q�� �t�B�W�J����ԃf�W�^���f�[�^������� �T�u�e�[�}�U�������d��IoT�f�o�C�X�E�v�V�I�Z���T�Z�p
- �ۑ薼�F�������x�Z���T�V�X�e���̌����J��
- ���ԁF����30�N4���]
- ���S�F�{���T��
- Link
�������e�FComing soon!
38�D���ȏȁF�n��C�m�x�[�V�����E�G�R�V�X�e���`���v���O����
- �ۑ薼�F�_�ސ씭�u�w���X�P�A�E�j���[�t�����e�B�A�v�擱�v���W�F�N�g�i�e�[�}1�j�u�\�邾���l�H�X���v�̊J��
- ���ԁF����30�N9���]�ߘa4�N3��
- ��\�ҁF������
- Link
������Љ�ɐ��I�ɒ��킷�颃w���X�P�A�E�j���[�t�����e�B�A��̎����Ɍ����A�����㓜�A�a�C���X�������Ö@�̊J�����ʖє��Đ��Z�p�̊J�����A��w���Ɛ_�ސ쌧���Y�ƋZ�p�����������𒆐S�Ƃ������Ɖ��x���̐��̉��Ŏ��{����B���[�f�B���O�x���`���[�̑n�o�E�����𒆐S�ɁA�_�ސ�炵���C�m�x�[�V�����G�R�V�X�e������̉�����B
37�D�Ȋw������⏕���F��茤��
- �ۑ薼�F���a�֘A�ۂ̐v���E�ȈՃJ�E���e�B�O���s���X�}�[�g�o�C�I�f�o�C�X�̊J��
- ���ԁF����30�N4���]�ߘa2�N3��
- ��\�ҁF�c�����K
- Coming soon
���a�֘A�ۂ�d�C���w�I�ɐv���Ɍ��o���鏬�^�f�f�f�o�C�X���쐻���A�Տ���Â̌���ɂ����Ă��̏�f�f�\�ȍۃJ�E���e�B���O�V�X�e�����J�����邱�Ƃ�ړI�Ƃ��܂��B
36�DCOI ���A�g�����t�@���h
- �ۑ薼�F���̕ێ��ƃn�������߂����e�t�Ƃ��̌��ʂ������ł���Z���T�V�X�e��
- ���ԁF����30�N4���]�ߘa2�N3��
- ��\�ҁF�c�����K
- COI���A�g�����t�@���h
�����ɂƂ��Ĕ��e�͖��邭�߂������߂̃L�[�ł���ƂƂ��Ɏ��ȕ\���̈�̎�i�ł��B����ʼn���ɔ������g���u���͑������A�Y�݂��傫���Ȃ�܂��B �����ŁA�{�����ۑ�ł́A�@�畆�זE�̊����㏸�A�A���\�ʂ̏�ۃo�����X�̒����ɂ��A���g���u���ł����ɕێ��ƃn�������P���܂��B ����ɏ����̊Ԃł͔��e�t�̌��ʂ̎����Ƃ����j�[�Y���������A�B��ۃo�����X���ȕւɑ���ł���Z���T�̊J���s�����܂��B
35�D���{�Ɏq�ޗ��H�w������F��������
- �ۑ薼�FmicroRNA���o����������Z���~�b�N�����o�C�I�Z���T�̑n��
- ���ԁF����30�N4���]����31�N3��
- ��\�ҁF�c�����K
- ���c�����N
��艷�x�Ŋj�_�����������i�s���铙���j�_�����@�ɂ��microRNA����������@�ƃZ���~�b�N������p�����d�C���w�v����g�ݍ��킹���V�������o�V�X�e�����Ă��܂��B
34�D�Ȋw������⏕���F��茤��
- �ۑ薼�F�r�^�~���b��ӕ��̐����I�Ӌ`�̉�
- ���ԁF����30�N4���]����34�N3��
- ��\�ҁF�{�V���
- Coming soon
�ߔN�A�r�^�~���b�����ɂ����č��܂ŃA�X�R���r���_���������Ă����Ƃ���Ă����R�����p���͂��߂Ƃ��鐔�X�̐�����p�́A���͂����̑�ӕ����������Ă���\������������A�ɂ킩�ɒ��ڂ��W�߂Ă��܂��B ���̂悤�ȑ�ӕ�����������p���𖾂��A�l�ނ̌��N�����ɍv�����邱�Ƃ�ړI�Ƃ��܂��B
33�D�Ȋw������⏕���F���ʌ����������
- �ۑ薼�F�W�I�זE�ւ̎_���^�r�^�~��C�̑��B�E��ӂ��\�Ƃ���l�H�g�����X�|�[�^�[�̊J��
- ���ԁF����29�N4���]����32�N3��
- ��\�ҁF�{�V���
- �z�[���y�[�W
�ړI�Ƃ���זE�ɁA�ړI�Ƃ��镨����I��I�ɑ��B�����邱�Ƃ��ł���l�H�g�����X�|�[�^�[���J�����A����p�̏��Ȃ��V�������Ö@���Ă��܂��B
32�DKISTEC-KAST�u�헪�I�����琬���Ɓv
- �ۑ薼�F�u�\�邾���l�H�X���v�̊J��
- ���ԁF����29�N4���]����31�N3��
- ��\�ҁF������
- �z�[���y�[�W
���A�a���Â���т��̍����ǂ̗\�h�ɂ͌��i�Ȍ����Ǘ����K�{�ł����A���҂̐����̎��Ȃ킸�A���S�������I�ɗL���Ȏ��Ö@�͖����m������Ă��܂���B �{�����ł́A�X�}�[�g�Q�������p���������^�̃C���X���������@�\�ƃ}�C�N���j�[�h�����̒�N�P�牺�����Z�p��Z�������u�\�邾���l�H�X���v���J�����܂��B �@�B�ɗ��炸�A�ɂ݂Ȃ��A�����A�g���̂ĉ\�ȋZ�p�ŁA���A�a�ɂ�����A�����b�g���f�B�J���j�[�Y�A���Ȃ킿�A�����I�Ȍ����Ǘ��A�ጌ���̉���A���ҕ��S�̌y���A�̉�����ڎw���܂��B
31�D���Ɏq���c�u��������v
- �ۑ薼�F�C���t���G���U�E�C���X�F����d�C�M���ɕϊ����铱�d�������q�f�o�C�X�̊J��
- ���ԁF����29�N4���]����31�N3��
- ��\�ҁF���c�B�Y
- �z�[���y�[�W
�����̃|�C���g�E�I�u�E�P�A�f�f��O���ɁA�v�����e�B���O�Z�p�Ȃǂ̒�R�X�g����ʐ��Y�\�ȓ��d���L�@�ޗ����J�����A�d�C�I�ȃC���t���G���U�E�C���X���o�������m������B �C���t���G���U�̃^�C�v�ʂ��邽�߂ɁA�E�C���X�̏h��זE�ւ̊����@�\�ɕ킢�A�E�C���X�\�ʂ̃^���p�N���ƑI��I�Ɍ������铜���z����C���������d���L�@�ޗ���V���ɍ�������B �����x�ȃE�C���X���o���������邽�߂ɁA���̓��d���ޗ���p�����L�@�d�C���w�g�����W�X�^�Ȃǂ̃f�o�C�X���쐻���A�E�C���X�F�������̍������ȓd�C�M���ϊ�����������B
30�D�e���������Ȋw�|�p���c�u��ʌ��������P�v
- �ۑ薼�F�X�}�[�g�C���X�����f�o�C�X�ɂ��v�V�I�ȓ��A�a���Ð헪�̊J��
- ���ԁF����28�N4���]����30�N3��
- ���S�ҁF������
- �z�[���y�[�W
�O���R�[�X�Ɏ����I�ɉ�������Q���̋Z�p�V�[�Y�����ƂɁA�V���������̐l�H�X�����J�����A���Ɖ���ڎw���B �d���A���[�^�[�A�}�C�R���A�A���S���Y���A�Z���T�[�A�����̂���������s�v�ƂȂ�����ň��S���ɗD�ꂽ�u�G���N�g���j�N�X�t���[�v�Ȑ��i����A���A�a���҂�QOL�̌����ڎw���B
29�D�Z�R���Ȋw�Z�p�U�����c�u��ʌ��������v
- �ۑ薼�F�X�}�[�g�C���X�����f�o�C�X�ɂ��v�V�I�ȓ��A�a���Ð헪�̊J��
- ���ԁF����28�N4���]����32�N3��
- ���S�ҁF������
- �z�[���y�[�W
�O���R�[�X�Ɏ����I�ɉ�������Q���̋Z�p�V�[�Y�����ƂɁA�V���������̐l�H�X�����J�����A���Ɖ���ڎw���B �d���A���[�^�[�A�}�C�R���A�A���S���Y���A�Z���T�[�A�����̂���������s�v�ƂȂ�����ň��S���ɗD�ꂽ�u�G���N�g���j�N�X�t���[�ȁv���i����A���A�a���҂�QOL�̌����ڎw���B
28�D���ΉȊw�Z�p�U�����c�u��������(A)�v
- �ۑ薼�FpH�������g�����W�X�^�ւ̕��V�זE�ߑ��ɂ���̊����̃��x���t���[����
- ���ԁF����28�N4���]����29�N3��
- ������\�ҁF���c�B�Y
- �z�[���y�[�W
�����̌^�C�I���Z���T�ƍזE��Z�������זE������pH����n�́A�זE���̏�Ԃ����A���^�C���E�����x�ɕ]������V�K�E�Ǝ��ȕ��@�ł���B �{�����ł́A���V�זE��ߑ�����@�\���L�@�E�ʂ��Z���T�\�ʂɍ\�z���A�O���h���ɑ���זE���ߖT�C�I�����ω����זE�Ɖu�����Ƃ��ĕ]������V���ȕ��@�_���J������B
27�D�J�V�I�Ȋw�U�����c�u��{�e�[�}�v
- �ۑ薼�FpH�������d�E���ʃg�����W�X�^�Ɗj�_���������ɂ��j�_����}�[�J�[�̃��x���t���[�d�C�I�v��
- ���ԁF����28�N4���]����29�N3��
- ������\�ҁF���c�B�Y
- �z�[���y�[�W
�d�E���ʃg�����W�X�^�iFET�j��p���āA�|�������[�[�A�������iPCR�j��[�����O�T�[�N�������iRCA�j�Ȃǂ̊j�_���������̐i�s��n�t��pH�ω��Ƃ��Ĕ�W���E�d�C�I�Ɍv��������@���J������B
26�D���{��Ì����J���@�\�iAMED�j�F�u�Y�w�A�g��ÃC�m�x�[�V�����n�o�v���O�����iACT-M�j�v
- �ۑ薼�F������^�̐l�H�X���ɂ��v�V�I�ȓ��A�a���Ë@��̊J��
- ���ԁF����27�N10���]
- ������\�ҁF������
- �z�[���y�[�W
�O���R�[�X�Ɏ����I�ɉ�������Q���̋Z�p�V�[�Y�����ƂɁA�V���������̐l�H�X�����J�����A���Ɖ���ڎw���B �d���A���[�^�[�A�}�C�R���A�A���S���Y���A�Z���T�[�A�����̂���������s�v�ƂȂ�����ň��S���ɗD�ꂽ�u�G���N�g���j�N�X�t���[�ȁv���i����A ���A�a���҂�QOL�̌����ڎw���B
25�D�Ȋw������⏕���F��茤��(B)
- �ۑ薼�F�����z��ᇍזE�Z���V���O���s���}�C�N�����̃f�o�C�X�̊J��
- ���ԁF����27�N4���]����30�N3��
- ������\�ҁF�c�����K
- �z�[���y�[�W
�����x�d�ʌv���o�C�I�Z���T�ɂ�茌���z��ᇍזE�iCirculating Tumor Cells: CTC�j�̕������o�Ɗj�_��͂��s�����^�E���^�f�o�C�X�̑n���Ɋւ��錤�����s���B ��ᇍזE�\�ʂ̃V�A���_�����ʂ̈Ⴂ�y�т��̒��Ɋ܂܂��j�_�̉�͂��s�����Ƃɂ��A����̑����f�f�f�o�C�X�̑n����ڎw���ƂƂ��ɁACTC�Ɋւ���V���Ȑ����@�\��T������B
24�D�Ȋw������⏕���F���ʌ����������
- �ۑ薼�F�}�C�N��RNA/�G�N�\�\�[���̔�W�����o�ɂ��ȈՌ^����f�f�f�o�C�X�̊J��
- ���ԁF����27�N4���]����30�N3��
- ������\�ҁF�c�����K
- �z�[���y�[�W
�G�N�\�\�[���f�f��microRNA��͂��s������f�f�f�o�C�X�̑n���Ɋւ��錤�����s���B �G�N�\�\�[�����\�ʂ̃V�A���_�����ʂ̈Ⴂ�A�y�т��̒��Ɋ܂܂��miRNA�̉�͂��s�����Ƃɂ�肪��L���̔��f����т��̕��ʓ���\�Ȑf�f�f�o�C�X�̑n����ڎw���B
23�D�L���m�����c�F���������v���O�����u�Y�Ɗ�Ղ̑n���v
- �ۑ薼�F�������������q�Q���ɂ��C���e���W�F���g�^�l�H�X���̊J��
- ���ԁF����27�N4���]����29�N3��
- ������\�ҁF������
- �z�[���y�[�W
22�D�Ȋw������⏕���F��Ռ���(C)
- �ۑ薼�F�o�C�I�g�����W�X�^�ɂ��^���p�N���|���C���̓d�C�I���o
- ���ԁF����27�N4���]����30�N3��
- ������\�ҁF���c�B�Y
- �z�[���y�[�W
���q�F���ɂƂ��Ȃ��d�ז��x�ω��ڌ��o����u�o�C�I�g�����W�X�^�v��p���āA�������ۂɐ[���ւ��^���p�N���̖|���C����d�C�I�Ɍ��o�����@���J������B �{��@�͌u���W����d�C���w�W����p���Ȃ����x���t���[���o�ł���A���͎��Ԃ̒Z�k�E��R�X�g���E���u�̏��^���E���X���[�v�b�g�����������A�|���C���̃|�C���g��I�u��P�A�f�f���u������B
21�D���ΉȊw�Z�p�U�����c�u��������(A)�v
- �ۑ薼�F�E�����̖Ɖu�w�I�@���Ɋւ���d�C���w�v���V�X�e���̑n��
- ���ԁF����27�N4���]����28�N3��
- ������\�ҁF�c�����K
- �z�[���y�[�W
20�D�o�t�d�q�L�O���c�u���R�Ȋw���������v
- �ۑ薼�F���d�������q��p�����L�@�o�C�I�G���N�g���j�N�X�ɂ��E�C���X�̓��ٓI���x���t���[���o
- ���ԁF����27�N4���]����28�N3��
- ������\�ҁF���c�B�Y
- �z�[���y�[�W
�X�}�[�g�t�H�����Ɏ������ă|�C���g�E�I�u�E�P�A�f�f���\�ȉ��^�̃E�C���X���o�@�̊J����ڎw���B�L�@�g�����W�X�^�Ȃǂ̓��d���L�@�ޗ��f�o�C�X�ɂ�錟�o�͌��w�n��p���Ȃ��d�C�I��@�ł��邽�ߑ��u�̏��^���E�����ɓK����B
19�D���J��H�v���Z�p�U�����c�u�J�����������v
- �ۑ薼�F�זE�g�����W�X�^��p�����זE���i�m��E�`���̌v��
- ���ԁF����27�N4���]����28�N3��
- ������\�ҁF���c�B�Y
- �z�[���y�[�W
��`�q������זE�����B�Ȃǐ�i���Â̍ۂɁA�������q���߂��������ŁA�זE�����g�ɑ����Q���ʕ]������K�v������B �|�{�זE�ƃg�����W�X�^��g�ݍ��킹�āA�����̐Ԍ����n���������ő���ł��Ȃ����q��6���ȉ��E���a10nm�ȉ��̕��������߂ł���i�m��E�̌`�����A�����j�A���t�������̐��f�C�I���̖����ߓx�Ƃ��đ��肷��B
18�D�����Ȋw�ȁF��w���V�Y�Ƒn�o���_�v���W�F�N�g�iSTART�j�i�v���W�F�N�g�x���^�j
- �ۑ薼�F���A�a���҂�QOL(�����̎�)�����ڎw�����G���N�g���j�N�X�t���[�Ȑl�H�X���̊J��
- ���ԁF����26�N11���]
- ������\�ҁF������
- �z�[���y�[�W
�O���R�[�X�Ɏ����I�ɉ�������Q���̋Z�p�V�[�Y�����ƂɁA�V���������̐l�H�X�����J�����A���Ɖ���ڎw���B �d���A���[�^�[�A�}�C�R���A�A���S���Y���A�Z���T�[�A�����̂���������s�v�ƂȂ�����ň��S���ɗD�ꂽ�u�G���N�g���j�N�X�t���[�ȁv���i����A ���A�a���҂�QOL�̌����ڎw���B
17�D���t�{�F�v�V�I�����J�����i�v���O����(ImPACT)
- �ۑ薼�F�i������ɔ��ʕ����̒��v�������ڃZ���V���O�V�X�e��
- ���ԁF����26�N10���]
- �����J���ӔC�ҁF�{���T��
- �z�[���y�[�W
�N�������₩�ʼn��K�Ȑ������������邽�߂ɁA�g�̉��̗L�Q�E�댯��������g�����ȕւŌ��ʓI�ȕ��@���������̗D�ꂽ�����\�͂��z���钴���׃G���N�g���j�N�X�Ŏ������܂��B �L�Q�E�댯���X�N��v���E�ȕւɌ��m���A���S�E���S�������ł���Љ���������܂��B
16�DSTARC��w���������@IS�v���O����
- �ۑ薼�F������ړI�Ƃ������^�E���^�G�N�\�\�[���Z���V���O�o�C�I�Z���T�̑n��
- ���ԁF����26�N8���]����27�N7��
- ������\�ҁF�{���T��
- �z�[���y�[�W
�d�E���ʃg�����W�X�^(Field Effect Transistor: FET)�̓��쌴���Ɋ�Â��o�C�I�g�����W�X�^����ѐ����U���q�}�C�N���o�����X(Quarts Crystal Microbalance: QCM)��g�ݍ��킹������`�b�v�ɂ�铯�����o���u��p���āA �����v���Ɍ������邽�߂̃G�N�\�\�[�������microRNA��͂��Ă���B����̑��������Ɍq���錒�f�E������f�������コ���邽�߁A�܂��p��̗\��Ǘ����ʓI�ɍs���Ĕ��Ȃǂ̕a���I�m�ɔ��f���邽�߂ɂ́A ���҂ɕ��S�⎞�Ԃ������邱�ƂȂ��g�߂̐f�Ï���ݑ�ŁA�����x�E�����x�ɂ���}�[�J�[�����o�ł���{��Ă̂悤�ȏ��^�ŊȈՂȃo�C�I�Z���T���J�����L���ł���ƍl������B
15�D�Ȋw������⏕���F��茤��(A)
- �ۑ薼�F�{�����_�𗘗p�����V�K�C�I���V�[�P���V���O�@�̊J��
- ���ԁF����26�N�x�]����28�N�x
- ������\�ҁF������
- �����N
�u�s���W���{�����_?�s�������_�ԂŐ�������ٓI���t�I�ȋ��L�����v�q�@���Ƃ���V���ȃC�I�����o������DNA�z���͋Z�p�̌����ؖ���ړI�Ƃ���B �]���̃v���g�����o�����V�[�P���T�́A���Ɂu1000�h���Q�m���v���蒆�Ɏ��߂��邪�A������A�y�f�����ɕs���Ȓ�ɏՔ\�n�t���g�p����K�v������A1����������̓ǂݎ�艖���200���x�ɂƂǂ܂�B DNA�|�������[�[�ɂ�鑊�⍽���������ɂ����āA�v���g�����l�Ɉꕪ�q��������s�������_�𑨂���A�v���[�`���Ƃ邱�ƂŁA���ɏՔ\�n�t���ł̍y�f���������e���A�ǂݎ�艖��̌��I�ȉ��P��}��B DNA�V�[�P���T�̍X�Ȃ鏈�����x�̌���ƒቿ�i�����������������Ă��A����ׂ��g�|�X�g�Q�m���h��g�e�[���[���[�h��Áh�̎����ɍv������B
14�D�V�w�p�̈�i���匤���j�F�u�i�m���f�B�V�����q�Ȋw�v
- �ۑ薼�F�C�I���������d�E���ʃg�����W�X�^�ɂ��i�m�זE�Ő��ƃi�m���f�B�V���̕]��
- ���ԁF����26�N�x�]����27�N�x
- ��S�������ҁF���c�B�Y
- �z�[���y�[�W
�זE�E�o�C�I�~���e�B�b�N�X�E�ʁE���x���t���[�^�Z���T�[��Z�������A�זE���ߖT�������ł̐��̕��q�������@�\�������x�E�����x�ɉ�͂��邱�Ƃɂ��A �Ȋw�p�����[�^��p�����זE�Ő���זE�a�Ԃ̓���I��ʕ]���������Ȃ��A���̂̃V�X�e�������ꂽ���I�ȉ����@�\�q���x���ʼn𖾂��邱�Ƃ�ړI�Ƃ���B �o�C�I�~���e�B�b�N�X�H�w�ƍ����x�o�C�I�Z���V���O��Z�����A����ȍזE����������l�H�I�ɍč\�z���A���̓��ł̋Ǐ��I�ȕω����������Ƃ��镪�q�������@�\�̕������w�I�p�����[�^�𖾂炩�ɂ���B�܂��A��L�̋Z�p��p���āA��`�q���B�L�����A�Ȃǂ̃i�m�ޗ��̍זE���ʉߋ@�\�⎡�Ì��ʁE�זE����Q�����ʓI�ɉ�͂���B ��i���Âɂނ����זE���������ł̐��̕��q���Ԃ̗����ƁA�i�m��Âɔ����זE�Ő��E���Ì��ʂ̕��q�Ȋw���\�z���A�����I�Ȉ�ÃC�m�x�[�V�����Ɍ������b���\�z����B
13�D���v���c�@�l���J��H�v���Z�p�U�����c�F���㌤��
�d�E���ʃg�����W�X�^�̌�����p�����������x�d�ʌv���o�C�I�Z���T�ɂ��G�N�\�\�[���f�f��microRNA��͂��s�����^�E���^�f�o�C�X�̑n���Ɋւ��錤�����s���B �G�N�\�\�[�����\�ʂ̃V�A���_�����ʂ̈Ⴂ�A�y�т��̒��Ɋ܂܂��microRNA�̉�͂��s�����Ƃɂ�肪��̑����f�f�f�o�C�X�̑n����ڎw���ƂƂ��ɁA�G�N�\�\�[���Ɋւ���V���Ȑ����@�\��T������B
12�D�v�V�I�C�m�x�[�V�����n�o�v���O�����iCOI STREAM�j�F�u�X�}�[�g���C�t�P�A�Љ�ւ̕ϊv��擱������̂Â���I�[�v���C�m�x�[�V�������_�iCOINS�j�v
- �ۑ薼�F�T�u�e�[�}4�F�̌��s�v�̍ݑ��f�f�V�X�e��
- ���ԁF����25�N�x�]
- �����J���S���ҁF�{���T��
- �z�[���y�[�W
���ł��E�ǂ��ł��E�N�ł��A�S���I�E�g�̓I�E�o�ϓI���S�Ȃ��A�Љ�I���ׂ̑傫����������������Ă������ƂŁA�����I�Ɍ��N�ɂȂ��Ă����Љ�i�X�}�[�g���C�t�P�A�Љ�j���������邱�Ƃł��B �����ŁA����܂�SF �̐��E�ł�������邱�Ƃ̂Ȃ������u�̓��̔���������������E�C���X�T�C�Y�i�` 50nm �j�̃X�}�[�g�i�m�}�V���v���A�f�f�Ǝ��ÂɕK�v�ȗv�f�Z�p�����炩���ߍ�荞�@�\���q�i���S���q�j�̎�����ɂ���đn�����A�l�̓��́u�K�v�ȏꏊ�ŁE�K�v�Ȏ��ɁE�K�v�Ȑf�f�Ǝ��Áv���s���u�̓��a�@�v�̍\�z��ڎw���܂��B
11�D�Ȋw������⏕���F����I�G�茤��
- �ۑ薼�F�X�}�[�g�Q���𗘗p�������S�����^�́g�l�H�X���h�̑n��
- ���ԁF����25�N�x�]����26�N�x
- ������\�ҁF������
- �����N
�{��ẮA�C���X�����ˑ��^�iI �^�j���A�a��ΏۂƂ��A�Ò��j�܂��͑}���`���[�u�̐�[�����̈�ɃQ����z����݂̂̋ɂ߂ĒP���ȍ\���Ƃ����C���e���W�F���g�^�̃C���X���������f�o�C�X �̊J���Ƃ��̋@�\����ړI�Ƃ���B�g�p�`�ԂƂ��Ă͊����̃C���X�����|���v�����ɏ����Ȃ�����A�d���A���[�^�[�A�}�C�R���A�A���S���Y���Ȃǂ�������� �s�v�Ƃ��A�ޗ����̂́g�A���I�ȃt�B�[�h�o�b�N�@�\�h�ɂ���āA���Ì��ʂƈ��S���̂����ł������Z�p�𗽉킷����̂��\�z����B
10�D�Ȋw������⏕���F��茤��(B)
- �ۑ薼�F�����x��`�q�g�����W�X�^�ɂ�钷������z���͂�ڎw�����@�\���E�ʃQ�[�g�̍\�z
- ���ԁF����25�N�x�]����27�N�x
- ������\�ҁF�O����
- �����N
�{�����ł́A�d�E���ʃg�����W�X�^�̌�����p�����d�C���w�I����ɂ��DNA�V�[�P���V���O�Z�p���x�[�X�ɁA���݂��̃V�X�e������������̈�ł���DNA�ǂݎ�艖��̉��P�ɏœ_���i��A�g�����W�X�^�Q�[�g�\�ʂ̓O��I�ȑ��荞�݂ɂ���āA�V������@�Ɋ�Â�FET�^DNA�V�[�P���T���J�����鎖��ړI�Ƃ���B
9�D�Ȋw������⏕���F��茤��(B)
- �ۑ薼�F�������x�d�ʌv���o�C�I�Z���T�[�ɂ��זE���i�^���p�N�����Ԃ̃��j�^�����O
- ���ԁF����25�N�x�]����27�N�x
- ������\�ҁF�O�c�N�O
- �����N
�������x�d�ʌv���o�C�I�Z���T�[�ɂ��זE���i�^���p�N�����Ԃ̃��j�^�����O�Ɋւ��錤�����s���D�]���̌u���C���[�W���O�Ɉˑ������^���p�N�����Ԋώ@����E�p���C�v���e�I�~�N�X��́C���q���[�^�[����т��̏W�ω������^���f�q�̉^���@�\�𖾂̂��߂̐V���ȃv���b�g�t�H�[�������D
8�D�V�w�p�̈�i���匤���j�F�u�i�m���f�B�V�����q�Ȋw�v
- �ۑ薼�F�C�I���������d�E���ʃg�����W�X�^�ɂ��i�m�זE�Ő��ƃi�m���f�B�V���̕]��
- ���ԁF����24�N�x�]����25�N�x
- ��S�������ҁF���c�B�Y
- �z�[���y�[�W
- H25�N�x��������
- H24�N�x��������
�o�C�I�G���N�g���j�N�X�Z�p��p���āA�זE�E�@�\���i�m�ޗ��E�����̃f�o�C�X��Z�������A�זE�ƃi�m�ޗ��Ƃ̑��ݍ�p�������x�E�����x�ɕ]�����邱�Ƃɂ��A�i�m�זE�Ő��̈�`�I�]���A�זE�a�ԁE���Ì��ʁE�\��f�f���Ȋw�p�����[�^�ɂ�蓝��I�ɕ]�����邱�Ƃ�ړI�Ƃ��܂��B �i�m�ޗ��̍זE���ʉߋ@�\�A�e��I���K�l���ł̐����w�����ɑ���זE���O�ł̃C�I�����x�̊W��A���d�׃i�m�ޗ����זE���Ɍ`������ꎞ�I�ȃi�m�|�A�������炷�זE�Ő����ʓI�E��`�I�ɕ]�����A�j�_��̃L�����A�ł���e��i�m�}�e���A���̍זE�����B�̕��q���J�j�Y����A �זE���A���ɂƂ��Ȃ��זE�Ő��U�N�̕��q�Ȋw�ȂǁA�i�m���f�B�V���̂��߂̕��q�Ȋw���\�z���A�����I�ȍ��X���[�v�b�g��܃X�N���[�j���O�ւ̉��p��A���������̑�֕]���Z�p�̑b���\�z���܂��B
7�D���{�w�p�U����F�Ԍ𗬎��Ɓi���������j
- �ۑ薼�F�����r�[�Y�[�U�^�}�C�N�����H��p�����ʎq�h�b�g�W��DNA�̓d�C���w�I���o
- ���ԁF����24�N�x�]����25�N�x
- �匤���ҁF���c�B�Y
- �z�[���y�[�W
�|�C���g�I�u�P�A�f�f���\�ɂ��鎟����^�|�[�^�u���Z���T�[�̊J����ڎw���A�d�C���w�ƃo�C�I�G���N�g���j�N�X�Ɋ�Â����������E�����E�����̓������o�^��DNA �A�b�Z�C�t�H�[�}�b�g���`�b�v��ɍ\�z���܂��B ����܂ŗʎq�h�b�g�͌��ސF�̏��Ȃ��u���g���[�T�[�Ƃ��Ď�ɒ��ڂ���Ă��܂������A�V���� �ʎq�h�b�g�̔����̃i�m���q�Ƃ��Ă̓d�C���w�I�Ȑ����ɒ��ڂ��A�����x���o�\�ȃ|�C���g�I�u�P�A���u�Ƃ��ĉ��p���܂��B
6�D���{�w�p�U����F���]�z�����������茤���Ґ헪�I�C�O�h���v���O����
- �ۑ薼�F�o�N�e���A�����Ɋւ��鋤�������ɂ��㎕�H�Z������̍��ۓI��胊�[�_�[�̈琬
- ���ԁF����23�N�x�]����25�N�x
- ��S�������ҁF�{���T��
- �z�[���y�[�W
������Ȏ��ȑ�w�E���̍ޗ��H�w�������̎�茤���҂��X�E�F�[�f���̃J�������X�J�������ɔh�����āA���ۊ��o�̏�����}��ƂƂ��ɁAProf. Agneta Richter-Dahlfors�Ƃ̋��������������I�ɐ��i���A��茤���ғ��m�̌𗬂�ʂ��Ē����I�ȋ��͊W���m�����܂��B �h����̃J�������X�J�������́A��w�n�̒P�ȋ��猤���@�ւƂ��Ă͐��E�ōő�ł���A�m�[�x���܂̐����w��w����̑I�l�ψ������܂��B ���ۋ��������ł́AHIV�ASARS���͂��߂Ƃ��銴���ǂ̐f�f�@�A���Ö@�A�\�h�@�̌����E��̉����Ɍ����čŐV�̌������ʂ���і��_�����L�����A�����̌����̊�ՂƂȂ銴���v���Z�X�̕��q���J�j�Y���Ɋւ��Đ����w�I������[�߂邱�Ƃ�ړI�Ƃ��܂��B �{�v���O�����ɂ��A��茤���҂��㎕�H�Z������̍��ۓI���[�_�[�Ƃ��āA�C�O�̌����҂Ƌ��͂��Ĉ㎕�H�Z������W�����A����ɐV����������J�Ă����d�g�݂̊�Ղ��\�z���܂��B
5�D�Ȋw������⏕���F��茤��(B)
- �ۑ薼�F�j�_�A�v�^�}�[��p�����������x�d�ʌv���o�C�I�Z���T�[�ɂ���ᇃ}�[�J�[���o
- ���ԁF����23�N�x�]����25�N�x
- ������\�ҁF���c�B�Y
- �����N
�d�E���ʃg�����W�X�^(FET: Field Effect Transistor)�̌����ɂ�郉�x���t���[�ō����x�ȓd�C���w�v���Z�p�����p���āA�j�_�A�v�^�}�[��p�����������x�d�ʌv���o�C�I�Z���T�[�ɂ���ᇃ}�[�J�[���o�Ɋւ��錤���������Ȃ��܂��B ���ɂ܂���ᇃ}�[�J�[�^���p�N���̌��o���ȈՁE�v������R�X�g�ɒB�������ՋZ�p����邱�ƂŁA�]���̃C���m�A�b�Z�C�ɑ��钴�����x�^���p�N���Z���V���O�A�v���e�I�~�b�N�X��́A�|���C����͂̂��߂̐V���ȃv���b�g�t�H�[������܂��B �{�����œ������ՋZ�p�́A�䂪���̎�����P�ʂł�����̐f�f�ւ̓W�J�������܂�A��ÃV�X�e���̃C�m�x�[�V�����ɂȂ��Ă������Ƃ��\�ł��B
4�D�Ȋw������⏕���F��茤��(A)
- �ۑ薼�F������^�A�|�g�[�V�X�p�X�E�F�C��͂̂��߂̏W�ω��y�f�����v���g�����W�X�^�̑n��
- ���ԁF����23�N�x�]����25�N�x
- ������\�ҁF������
- �����N
�{�����ł́A�d�E���ʃg�����W�X�^�𗘗p���A�זE���y�f�����������ɒ�ʂ��邱�Ƃ̂ł���W�ω��v���f�o�C�X���J�����܂��B �A�|�g�[�V�X�U���Ɋւ��V�O�i���`�B�̒��j��S���y�f���^�[�Q�b�g�Ƃ��A�����̎��n��I�Ȓ�ʂɊ�Â��A�|�g�[�V�X�p�X�E�F�C��͖@���J�����܂��B �d�E���ʃg�����W�X�^�̒������������A�A�|�g�[�V�X�ɂ�����p�X�E�F�C��͂��]�������ȕցA�v������R�X�g�ɒB������c�[������邱�ƂŁA�i�i�ɍ������Ȗ��J�j�Y����͂�n��^�[�Q�b�g�̍i�荞�ݕ]�����\�Ƃ���u�v�V�I�Ȉ��i�J���v���b�g�t�H�[���v���Ă��܂��B
3�D�Ő�[�����J���x���v���O�����iFIRST�v���O�����j�F�u�i�m�o�C�I�e�N�m���W�[���擱����f�f�E���ÃC�m�x�[�V�����v�v���W�F�N�g
- �ۑ薼�F�j�_����z���̓f�o�C�X�̌���
- ���ԁF����21�N�x�]����25�N�x
- �����O���[�v�F�T�u�e�[�}I �i�m�f�f�V�X�e���̑n��
- ������ĎҁF�{���T��
- �z�[���y�[�W
�{�v���W�F�N�g�ł́u����v���͂��߂Ƃ����a�̒������f�f���獪�{���ÂɎ���܂ł��N�P���V�[�����X�Ɏ������鐸���f�f�E���ÃV�X�e�����\�z��ڎw���܂��B �����f�f�̂��߂̌����}�[�J�[�̐v���E�����x�v���f�o�C�X�Z�p���m�����邱�Ƃɂ��A�ȈՌ^�v���f�f�@�̊m���ɂ�邪�S���ቺ�A�����V�X�e���̌������A�ʉ@�R�X�g�팸�A�n��i�������ɍv�����܂��B �܂��A�J�����ꂽ�Z�p�E���i�̐v���ȎЉ�Ҍ��Ɍ��������������H���邾���łȂ��A��[�i�m�e�N�m���W�[�����p�������i�E��Ë@��̐��E�I�Ȍ����J�������܂��A���̐��i������Ô���ÁE�Љ�V�X�e���S�̂ɋy�ڂ��e�����ʉ������鐸�k�ȕ]���n�̍\�z���s���܂��B ��X�́u�����f�f�̂��߂̌����}�[�J�[�̐v���E�����x�v���f�o�C�X�Z�p�̊m���v��ڕW�Ƃ��A�ȈՌ^�v���f�f�@�̊m���ɂ�邪�S���ቺ�A�����V�X�e���̌������A�ʉ@�R�X�g�팸�A�n��i�������ɍv�����܂��B

2�D�V�w�p�̈�i�̈��Č^�j�F�u�\�t�g�C���^�[�t�F�[�X�̕��q�Ȋw�v
- �ۑ薼�F������/���̕��q�i�m�E�ʂ̍\�z�ƈ�`�q�g�����W�X�^�ւ̉��p
- ���ԁF����20�N�x�]����24�N�x
- �v�挤���ҁF�{���T��
- �z�[���y�[�W
- H23�N�x��������
- H22�N�x��������
- H21�N�x��������
- H20�N�x��������
�d�E���ʃf�o�C�X��p���A���o���ƂȂ�Q�[�g�≏���\�ʂɍ����q�Q���������\�z���A���q�F�������ɔ����Q���̕������w�I�p�����[�^�̕ω������o����V�����T�O�Ɋ�Â��o�C�I�g�����W�X�^�̌����𐄐i���܂��B �{�f�o�C�X�́A�u�����q�̂悤�ȕW����K�v�Ƃ����A���q�F����������U�Q���̕������w�I�p�����[�^�̕ω��ɕϊ����A���̕������w�I�p�����[�^�ω���d�E���ʂœd�C�V�O�i���Ƃ��Č��o���܂��B �g�����W�X�^�̃Q�[�g�\�ʂɁA�����q�Q���ɂ�铮�I�E�ʁA�U�d���ω��Ȃǂ̐V�����T�O�����A���̕��q�F������P�����J�j�J���M�����o�ēd�C�M���Ɏ���M���ϊ��̋@�\�A���̕��q�F���ɂ�铮�I�E�ʃ_�C�i�~�N�X�A�����q�Q���\���E�ޗ��̐�����q�Ȃǂ𖾂炩�ɂ��邱�Ƃ�ړI�Ƃ��܂��B
References
- T. Goda et al., Sensors, 2013, 13, 2267. Check
- T. Goda et al., Langmuir, 2012, 28, 14730. Check
- Y. Maeda et al., Nanoscale Res. Lett., 2012, 7, 108. Check
1�D�헪�I�n�����i����CREST�F�v���Z�X�C���e�O���[�V�����ɂ�鎟����i�m�V�X�e���̑n��
- �ۑ薼�F�@�\���i�m�\���Q�[�g�o�C�I�g�����W�X�^�̑n��
- ���ԁF����20�N�x�]����25�N�x
- ������\�ҁF�{���T��
- �z�[���y�[�W
- H23�N�x�V���|�W�E���u���v�|
- H24�N�x��������
- H23�N�x��������
- H22�N�x��������
- H21�N�x��������
- H20�N�x��������
�{�����ł͐��̍ޗ��^�@�\�����q�^�����̂���Ȃ镡���Q�[�g�\�����\�z���A�َ�ޗ��Ԃɂ�����E�ʃi�m�\���𐧌䂷�邱�Ƃɂ��A���̕��q�F���y�эזE�@�\�̔����ߒ���d�C�M���ɕϊ�����o�C�I�g�����W�X�^��n�����܂��B �o�C�I�g�����W�X�^�̓d�ʉ����ɂ̓Q�[�g�^�n�t�E�ʂ̓d�C��d�w�iDebye���j���d�v�Ȗ����������Ă��邽�߁A�{�����ł̓Q�[�g��L�@���q��̍ޗ��Ȃǂ̃\�t�g�}�e���A���ō\�����A�e�E�ʂɂ�����d�C���w�I�ȐM���ϊ��̕��q�@�\����͂��邱�Ƃɂ��A���̕��q�F����זE������Ód�I���ݍ�p�ɂ���W���E��N�P�Ō��o���܂��B �o�C�I�g�����W�X�^�̓��쌴���ƃf�o�C�X�@�\�̌�����ʂ��āA�\�t�g�^�n�[�h�ޗ��̃i�m�E�ʂɊւ��ĐV���Ȓm����~�ς��A���ɓd�C���w�I�ϓ_���琶�̕��q�A�זE�@�\�����ʓI�ɔ����E���o���邽�߂̍ޗ��v�w�j��Ƌ��ɁA�o�C�I�e�N�m���W�[�ƃG���N�g���j�N�X��Z������V���ȗ̈�̊J���ڎw���܂��B
References