A01-3


研究概要
遺伝情報を格納する核は外膜と内膜からなる二重の膜構造で覆われている。核外膜は核を覆うように存在する小胞体膜と連続している。一方、内膜にはそれを構成する多くのタンパク質が含まれ、これらは小胞体で合成された後、外膜と連結する核膜孔をつたわって内膜に移動してくる。すなわち、核の内外膜は小胞体膜と連続した構造を形成しており、様々な分子が行き交う構造的・機能的連携ゾーンといえる。しかしこれまで核膜を構成する分子群がどのように小胞体で作られ、必要な分子が選別されて核膜のしかるべき部位に移動するのかその詳細なメカニズムは明らかにされていない。またDNA損傷をはじめ核で起こった各種のイベントに対し核膜を介して連結している小胞体がどのように応答し核と連携して核内事象を制御しているのか謎が多い。
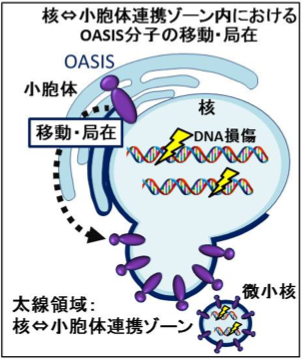 計画研究代表者は、小胞体膜タンパク質OASISがDNA損傷時に小胞体膜から核膜のごく一部の領域に集積する現象を見出した。OASISが集積した核膜部位はやがて発芽して微小核を形成し損傷を受けたDNA断片を搭載して核から切り離される。このような一連の小胞体膜タンパク質のダイナミックな動態は損傷したDNAの修復に必要不可欠であり、OASISが欠損した細胞ではDNA損傷が増強され細胞に致死的な傷害を与える。このような研究成果を踏まえ、本計画研究では、小胞体膜タンパク質OASISが小胞体から核膜の一部あるいは微小核に移動する領域を核⇔小胞体連携ゾーンと定義する。そして、小胞体膜タンパク質OASISによるDNA損傷応答を核⇔小胞体連携ゾーンのモデル系として捉え、(1)OASISの小胞体から核への移行メカニズムや(2)微小核形成を介した損傷DNA排出機構に迫る。OASISモデル系で得られた情報を有効活用し、核⇔小胞体連携ゾーンを構成する分子群の同定やゾーン形成の時空間的制御機構、さらにはゾーンの生理機能解析を実施することで核⇔小胞体連携ゾーンの実体を解き明かす。
計画研究代表者は、小胞体膜タンパク質OASISがDNA損傷時に小胞体膜から核膜のごく一部の領域に集積する現象を見出した。OASISが集積した核膜部位はやがて発芽して微小核を形成し損傷を受けたDNA断片を搭載して核から切り離される。このような一連の小胞体膜タンパク質のダイナミックな動態は損傷したDNAの修復に必要不可欠であり、OASISが欠損した細胞ではDNA損傷が増強され細胞に致死的な傷害を与える。このような研究成果を踏まえ、本計画研究では、小胞体膜タンパク質OASISが小胞体から核膜の一部あるいは微小核に移動する領域を核⇔小胞体連携ゾーンと定義する。そして、小胞体膜タンパク質OASISによるDNA損傷応答を核⇔小胞体連携ゾーンのモデル系として捉え、(1)OASISの小胞体から核への移行メカニズムや(2)微小核形成を介した損傷DNA排出機構に迫る。OASISモデル系で得られた情報を有効活用し、核⇔小胞体連携ゾーンを構成する分子群の同定やゾーン形成の時空間的制御機構、さらにはゾーンの生理機能解析を実施することで核⇔小胞体連携ゾーンの実体を解き明かす。
代表的な原著論文
研究代表者(今泉和則)
- Ohtake Y, Matsuhisa K, Kaneko M, Kanemoto S, Asada R, Imaizumi K, and Saito A. (2018) Axonal Activation of the Unfolded Protein Response Promotes Axonal Regeneration Following Peripheral Nerve Injury. Neuroscience, 375:34-48.
- Wu Y, Guo XP, Kanemoto S, Maeoka Y, Saito A, Asada R, Matsuhisa K, Ohtake Y, Imaizumi K, and Kaneko M. (2018) Sec16A, a key protein in COPII vesicle formation, regulates the stability and localization of the novel ubiquitin ligase RNF183. Plos One, 13: e0190407.
- Saito A, Cai L, Matsuhisa K, Ohtake Y, Kaneko M, Kanemoto S, Asada R, Imaizumi K. (2017) Neuronal activity-dependent local activation of dendritic unfolded protein response promotes expression of brain-derived neurotrophic factor in cell soma, Journal of Neurochemistry, 144:35-49.
- Cui, X., Cui, M., Asada, R., Kanemoto, S., Saito, A., Matsuhisa, K., Kaneko, M., and Imaizumi, K. (2016) The androgen-induced protein AIbZIP facilitates proliferation of prostate cancer cells through downregulation of p21 expression. Sci. Rep. 6, 37310
- Kanemoto, S., Kobayashi, Y., Yamashita, T., Miyamoto, T., Cui, M., Asada, R., Cui, X., Hino, K., Kaneko, M., Takai, T., Matsuhisa, K., Takahashi, N., and Imaizumi, K. (2015) Luman, an ER membrane-bound transcription factor, is involved in osteoclastogenesis through the regulation of DC-STAMP expression, stability and localization. J. Cell Sci. 128, 4353-4365
- Saito, A., Kanemoto, S., Zhang, Y., Asada, R., Hino, K., and Imaizumi, K. (2014) Chondrocyte Proliferation Regulated by Secreted Luminal Domain of ER Stress Transducer BBF2H7/CREB3L2. Mol. Cell 53, 127-139
- Hino, K., Saito, A., Kido, M., Kanemoto, S., Asada, R., Takai, T., Cui, M., Cui, X., and Imaizumi, K. (2014) Master Regulator for Chondrogenesis, Sox9, Regulates Transcriptional Activation of the ER Stress Transducer BBF2H7/CREB3L2 in Chondrocytes. J. Biol. Chem. 289, 13810-13820
- Saito, A., Kanemoto, S., Kawasaki, N., Asada, R., Iwamoto, H., Oki, M., Miyagi, H., Izumi, S., Sanosaka, T., Nakashima, K., and Imaizumi, K. (2012) Unfolded protein response, activated by OASIS family transcription factors, promotes astrocyte differentiation. Nature Commun. 3, 967
- Kondo, S., Hino, S., Saito, A., Kanemoto, S., Kawasaki, N., Asada, R., Izumi, S., Iwamoto, H., Oki, M., Miyagi, H., Kaneko, M., Nomura, Y., Urano, F., and Imaizumi, K. (2012) Activation of OASIS family, ER stress transducers, is dependent on its stabilization. Cell Death Differ. 19, 1939-1949
- Murakami, T., Saito, A., Hino, S-I., Kondo, S., Kanemoto, S., Chihara, K., Sekiya, H., Tsumagari, K., Ochiai, K., Yoshinaga, K., Saitoh, M., Nishimura, R., Yoneda, T., Kou, I., Furuichi, T., Ikegawa, S., Ikawa, M., Okabe, M., Wanaka, A., and Imaizumi, K. (2009) Signalling mediated by the endoplasmic reticulum stress transducer OASIS is involved in bone formation. Nature Cell Biol. 11, 1205-1211
- Saito, A., Hino, S., Murakami, T., Kanemoto, S., Kondo, S., Saitoh, M., Nishimura, R., Yoneda, T., Furuichi, T., Ikegawa, S., Ikawa, M., Okabe, M., and Imaizumi, K. (2009) Regulation of endoplasmic reticulum stress response by the BBF2H7-mediated Sec23a pathway is essential for chondrogenesis. Nature Cell Biol. 11, 1197-1204
- Ogata, M., Hino, S., Saito, A., Morikawa, K., Kondo, S., Kanemoto, S., Murakami, T., Taniguchi, M., Tanii, I., Yoshinaga, K., Shiosaka, S., Hammarback, J.A., Urano, F., and Imaizumi, K. (2006) Autophagy is activated for cell survival after endoplasmic reticulum stress. Mol. Cell. Biol. 26, 9220-9231
- Kondo, S., Murakami, T., Tatsumi, K., Ogata, M., Kanemoto, S., Otori, K., Iseki, K., Wanaka, A., and Imaizumi, K. (2005) OASIS, a CREB/ATF-family member, modulates UPR signalling in astrocytes. Nature Cell Biol. 7, 186-194
研究分担者(金子雅幸)
- Kaneko, M., Iwase, I., Yamasaki, Y., Takai, T., Wu, Y., Kanemoto, S., Matsuhisa, K., Asada, R., Okuma, Y., Watanabe, T., Imaizumi, K., and Nomura, Y. (2016) Genome-wide identification and gene expression profiling of ubiquitin ligases for endoplasmic reticulum protein degradation. Sci. Rep. 6, 30955
- Saito, R., Kaneko, M., Kitamura, Y., Takata, K., Kawada, K., Okuma, Y., and Nomura, Y. (2014) Effects of Oxidative Stress on the Solubility of HRD1, a Ubiquitin Ligase Implicated in Alzheimer’s Disease. PLoS One 9, e94576
- Kaneko, M., Koike, H., Saito, R., Kitamura, Y., Okuma, Y., and Nomura, Y. (2010) Loss of HRD1-mediated protein degradation causes amyloid precursor protein accumulation and amyloid-beta generation. J. Neurosci. 30, 3924-3932
- Omura, T., Kaneko, M., Okuma, Y., Orba, Y., Nagashima, K., Takahashi, R., Fujitani, N., Matsumura, S., Hata, A., Kubota, K., Murahashi, K., Uehara, T., and Nomura, Y. (2006) A ubiquitin ligase HRD1 promotes the degradation of Pael receptor, a substrate of Parkin.
J. Neurochem. 99, 1456-1469 - Kubota, K., Niinuma, Y., Kaneko, M., Okuma, Y., Sugai, M., Omura, T., Uesugi, M., Uehara, T., Hosoi, T., and Nomura, Y. (2006) Suppressive effects of 4-phenylbutyrate on the aggregation of Pael receptors and endoplasmic reticulum stress. J. Neurochem. 97, 1259-1268
総説
- 金子雅幸、金本聡自、郭暁鵬、今泉和則(2017)ライソゾームに局在するユビキチンリガーゼRNF182のmTORCIシグナルへの関与. Pharma Medica, Vol.35(12): 90.
- 齋藤敦、今泉和則(2017)神経活動依存的な小胞体ストレス応答を介した樹状突起の伸長およびスパイン形成制御. Pharma Medica, Vol.35(12): 96.
- 金子雅幸、前岡侑二郎、呉艶、今泉和則(2017)ライソゾームに局在する膜貫通型ユビキチンリガーゼの生理機能. Pharma Medica, Vol.35(11): 85.
- 浅田梨絵、崔旻、今泉和則(2017)DNA損傷における小胞体膜貫通型転写因子OASISの役割. Pharma Medica, Vol.35(11): 83.
- 今泉和則(2017)HISTORY「小胞体ストレス研究の黎明期 - 小胞体ストレスシグナル分子群の発見」. BIO Clinica, 32/12: 1249-1253.
- *Kaneko M, Imaizumi K, Saito A, Kanemoto S, Asada R, Matsuhisa K, Ohtake Y. (2017) ER Stress and Disease: Toward Prevention and Treatment, Biological & Pharmaceutical Bulletin, 40(9): 1337-1343.
- 今泉和則 (2014) 小胞体ストレス応答性膜型転写因子OASISファミリー. 実験医学 32, 2233-2240
- 今泉和則 (2013) オルガネラの制御と破綻. 脳 21 16, 12-16
- 今泉和則 (2012) 小胞体ストレス応答を介した骨軟骨形成制御.生化学 84, 18-29
- Asada, R., Kanemoto, S., Kondo, S., Saito, A. and Imaizumi, K. (2011) The signaling from endoplasmic reticulum-resident bZIP transcription factors involved in diverse cellullar physiology. J. Biochem. 149, 507-518
- 今泉和則 (2009) 小胞体ストレス-小胞体ストレスから回避する化合物の探索. 分子精神医学 9, 199-202