〒101-0062 東京都千代田区神田駿河台2-3-10
東京科学大学 総合研究院
高等研究府 病態細胞生物学研究室
TEL:03-5280-8082 FAX:03-5280-8079
研究内容
研究概略
当研究室では、①自らが発見した細胞機能であるゴルジ体関連分解Golgi-membrane-associated degradation (GOMED)の生理的、病理的意義の解明、②細胞死機構の解析とその破綻に由来する疾患の治療薬開発、③ミトコンドリアやゴルジ体の異常に端を発する疾患研究を3つの柱として研究を行っている。最終的には、これらの知見を基盤に生命の動作原理の本質を解明することを目指している。
主な研究テーマ
1. 新規タンパク質分解機構GOMEDの解析
- A, GOMED分子機構の解析
- B, 生体におけるGOMEDの意義
- C, 疾患への応用
2. 細胞死の解析
- A, アポトーシス分子機構の解析
- B, 非アポトーシス細胞死分子機構の解析(オートファジー細胞死、ネクローシス)
- C, 生体における細胞死の意義
- D, 疾患への応用
3. オルガネラの膜動態膜の解析
- A, ミトコンドリア膜蛋白質の構造機能連関
- B, ミトコンドリア機能異常に基づく疾患の病態解明
1. GOMEDの分子機構と生理機能解析
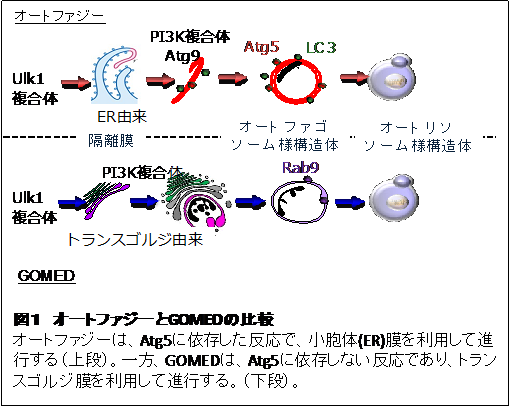
GOMEDは、オートファジーと類似の構造体によって実行されるタンパク質分解機構である。ただし、誘導刺激、実行分子、分解タンパク質の種類などが、オートファジーとは大きく異なる。また、オートファジーが小胞体膜を利用して実行されるのに対し、GOMEDはゴルジ体膜を利用して実行される(図1)。ゴルジ体は、通常シス、メディアル、トランス槽が一体的に機能し、分泌タンパク質や細胞膜タンパク質に適切な修飾を加え、適切な場所に運搬するために機能している。しかしながら、分泌タンパク質などが過剰に運搬されたり、タンパク質に異常が生じたりすると、GOMEDが活性化し、トランス槽の一部がメディアル槽から乖離し、球体化し、異常なタンパク質を包み込む。包み込まれたタンパク質は、その後にリソソーム酵素によって分解される。オートファジーとGOMEDは、1つの細胞の中で共存しており、細胞に加わった刺激の種類によって、あるいは分解する基質の種類によって、使い分けられており、生体での役割は全く異なっている。
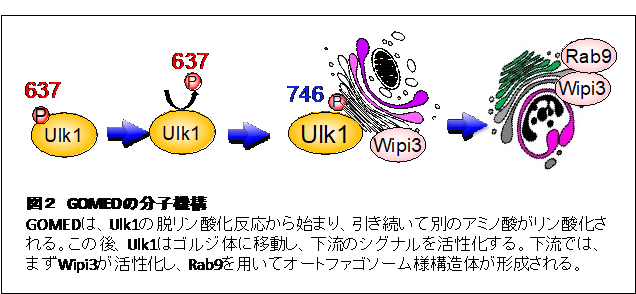
GOMEDの分子機構は、酵母から哺乳動物細胞までよく保存されており、初期段階においてはUlk1やBeclin 1などの分子が重要となる(図2)。さらに、その下流ではWipi3分子が機能している。Wipi3分子は、通常は細胞質中に局在するが、GOMEDのシグナルが細胞に加わると、ゴルジ体に移動し、ゴルジ体膜の変形にかかわる。湾曲したゴルジ体膜は、細胞質成分やゴルジ体中のタンパク質を包み込み、最終的にリソソーム酵素で分解する。
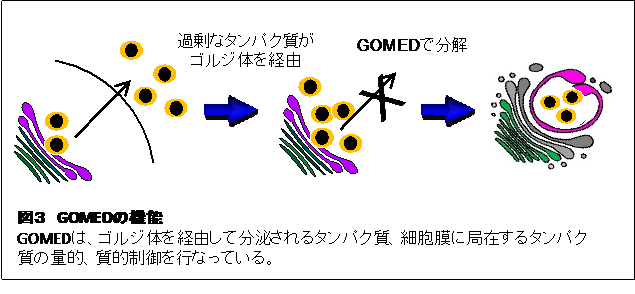
通常のオートファジーとGOMEDの最大の違いは、分解基質が異なる点にある。通常のオートファジーは、p62やLC3などの細胞質タンパク質を主に分解する。一方で、GOMEDは、ゴルジ体を経由して運搬される分子が基質分子となる(図3)。このようなGOMED機能の代表的なものとして、インスリン分泌制御がある。インスリンは、膵臓のインスリン分泌細胞(β細胞)で合成されゴルジ体を介して分泌されるが、細胞周囲のグルコース濃度が低下する(即ち血糖値が下がる)と、さらなる低グルコースを防ぐためにインスリン分泌が抑制される。この時、β細胞内では、GOMEDが誘導されてインスリンの滞留が緩和されるのである。また、GOMEDは、神経細胞の恒常性維持にも関わっている。この知見は、神経細胞特異的にWipi3遺伝子を欠損させたマウスにおいて、小脳のプルキンエ細胞が変性脱落し、行動異常が出現したことより明らかである。この時のGOMEDは、鉄輸送タンパク質であるセルロプラスミンの恒常的分解に寄与しており、この分解が起こらないと、鉄沈着性の神経変性疾患を発症することとなるのである。
2 . 細胞死の解析
我々の体の多くの細胞は自殺装置を内包しており、死ぬべき状況に至ると、自ら積極的に死を実行する。この機構は細胞の分裂や増殖と協調して機能し、個体発生や組織の恒常性維持に寄与している。従来、生理的な細胞死はアポトーシスのみであると考えられて来たが、我々を初めとする複数のグループにより非アポトーシス細胞死の存在が明らかにされ、生体内では複数の細胞死機構が様々に機能しているものと考えられる。我々は、①個々の細胞死機構の詳細を明らかにし(分子レベルの解析)、②生体における細胞死の役割を明らかにし(個体レベルの解析)、③これらの知見を疾患に応用したいと考えている。
A,アポトーシス分子機構の解析
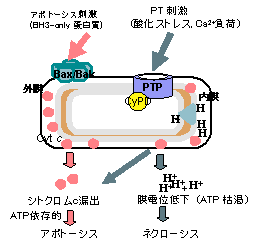
アポトーシス分子機構の基本骨格は、これまでにほぼ明らかにされている。即ち、多くのアポトーシスシグナルはミトコンドリアに入り、ミトコンドリア膜の透過性を亢進させる。ミトコンドリアの膜間腔には数種類のアポトーシス誘導蛋白質が存在しており、膜透過性亢進に伴ってこれらが細胞質に漏出する。その結果、システインプロテアーゼであるカスペースが活性化し、アポトーシスが実行される。アポトーシスを主に制御しているのはBcl-2ファミリー蛋白質であり、これらはミトコンドリアの膜透過性を調節することによって細胞の生死を決定している(Nature, 1995, Nature, 1999, Cell, 2003, etc)。ミトコンドリア周囲でのアポトーシスシグナルの伝達機構には未解明の部分が残されており、我々はこの詳細を明確にする為に解析を進めている。
B,非アポトーシス細胞死分子機構の解析
オートファジー様細胞死
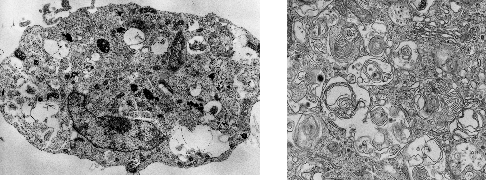
アポトーシスを起こしにくい細胞株(Bax/Bak欠損細胞)に抗癌剤などのアポトーシス刺激を加えると、オートファジー(自食反応)に依存した細胞死機構が活性化し、その結果細胞は死に至ることを、我々は世界に先駆けて見出した(Nature Cell Biol., 2004) (図1)。オートファジー様細胞死(autophagic cell death)は、生理的な細胞死や病理的な細胞死に関与することが示唆されており、現在その詳細な分子機構の解析を行っている。
図1. 抗がん剤によって誘導されたオートファジー様細胞死
ネクローシス
単離ミトコンドリアに活性酸素やCa2+を添加すると、permeability transition(PT)と呼ばれるミトコンドリア膜の透過性亢進現象が誘導される。PTの際には、ミトコンドリアの膨潤や膜電位の低下が惹起される。我々はPTの制御分子であるCyclophilin Dのノックアウトマウスを作製し、細胞死への影響を観察した。その結果、このシステムは、①アポトーシスには関与しないこと、②過剰なカルシウムや酸化ストレスによるネクローシスを誘導すること、を見出した(Nature, 2005)(図3)。現在、ミトコンドリア膜透過性亢進機構の詳細なメカニズム、酸化ストレスによる細胞死の分子機構を解析中である。
C, 生体における細胞死の役割解明
我々は細胞死(アポトーシス、オートファジー細胞死、ネクローシス)に関わる分子の遺伝子改変マウスを多数有しており、これらの解析を通して、それぞれの細胞死の生理的、病理的意義を解析している。
D,細胞死の疾患への応用
細胞死は癌や虚血病変、神経変性疾患など様々な疾患の原因あるいは増悪因子となっている事が報告されている。細胞死機構の解析を通して得た知見をこれらの疾患の克服につなげたいと考えている。
#虚血・再灌流傷害:Cyclophilin D欠損マウスが心筋や脳の虚血再灌流傷害に強い抵抗性を示すことより、PTを介したネクローシスがこの病態に一部関与している事が明らかである(Nature, 2005)。これを基盤に、PT制御薬の開発を企図している。
#放射線誘導性腸炎:放射線誘導性腸炎は主に、放射線による小腸上皮細胞のアポトーシスが原因である。我々は、抗アポトーシス薬としてTat-BH4を開発し、放射線誘導性腸炎での効果を確認している(PNAS, 2000)。
現在、アポトーシスやネクローシスの制御薬として、ミトコンドリアの膜透過性を指標にした低分子化合物スクリーニング系を立ち上げている。
3.オルガネラの膜動態膜の解析
A.ゴルジ体膜の形態変化と機能連関の解析
ゴルジ体は、通常シス、メディアル、トランス槽が一体的に機能し、分泌タンパク質や細胞膜タンパク質に適切な修飾を加え、適切な場所に運搬するために機能している。しかしながら、GOMED実行時には、トランス槽の一部がメディアル槽から乖離し球体化する。また、ゴルジ体は、細胞分裂にともなって、その形態を大きく変化させる。これらの構造変化と機能の連関を解析している。
B. ミトコンドリア機能異常に基づく疾患の病態解明
ミトコンドリアはATP合成やTCAサイクルなど、代謝反応の中心として細胞の生存に寄与している。一方、ミトコンドリアは細胞死においても決定的な役割を果たしている。いずれの場合においても、ミトコンドリアと細胞質との間の情報交換は、これらの細胞機能に不可欠である。我々は、ミトコンドリアと細胞質との間の情報交換の場となるミトコンドリア膜に着目し、膜蛋白質の機能や構造、膜透過性システムを網羅的に解析したいと考えている。また、ミトコンドリアの機能異常に基づく疾患に対して、その病態を解明したいと考えている。
(1)ミトコンドリア膜蛋白質の構造機能連関
アポトーシスやネクローシスなどの細胞死に関連した膜透過性亢進装置の解析の他、代謝物質の交換に必要な膜蛋白質も含めて、膜蛋白質の網羅的な解析を企図している。
(2)ミトコンドリア機能異常に基づく疾患治療法開発
ミトコンドリアの異常に由来する疾患として代表的なものに、神経変性疾患があげられる。神経変性疾患の一部では、ミトコンドリアDNAの点突然変異やそれに伴う活性酸素発生によるミトコンドリアの機能傷害が疾患の増悪因子となっている。また、パーキンソン病をはじめとして、一部の家族性神経変性疾患はミトコンドリア蛋白質の異常が疾患の一義的な原因となっている。ミトコンドリアでの異常と疾患の関係を明確にすることにより、疾患を克服することが可能になるものと思われる。
