・造血器腫瘍における悪性化のメカニズム解析
血液腫瘍をはじめとした腫瘍性疾患の多くは、付加的な遺伝子異常により悪性度の高い病態へと進展していくことが知られています。代表的な病態として骨髄異形成症候群は骨髄でのアポトーシスが亢進することで無効造血(造血がうまくいかなくなること)が生じ、末梢血の血球減少をきたしますが、一定の確率で急性白血病の病態に進展します。この白血病化の際にアポトーシスの抑制、抗アポトーシス遺伝子の発現増強など、様々なことが起こりますが、その進展のメカニズムについてはまだ不明な点が多いです。当分野では、主に患者から採取された組織検体を用いて骨髄異形成症候群から急性白血病への進展、慢性白血病からの急性転化、骨髄増殖性疾患から二次性骨髄線維症あるいは急性白血病への進展などの病態に着目し、遺伝子発現量の変化やタンパク発現異常を調べることで、そのメカニズムの解析を行っています。
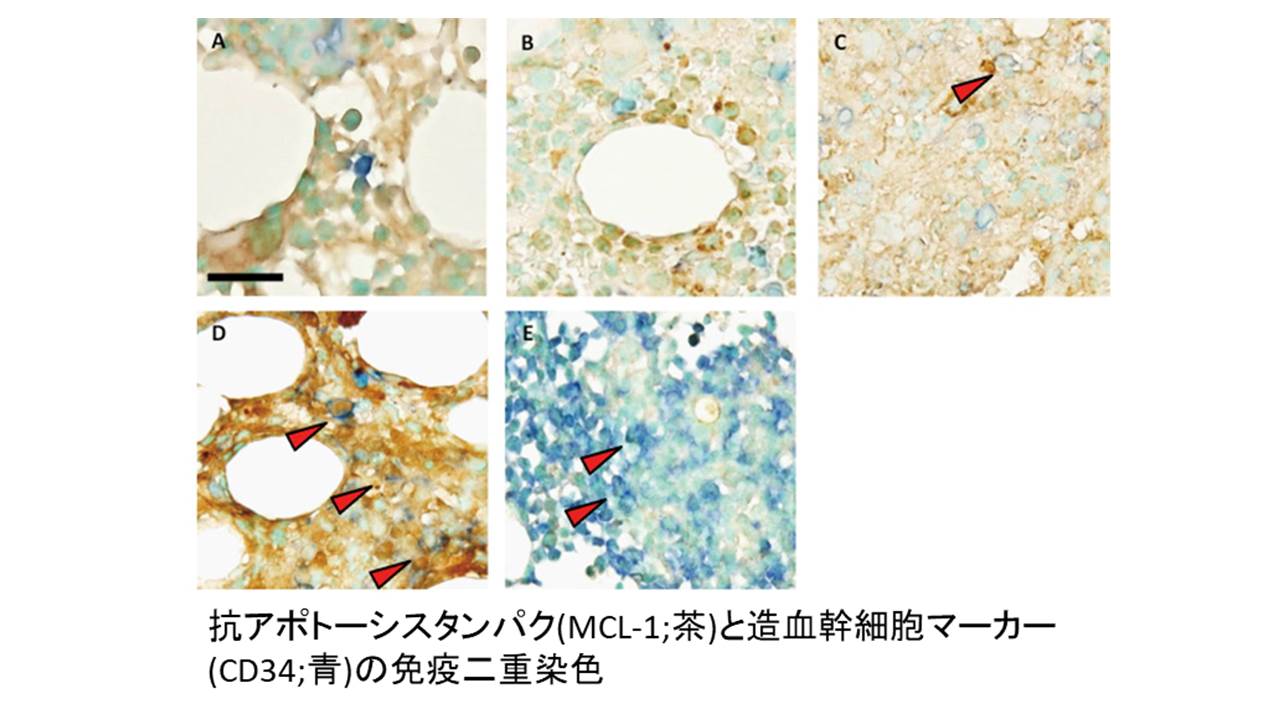
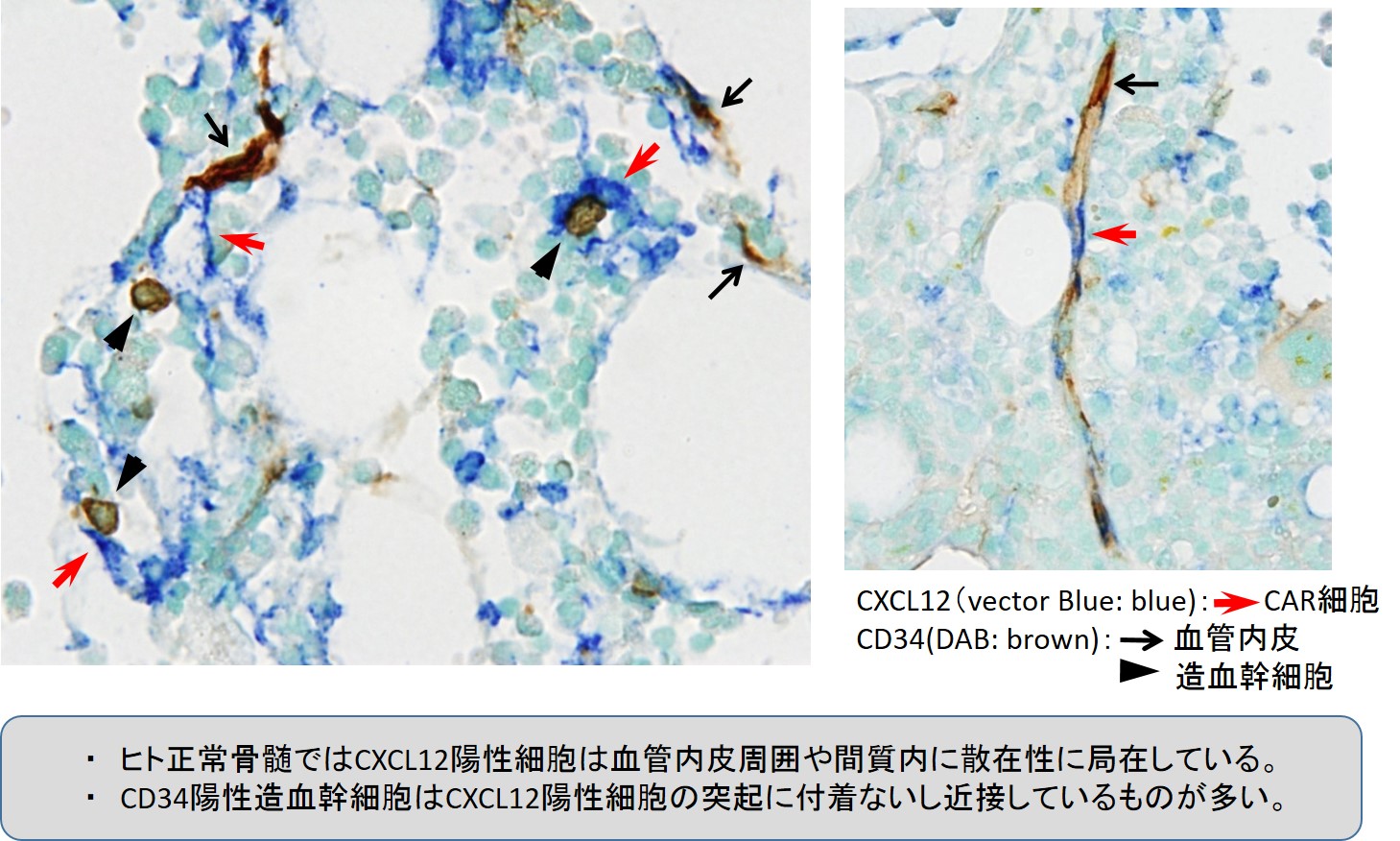
・造血器腫瘍における微小環境に着目した病態解析
正常の造血が維持されるためには、造血幹細胞とともに骨髄の造血環境が重要であることが明らかとされています。この造血組織における造血環境は”ニッチ”と呼ばれており、このニッチが造血の正体を解明すべく現在も多くの研究が行われています。当分野では、このニッチが造血器腫瘍など病的な状態においてどのように腫瘍細胞に影響を及ぼしているかについて解析を行っています。具体的には、骨髄ニッチが発現する遺伝子発現量を調べたり、ニッチが発現するタンパクを可視化し、腫瘍細胞とニッチの関係性について研究しています。
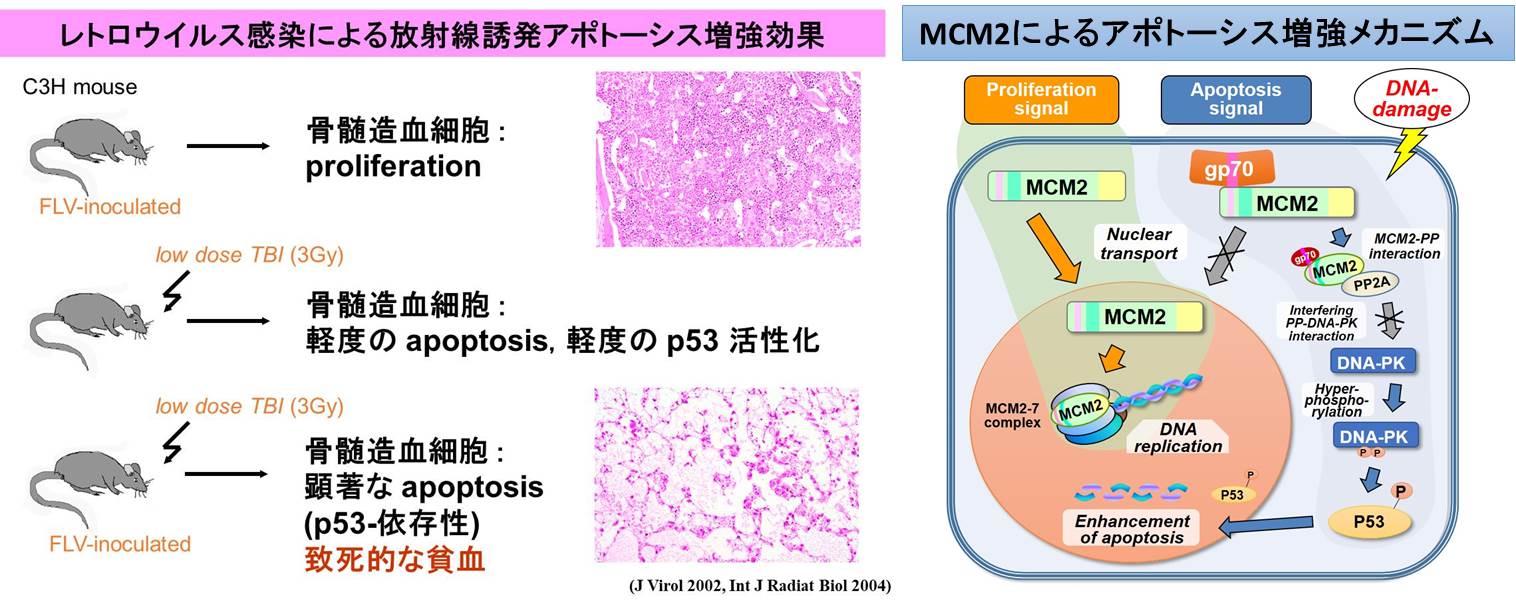
・新規アポトーシスシグナル増強機構の解析と前臨床応用
がん細胞に効果的な細胞死シグナルを与えることは、より効果的な抗腫瘍効果にとって極めて重要な要素といえます。当分野ではマウスの実験系を用いてマウスフレンド白血病ウイルスに感染させた状態で低線量の放射線を照射すると、骨髄細胞に強烈なアポトーシスをひき起こすこと発見しました。このアポトーシスのメカニズムをがん細胞に応用するために基礎実験を行ったところ、がん細胞に過剰に発現する細胞増殖マーカーのひとつであるMCM2がそのアポトーシス機能に密接に関わっていることを見出しました。MCM2は正常の増殖していない静止細胞には発現していないことから、有力な治療ターゲットである可能性を秘めています。現在、臨床応用に向けたMCM2がひき起こすアポトーシス増強システムのマウスモデル確立を目指して研究を進めています。
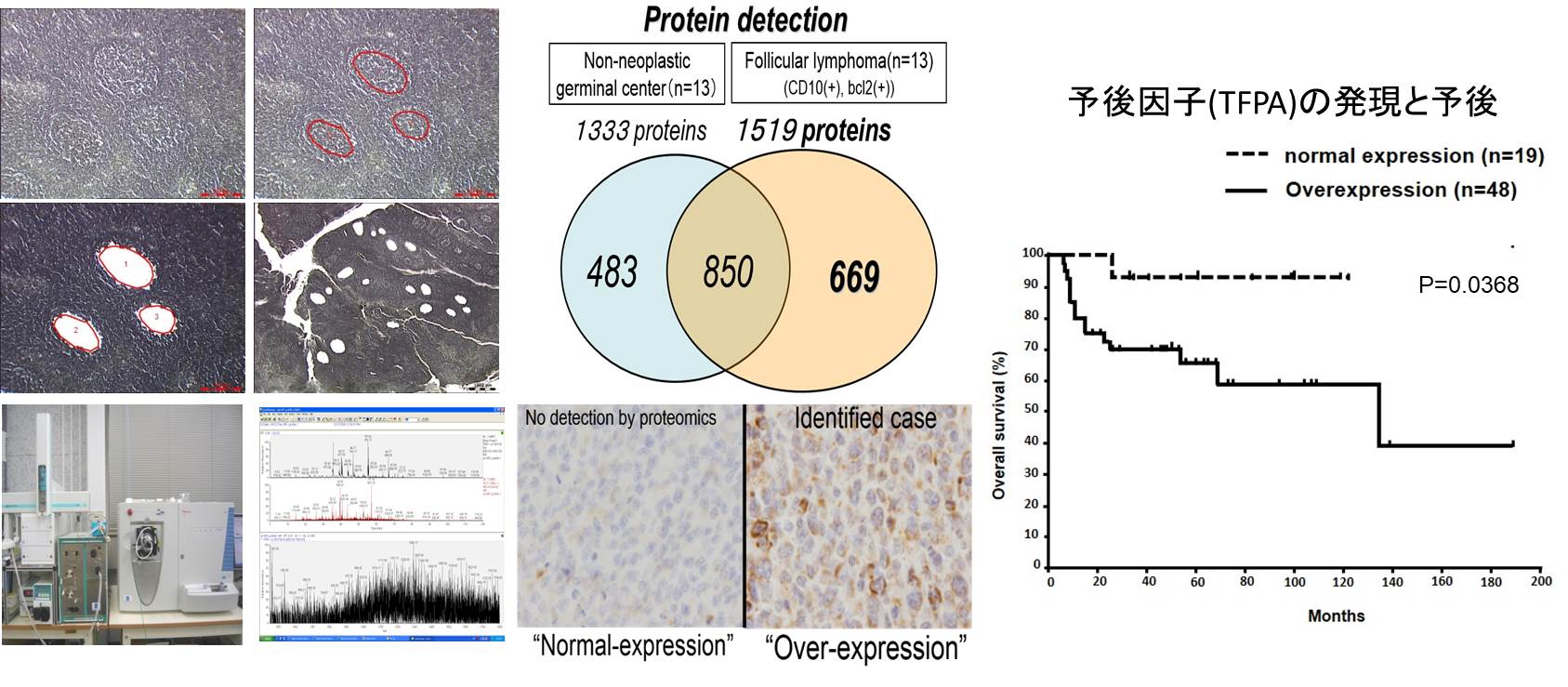
・脂質代謝に着目した悪性リンパ腫の病態解析
一般にがん細胞は正常の細胞に比べ解糖系にエネルギーを依存していることが古くから知られていましたが、近年の研究でがん細胞にとって脂質代謝によるエネルギーが細胞死の回避や薬剤耐性などの悪性形質に重要であることが示されています。当分野では先行研究で悪性リンパ腫組織の網羅的タンパク発現解析を行い、そのなかで悪性リンパ腫に特異的に過剰発現するタンパクとしてTrifunctional
protein (TFPA)を発見し、その過剰発現が悪性リンパ腫における予後不良予測因子候補の一つであることを見出しました。現在、悪性リンパ腫細胞の脂質に対する依存性や脂質量と酸化ストレスの関係などに着目し、分子生物学的、臨床病理学的検討を行っています。
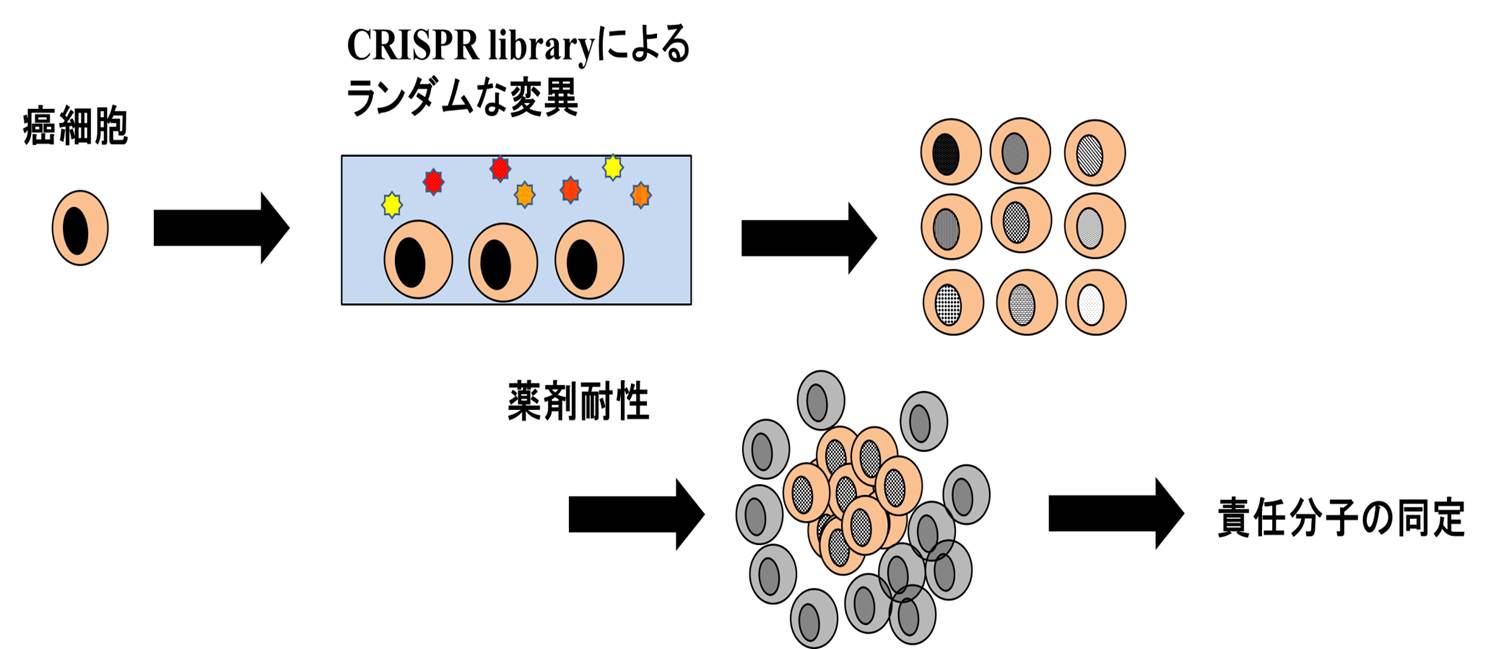
・遺伝子編集技術を利用した薬剤耐性機序の解明
癌治療の問題点として、治療薬があるにも関わらず、治療の過程において薬剤が効かなくなってしまうことあります。また、癌細胞にも血液の骨髄幹細胞に似たような幹細胞能を有する細胞が存在することが知られており、微小環境においてこれらの幹細胞様の癌細胞が薬剤耐性を得ることが治療抵抗性の重大な原因であるとも考えられています。近年開発されたCRISPR
libraryは非常に強力な変異誘導システムであり、ランダムな変異により薬剤耐性を誘導することが可能です。そして、薬剤耐性を獲得した細胞より、治療抵抗性の責任遺伝子の同定を非常に効率的行うことができます。本プロジェクトでは癌細胞の微小環境における薬剤耐性機構の解明し、治療抵抗性の克服を目標としています。