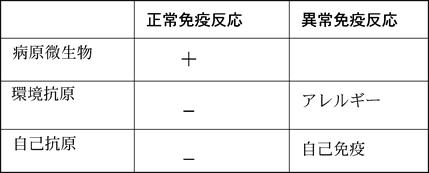
瑣末な研究ではなく、生命現象の基本的な理解を変えていくような研究を行うことをめざしています。実際に、これまで基本的な問題にとりくみ、成熟B細胞が抗原と反応するとアポトーシスをおこすことを発見し、さらに、抗原と反応したB細胞が免疫応答をおこすのか、不応答になるのかのスイッチ機構の解明を行ってきました。この機構は、抗体応答が正常な個体では病原微生物に対してはおこり、自己抗体や花粉、食物などの環境抗原にはおこらないという、免疫応答の基本的な仕組みに関与すると考えられます。
また、ワクチンの効果に関わる基本的な免疫の仕組みの解明や、アポトーシスにおける細胞周期の役割の解明を行ってきました。
2
新領域の開拓をめざす
これまでの学問領域の枠を越えた新領域の開拓をめざしています。液性免疫応答における糖鎖シグナルの研究をCRESTの課題として推進し、糖鎖免疫学の開拓を行っています。さらに、本学におけるケミカルバイオロジーの研究基盤整備にあわせ、化合物を駆使した免疫学研究、ケミカルイムノロジーの展開を図ります。
3
免疫疾患の新たな治療法や新たなコンセプトの
ワクチンの開発をめざす
自己免疫疾患やアレルギー疾患の原因は本来免疫系が反応してはいけない物質に対して免疫応答がおこることである。B細胞が免疫応答をおこすか不応答になるかのスイッチ機構の制御法を開発することにより、本来反応してはいけないB細胞の反応を阻害することを試みています。また、ワクチン効果
の基本的な仕組みの解明から、新たなコンセプトのワクチンの開発を試みています。
我々は、抗原と反応した成熟B細胞が抗体応答をおこすのか、あるいは不応答になるのかに関わる分子スイッチとして、B細胞上に発現する膜分子、CD40、CD22/シグレック2、CD72を同定してきた。
CD40:TNFレセプターファミリーのメンバ-
リガンドはCD40L(CD154)は主に活性化T 細胞に発現するTNFファミリーの分子
CD22/シグレック2 :シグレックファミリーのメンバー
レクチン活性があり、リガンドはa2,6シアル酸
CD72:C型レクチン様ドメインを持つ
レクチン活性の有無は不明
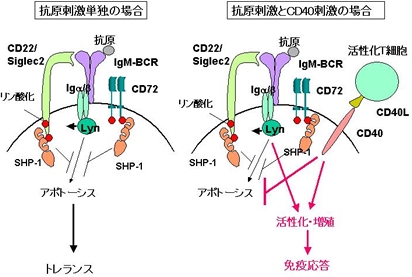
成熟B細胞は抗原のみと反応した場合、抗原受容体を介するシグナル伝達がおこり、B細胞はアポトーシスをおこす。CD40がCD40Lと反応すると、CD40を介するシグナル伝達により抗原によるアポトーシスが阻害され、B細胞は活性化・増殖する。
病原微生物の侵入に際しては、微生物抗原や炎症により樹状細胞が活性化され、その結果
、ヘルパーT細胞の活性化がおこる。活性化したヘルパーT細胞はCD40のリガンドCD40Lを発現する。病原微生物に反応したBリンパ球は、CD40Lと反応することにより活性化し、抗体反応をおこす。一方、自己抗原や環境抗原に反応したBリンパ球は、CD40Lと反応できずに、アポトーシスをおこし、免疫不応答となる。
CD40Lの過剰により自己免疫がおこることが予測されるが、我々は、CD40Lの過剰発現により全身性自己免疫疾患が発症することを実際に明らかにした。また、全身性エリテマトーデス患者で、CD40Lの過剰発現が報告されている。
CD22およびCD72は抗原受容体シグナル伝達の制御分子として同定されたが、これらの分子は抗原によるアポトーシスに必須であり、これらの分子によるシグナル制御がおこらなくなるとB細胞は抗原に反応して活性化するようになる。CD22の欠損やこれらの分子のエフェクター分子SHP-1の欠損により自己免疫がおこる。
したがって、CD40、CD22およびCD72は、抗原と反応したB細胞が活性化するかアポトーシスをおこして不応答になるかの分子スイッチであり、正常に機能することにより、病原微生物への抗体産生はおこるが、自己免疫やアレルギーは抑制される。
新たなアレルギー・自己免疫の治療戦略の開発
また、我々は、以上のような免疫応答・不応答のスイッチ分子を標的にすることにより、抗原と反応したBリンパ球の運命を変換する技術の開発をおこなっている。このことにより、新たなアレルギーや自己免疫の治療戦略の開発が可能になると期待される。

記憶免疫応答の分子機構の解明
なぜワクチンが効果
を発揮するのか
ある病原微生物に感染したことがあったり、あるいは、その病原微生物のワクチンを接種されていたりすると、免疫によりその微生物から守られる。これは、その病原微生物に反応する記憶リンパ球が体内で長く生存するためである。始めて微生物に感染すると、約1週間後に初期型のIgM抗体が産生され、2週目に大量
のIgG抗体の産生がおこる、IgG抗体は微生物を効率良く排除する。一方、記憶Bリンパ球は感染後速やかに抗体産生をおこし、症状がおこる前に微生物を排除する。このため、ワクチンにより微生物から守られることになる。
記憶Bリンパ球が速やかに大量
の抗体を産生する仕組み
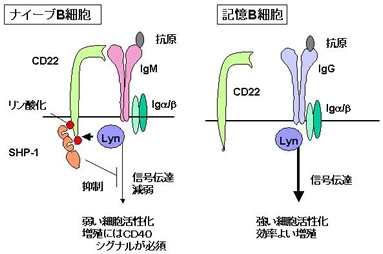
Bリンパ球には抗原受容体があり、抗原受容体が抗原と反応すると細胞内シグナル分子の活性化がおこる。これまで、抗原と反応したことのないナイーブBリンパ球と記憶Bリンパ球では、抗原受容体を介するシグナル伝達は同じと考えられていた。しかしながら、我々は、抗原受容体が抗原と反応した場合、記憶Bリンパ球ではナイーブリンパ球に比べ非常に強い細胞内シグナル分子の活性化がおこることを明らかにし、さらにそのメカニズムにCD22が関与することを示した。すなわち、CD22は記憶B細胞にも発現するが、記憶B細胞では抗原受容体シグナル伝達を制御できず、その結果
、細胞内シグナル分子の強い活性化がおこり、抗原と反応してもアポトーシスをおこさずに速やかに活性化する。この知見は、2002年にScience誌に掲載された。(論文別
冊はこちら) 現在、この分子機構のさらなる解明を行うとともに、この分子機構を標的として、感染免疫を効率化する方法の開発をおこなっている。
糖鎖免疫学の展開
これまで獲得免疫応答における糖鎖シグナルの重要性はあまり明らかではなかった。これは、糖鎖シグナルの性状がタンパクシグナルの性状とは異なるため、その解析が困難であったためである。実際、多くのレクチンは糖鎖リガンドと低い親和性でしか反応しない。また、糖鎖リガンドは種々の糖脂質や糖タンパク上に酵素反応によって発現するので、その局在はタンパクシグナルのように容易に同定できない。したがって、糖鎖リガンドの機能解明はきわめてチャレンジングなテーマである。
近年我々の研究も含め、CD22が液性免疫応答で重要な役割を果たすことが明らかとなってきた。そこで、CD22による液性免疫応答の制御におけるCD22の糖鎖リガンドの役割の解明を行うことにより、獲得免疫応答における糖鎖シグナルの役割を解明するとともに、糖鎖シグナルへのアプローチ法の開発を行っている。
本研究により糖鎖リガンドに機能やその作用様態が解明されれば、糖鎖薬剤によりアレルギーや自己免疫疾患の新たな治療法を開発したり、あらたなコンセプトの感染防御法の開発が可能になると期待される。

細胞周期回転によるアポトーシスの制御機構
ー調和のとれた細胞増殖・分化を保証する機構
細胞周期回転はアポトーシスを制御する
サイクリン依存性キナーゼ(CDK)は細胞周期回転のエンジンとして知られる。CDK阻害分子はCDKを阻害することにより細胞増殖を阻害するが、終末分化しつつある細胞ではアポトーシスをも阻害することが報告されている。一方、増殖している細胞、とりわけリンパ球ではアポトーシスを誘導する。したがって、細胞周期回転は細胞分化段階に応じてアポトーシスを異なる様態で制御し、増殖期にはアポトーシスを阻害し、終末分化の際にはアポトーシスを誘導すると考えられる。
このような細胞周期回転とアポトーシスの連関により、増殖期に増殖しない細胞が排除され、増殖を止めて終末分化する際には、増殖と止めない細胞を排除される。したがって、細胞周期回転によるアポトーシス制御により、秩序正しい細胞の増殖・分化が保証されているものと考えられる。


 免疫応答・不応答のスイッチ機構の解明
免疫応答・不応答のスイッチ機構の解明
 記憶免疫応答の分子機構の解明
記憶免疫応答の分子機構の解明
 細胞周期回転によるアポトーシスの制御機構
細胞周期回転によるアポトーシスの制御機構