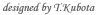
![]()
1.遺伝子改変モデル動物を用いた「新たな慢性アレルギー炎症誘発機構」の解明
〜血球細胞のなかで最も数の少ない好塩基球が、実は慢性アレルギーをひきおこす主役であった〜
(1)アレルギー疾患モデル動物(アレルゲン特異的IgEトランスジェニックマウス)の樹立
花粉症やペニシリンショックなどの際に見られる即時型アレルギー反応は外来異物(アレルゲン)が免疫グロブリンの一種であるIgE分子に結合し、皮膚や粘膜のマスト細胞上に発現しているIgEレセプターを架橋することによって開始されます。
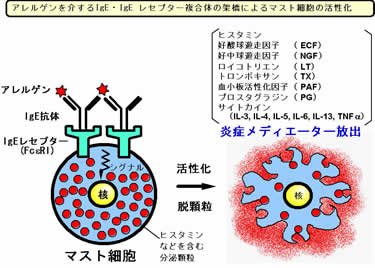
私たちは、誘発型のアレルギーモデル動物の樹立をめざした研究の第一段階として、世界に先駆けて、ハプテンTNP (trinitrophenol)に特異的なIgEを発現するトランスジェニックマウスの樹立に成功しました(米国特許:Patent No. 6,118,044)(Int. Immunol, 1999)。 これらのマウスではアレルギー患者の場合と同様、血中IgEが持続的に高値(20〜50 μg/ml)を示し、しかもそのIgEはすべてTNP特異的であることが確認されました。 そこでアレルゲン曝露による誘発実験をおこなったところ、アレルゲン注射による全身性アナフィラキシーショックの誘導など典型的な即時型(I型)アレルギー反応が観察されました。すなわち、抗原による事前の感作なしに1回の抗原チャレンジのみで抗原特異的なアレルギー反応を誘発できるモデル動物が樹立されたわけです。 |
 |
 |
TNP特異的IgEトランスジェニックマウス作製の成功をふまえて、さらに実際のアレルギー患者で問題となっているアレルゲンに注目して臨床への応用をめざした研究ということで、蛋白アレルゲンに特異的なIgEトランスジェニックマウスの作製を進めました。その結果、現在までに卵アレルゲン特異的IgEならびにダニアレルゲン特異的IgEのトランスジェニックマウスの樹立に成功しました。現在、食物アレルギーならびに喘息のモデル動物として解析を進めるとともに、T細胞レセプタートランスジェニックマウスとの掛け合わせをおこない、慢性型アレルギーのモデル動物としての解析をおこなっています(Int. Arch. Allergy Immunol., 2003; Clin. Exp. Immunol., 2004; J. Allergy Clin. Immunol., 2005)。 |
(2)好塩基球が主役を演じる新たな慢性アレルギー炎症誘発機構の解明と治療への応用
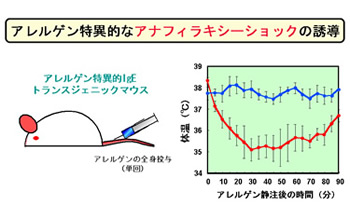
| この第3相目の皮膚腫脹は抗原特異的かつIgE依存的反応であり、病理組織学的には好酸球、好中球を含む非常に強い細胞浸潤が観察されました。抗ヒスタミンは第3相目皮膚腫脹には全く無効でしたが、サイクロスポリンならびにステロイドが第3相目皮膚腫脹を著明に抑制しました。さらに、各種の変異マウスを用いて解析したところ、驚くことに、T細胞欠損マウスならびにマスト細胞欠損マウスでも、正常マウスと同等の第3相目皮膚腫脹が観察されました(Immunity, 2005)。この新発見は「IgEが即時型のアレルギー反応をひきおこす」「T細胞が遅延型免疫応答をひきおこす」という既成概念では説明できない、全く新しい慢性アレルギー炎症誘導機構が存在することを意味します。 FcεRI欠損マウスでは第3相目皮膚腫脹が全く出現しなかったことから、低親和性IgEレセプターCD23ではなく高親和性IgEレセプターFcεRIが3相目皮膚腫脹には必須であることが判明しました。そこで、正常マウスからさまざまな細胞分画を単離して、FcεRI欠損マウスを移入して第3相目皮膚腫脹が再構築できるかどうか解析したところ、好塩基球を移入したときにのみ第3相目皮膚腫脹が観察されました。すなわち、マスト細胞ではなく、好塩基球が慢性アレルギー炎症をひきこす責任細胞であることが明らかとなりました(Immunity, 2005)。 さらに、最近樹立に成功した好塩基球除去抗体を用いた実験から、好塩基球は炎症のエフェクター細胞というよりも、むしろイニシエーター細胞として機能して、他の炎症細胞(好酸球や好中球)の炎症巣への遊走を誘導していることがわかってきました(Blood, 2007 )。この好塩基球除去抗体は慢性アレルギー炎症に対して予防的な効果を示すだけではなく、すでに炎症が起こった後に投与しても抑制効果を示しました。このことは、好塩基球が有望な治療の標的となることを強く示唆しています。 |  |
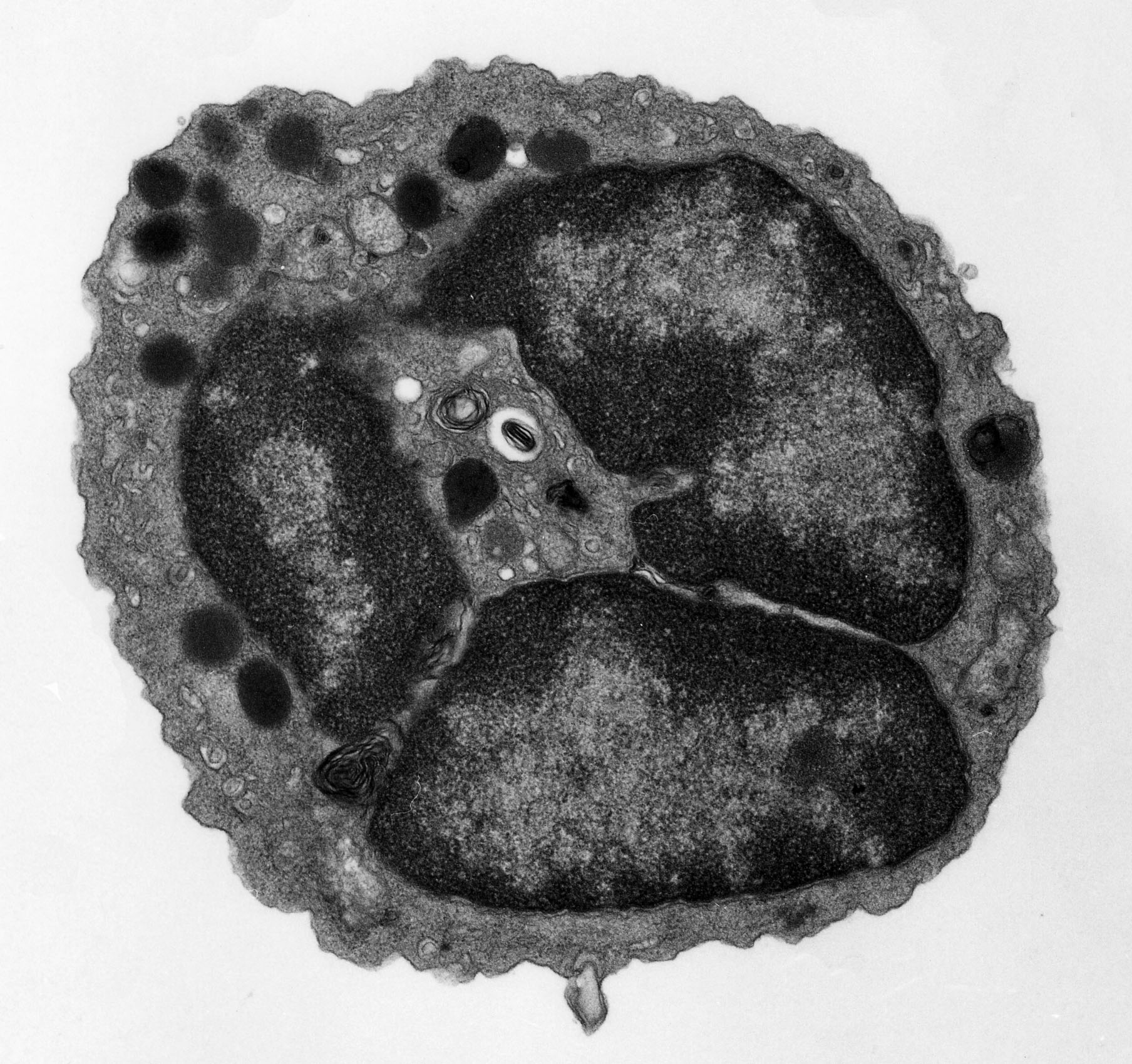 |
好塩基球は、末梢血白血球のわずか0.5%を占めるに過ぎない最少細胞集団であり、また好塩基球欠損マウスが無いこともあって、好塩基球に関する研究は非常に遅れています。また、好塩基球は、FcεRIを発現し、刺激によりヒスタミンなどのケミカルメディエーターを分泌するなど、マスト細胞と共通点が多いため、これまで「循環型のマスト細胞」などと揶揄され、マスト細胞の陰に隠れた脇役として認識されていました。ところが、最近になって、好塩基球が刺激に応じて即座に大量のTh2サイトカイン(IL-4など)を分泌することが判明し、にわかに注目を集めるようになりました。しかし、依然として好塩基球が生体内でどのような役割をしているのかは不明でした。私達の今回の発見は、好塩基球が生体内でマスト細胞とは異なるユニークな役割を果たしていることを初めて証明したものであり、好塩基球の存在意義を明示するエポックメイキングな研究成果です。 臨床疫学的に、喘息やアトピー性皮膚炎患者では、血中IgE値と疾患重症度との間に正の相関が認められます。また最近、世界的な規模で進められている抗IgE抗体療法の治験において、花粉症や食物アレルギーのような即時型アレルギー疾患のみならず、重度喘息患者においても症状の軽減ならびにステロイドの減量にいたる有効例が少なからず報告されています。したがって、私たちが発見した慢性アレルギー病態へのIgE・好塩基球の関与がモデルマウスのみならず、アレルギー患者においても実際におこっている可能性が考えられます。 |
(3)IgEによるIgEレセプターの発現制御機構の解明―創薬の新たなターゲット
IgEトランスジェニックのマスト細胞の高親和性IgE受容体FcεRIの発現量を調べたところ正常マウスのものに比べ5倍、IgE欠損マウスに比較するとなんと20〜30倍も亢進していることが判明しました。高IgE血症を示すアレルギー患者においてもマスト細胞・好塩基球上のFceRIの発現亢進が認められます。アレルギー患者ではFcεRIの発現亢進にともない、マスト細胞・好塩基球からのヒスタミンやサイトカインの分泌が亢進することが報告されています。したがって、IgE結合によるFcεRI発現亢進機構を解明することができれば、アレルギー治療の新たなターゲットが見つかる可能性が大です。
私たちのこれまでの研究で、マスト細胞におけるFceRIの発現亢進は主にIgE結合によるFcεRI分子の安定化とそれにともなう細胞表面でのFcεRI分子蓄積によるものであることが明らかとなりました(J. Immunol., 2001)。さらに、このIgE結合によるFcεRIの発現亢進がマスト細胞の記憶の形成・維持にも大いに寄与していることが判明しました(J. Immunol., 2003)。最近の研究から、ヒトにおいて、マスト細胞・好塩基球だけではなく、抗原提示細胞(樹状細胞など)上にもFcεRIが発現していることが明らかとなりました。抗原提示細胞上に発現するFcεRIは、α鎖とγ鎖と呼ばれる2種のポリペプチドから構成されています。IgGレセプターであるFcγRIIIもα鎖とγ鎖から構成されています。FcεRIとFcγRIIIは構造は大変よく似ていますが、細胞表面における半減期は非常に異なっています。すなわち、リガンドであるIgEが結合していないとFcεRIの細胞表面上での半減期が短いのに対して、FcγRIIIの半減期はIgGが結合していなくても非常に長いという特徴があります。両者を構成するγ鎖は共通ですので、両者の安定性の違いは、それぞれに固有なα鎖に依存していることになります。そこで、FcεRIα鎖とFcγRIIIα鎖の各種キメラ体を作製して、α鎖のどの部位がFcεRIの不安定性を決定しているのか絞り込みをおこなったところ、予想外なことに、α鎖の膜直上部分(茎部分)が重要で、しかもその長さが安定性を規定していることが明らかになりました(J. Immunol., 2006) |
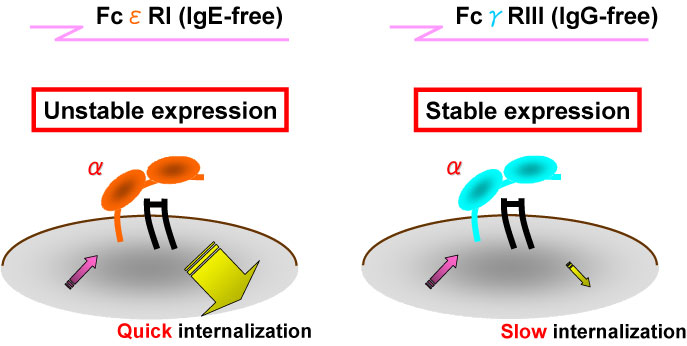 |
