「スーパーエンハンサーを標的とするmiRNAを用いた核酸抗癌薬の可能性」
2021.08.05
ポイント
- 核酸抗癌薬のシーズとしてマイクロRNA※1miR-766-5pを同定しました。
- miR-766-5p はスーパーエンハンサー※2の活性を制御するCBPおよびBRD4を標的とし、その活性を抑制することでMYC の発現を癌細胞特異的に抑制しました。
- miR-766-5p は希少難治癌であるNUT 正中線癌の※3ドライバーBRD4-NUT融合タンパクの発現を抑制しました。
- マウス治療実験モデルにおいてmiR-766-5pの局所投与は複数の癌細胞の腫瘍成長を抑制しました。
- miR-766-5pを用いた新規核酸抗癌薬開発への応用が期待できます。
東京医科歯科大学・難治疾患研究所・分子細胞遺伝分野の玄泰行助教、稲澤譲治教授らの研究グループは、miR-766-5pがスーパーエンハンサー活性の抑制を介してMYCの発現を癌細胞特異的に抑制し、抗腫瘍効果を発揮することを見出しました。この研究は文部科学省科学研究費補助金 (18H02688, 19K07709)などの支援のもと遂行され、その研究成果は、米国癌学会(American Association for Cancer Research, AACR)の機関誌の一つである国際科学誌Cancer Research(キャンサーリサーチ)に、2021年8月5日午前10時(米国東部時間)にオンライン版で発表されます。
研究の背景
癌はしばしば癌細胞特異的なスーパーエンハンサーを獲得し、様々な癌遺伝子を活性化していることが知られています。その中でも代表的な癌遺伝子MYCは多くの癌細胞においてスーパーエンハンサーが存在して高発現し、癌の性質を特徴づける一方、MYCを標的とする分子標的治療薬はいまだに開発されていません。核酸の一種であるマイクロRNA(miRNA)は、20-25塩基程度の内在性のノンコーディングRNAであり、複数の標的遺伝子の発現を抑制する働きがあり、核酸抗がん薬のシーズとして注目されています。研究グループはこれまでに多数のmiRNA を含むライブラリーを用いて、核酸抗癌薬の有望なシーズとなりうるmiRNA を報告してきました(Sci. Rep. 8, 4482. (2018), Mol. Ther. 28, 1494-1505. (2020), Mol. Ther. Nucleic. acids. 25, 83-92. (2021))。
研究成果の概要
研究グループは、まずこれまでに見出した138 種類の抗腫瘍効果の強い腫瘍抑制型miRNA (Mol. Ther. 28,1494-1505. (2020))を対象に、MYC の活性を抑制するmiRNA をin vitroでスクリーニングしました。その結果、MYCの発現を強く抑制するmiRNAとしてmiR-766-5pを同定しました。miR-766-5pはMYCの発現の高い癌細胞において、その発現を抑制する一方、MYCの発現の低い非腫瘍細胞においてはその発現に大きな影響を与えませんでした(図1A)。さらに詳細な機能解析の結果、miR-766-5pはスーパーエンハンサーの活性を制御するCBP の3'UTR を、BRD4のコーディング領域を標的として抑制し(図1B)、MYCのスーパーエンハンサー領域の活性を抑制することで(図1C)、非腫瘍細胞には影響を与えず、癌細胞特異的にMYC の発現を抑制していることがわかりました。た、miR-766-5pはNUT 正中線癌のドライバーであるBRD4-NUT融合タンパクも抑制しました(図1D)。マウスモデルの治療実験でmiR-766-5p の投与はNUT 正中線癌細胞を含む複数の癌細胞の腫瘍の成長を抑制しました(図1E)。
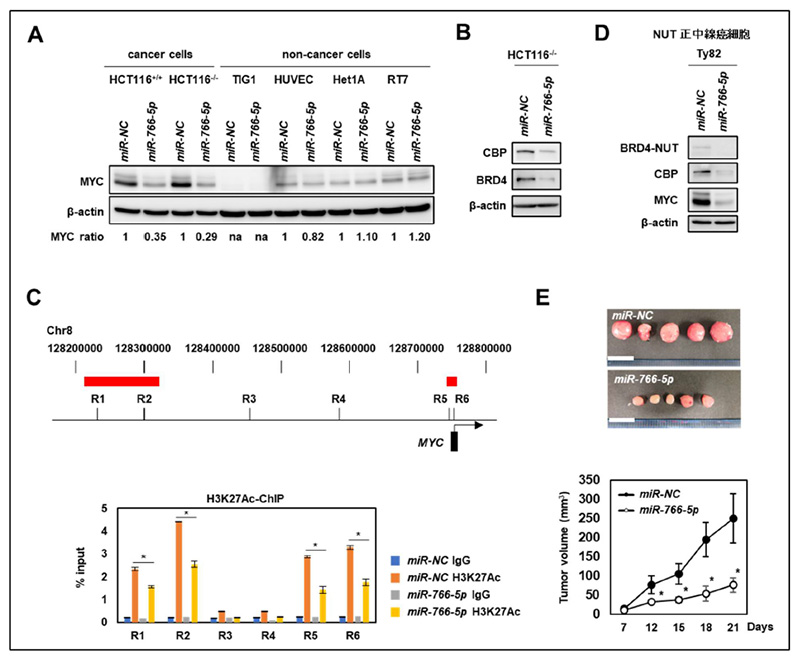
図1. miR-766-5pの抗腫瘍効果
(A)ウエスタンブロット法。miR766-5pはMYCの発現が高い癌細胞(HCT116+/+、HCT116-/-細胞)において、MYCの発現を抑制する一方、非腫瘍細胞(TIG1、HUVEC、Het1A、RT7細胞)ではMYCの発現が低く、その発現に大きな影響を与えなかった。(B)miR-766-5pはスーパーエンハンサー活性を制御するCBP及びBRD4を抑制した。(C)クロマチン免疫沈降法において、miR-766-5p はMYC のスーパーエンハンサー領域3(赤で示す領域)において、その活性(H3K27Ac)を抑制した。(D)miR-766-5pはNUT正中線癌細胞において、そのドライバーであるBRD4-NUT融合タンパクを抑制し、MYCの発現を抑制した。(E)miR-766-5pはマウス治療実験モデルにおいてNUT 正中線癌の腫瘍成長を抑制した。
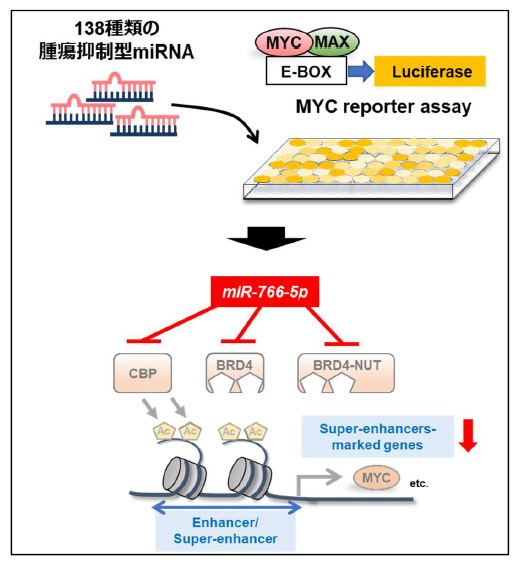
図2.本研究のまとめ図
研究成果の意義
本研究では、新たな核酸抗癌薬のシーズとしてmiR-766-5pを同定しました(図2)。miR-766-5pはBRD4とCBPを抑制することで、スーパーエンハンサーを制御し、癌細胞特異的にMYC の発現を抑制しました。miR-766-5を用いた核酸抗癌薬はMYCが活性化している癌に対する新たな治療戦略となる可能性があります。
用語解説
※1 マイクロ RNA(microRNA : miRNA) は、標的遺伝子の転写産物(mRNA)に直接結合することで、遺伝子発現を抑制する約22塩基からなるノンコーディングRNA です。ヒトでは 2,500種類以上のマイクロRNAが存在しており、中でも、がん抑制型マイクロRNAは、核酸抗癌薬の開発における創薬シーズとして期待されています。
※2 多くの癌細胞ではスーパーエンハンサーと呼ばれる、遺伝子の転写を大きく促進する調節機構が存在し、癌遺伝子を高発現させていることが知られています。特に代表的な癌遺伝子MYC は多くの癌で高発現し、スーパーエンハンサーが存在しています(Cell 155, 934-47. (2013))。近年、スーパーエンハンサーに結合して癌遺伝子の転写を促進するBRD4を標的とするBET阻害剤が開発されつつあります。
※3 NUT正中線癌はBRD4-NUT 融合遺伝子が発癌の要因(ドライバー)となる希少難治癌です。臨床試験において、BET阻害剤の有効性が示唆されています(J. Clin. Oncol. 36, 3007-3014. (2018))。
論文情報
掲載誌:Cancer Research
論文タイトル: miR-766-5p targets super-enhancers by downregulating CBP and BRD4
研究者プロフィール
-
 玄 泰行(ゲン ヤスユキ)
玄 泰行(ゲン ヤスユキ)
Yasuyuki Gen
東京医科歯科大学・難治疾患研究所分子細胞遺伝分野 助教
同・統合研究機構 疾患バイオリソースセンター協力教員(助教)
研究領域:腫瘍生物学 -
 稲澤 譲治(イナザワ ジョウジ)
稲澤 譲治(イナザワ ジョウジ)
Johji Inazawa
東京医科歯科大学・統合研究機構 疾患バイオリソースセンター センター長
同・難治疾患研究所 分子細胞遺伝分野 教授
研究領域:腫瘍生物学、人類遺伝学、腫瘍診断学
研究に関する事
東京医科歯科大学難治疾患研究所
分子細胞遺伝分野
氏名 稲澤 譲治 (イナザワ ジョウジ)
氏名 玄 泰行 (ゲン ヤスユキ)
TEL:03-5803-5820 FAX:03-5803-0244
E-mail:johinaz.cgenmri.tmd.ac.jp
報道に関する事
国立大学法人東京医科歯科大学 総務部総務秘書課広報係
〒113-8510 東京都文京区湯島1-5-45
TEL: 03-5803-5833 FAX: 03-5803-0272
E-mail: kouhou.admtmd.ac.jp
