研究内容
低侵襲がん治療用材料に関する研究
深部がん血管内放射線・温熱治療用微小球
1981年以来、がんは日本人の死亡原因の第1位を占めています。しかも、がんは大きな苦痛を伴うと恐れられています。現在、これを治療する最も一般的な方法は、患部を手術により切除する外科的療法です。しかし、患部を切除するとその機能を回復できない器官も多く、がんを外科的手術により完全に切除できない場合もあります。そこで、近年、患部を切除することなく、がん細胞だけを死滅させ、その後に正常組織の再生を期待できる、低侵襲機能温存療法に大きな期待が寄せられるようになりました。化学療法、免疫学的療法、放射線療法あるいは温熱療法などは、その可能性を有しますが、正常細胞を傷めず、がん細胞に対してだけ有効な抗がん剤を用いた化学療法や、がん細胞だけに有効な抗体を用いた免疫学的療法は未だ十分には発達していません。放射線あるいは温熱療法においては、従来主に体外から患部を放射線照射あるいは加温するため、体内深部のがん(例えば肝臓がん)を効果的に放射線照射あるいは加温できないばかりでなく、体表付近の正常組織にも大きな損傷を与えました。
β線などの飛程の短い放射線を放射する、直径20~30 μmの微小球を患部に送り込めば、周囲の正常組織を傷めることなく、がんを局部的に直接放射線照射して治療できる可能性があります(図1)。また、直径20~30 μmの強磁性微小球を上記と同様に患部に送り込み、患部を交流磁場の下に置くと、同微小球が磁気ヒステリシス損により発熱するので、がんを局所的に加温して治療できる可能性もあります(図1)。そこで本研究室では、そのようながんの低侵襲治療に有用なセラミック微小球の創製を試みています(図2~6)。
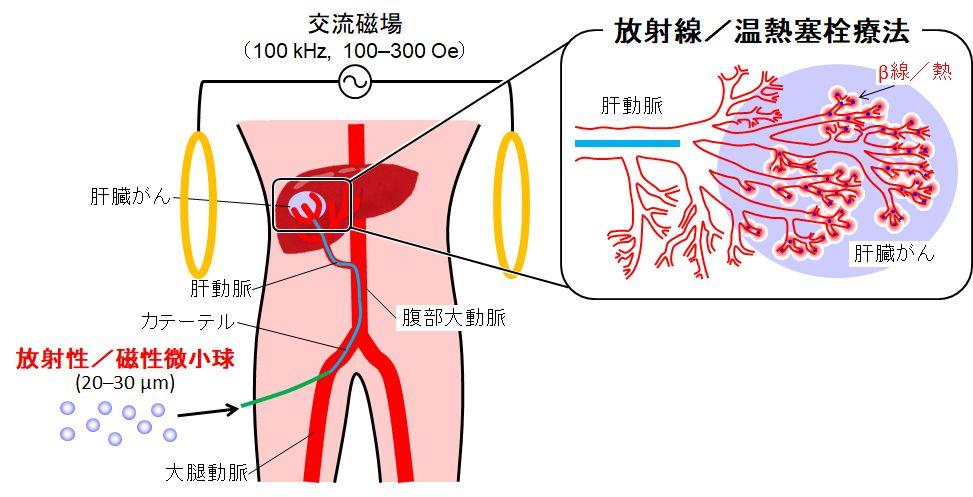

(M. Kawashita et al., Biomaterials, 24 (2003) 2955)

(M. Kawashita et al., Biomaterials, 26 (2005) 2231)
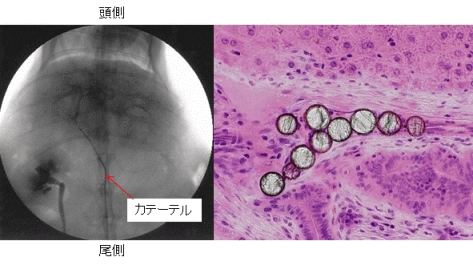
(M. Kawashita et al., Int. J. Appl. Ceram. Tech., 2 (2005) 173)
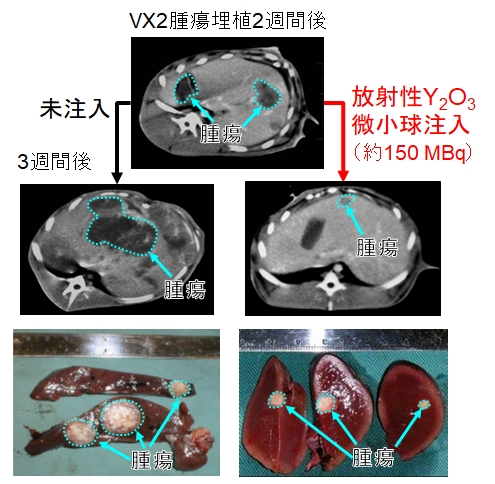
(M. Kawashita et al., Int. J. Appl. Ceram. Tech., 2 (2005) 173)
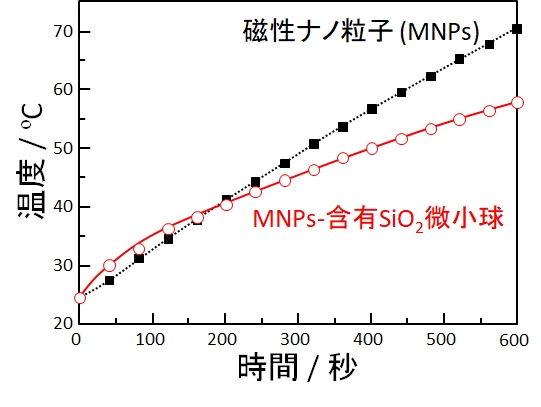
(Z. Li et al., Biomed. Mater., 5 (2010) 065010より改変)
生体活性骨修復用材料に関する研究
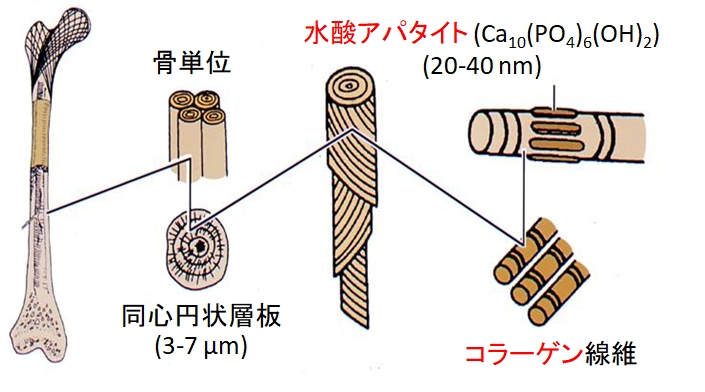
図7に示すような構造を有する骨は、私達の体を隅々まで支え、脳や内臓など重要な臓器を保護し、206個に分かれて互いに関節を介して繋がり、様々な運動を可能にしています。従って、関節や骨に1箇所でも損傷が生じると、私達はとたんに日常生活に支障をきたすことになります。高齢者が寝たきりになる原因の第2位は、関節症と骨折だといわれています。膝関節や股関節が傷んだ時、従来これらは金属とポリエチレンの組み合わせからなる人工関節で置き換えられてきました。しかし金属は、短期間にその関節面の平滑さを失い、摩擦係数を増大させ、金属とポリエチレンの摩耗片を生じます。この摩耗片は周囲の細胞の壊死を招きます。また、人工関節はポリメチルメタクリレートの骨セメントにより周囲の骨に固定されてきましたが、骨セメントは、固化の際、重縮合により100℃にも達する熱を発生して周囲の組織を傷め、循環器系に傷害を与える未反応モノマーを溶出し、しかもセメント自体は、コラーゲン線維の膜により周囲の骨から隔離され、骨と結合しません。その結果、術後10年を待たずして人工関節の固定が緩む例が数多く報告されました。これらの問題を解決するために、1970年代から、それまで別の目的で開発されてきたセラミックスが骨の修復に用いられるようになり、さらに骨の修復だけを目的にした新しいセラミックスが次々に開発され、今日ではセラミックスが臨床治療の場で無くてはならぬ働きをするようになってきました。
セラミックスやガラス等の人工材料の中には、骨欠損部に埋入されると、周囲の骨と自然に結合し、一体化する(生体活性を示す)ものがあります。これらは「生体活性セラミックス」と呼ばれ、重要な骨修復材料として既に実用化されています。しかし、臨床現場では、より骨結合性に優れた骨修復材料が求められています。そこで本研究室では、材料工学に基づいた種々の合成プロセスにより、骨修復に有用な生体活性材料の創製を試みています(図8, 9)。

(M. Kamitakahara et al., Biomaterials, 24 (2003) 1357)
(M. Kawashita et al., Colloids Surf. B, 145 (2016) 285)
水酸アパタイトの骨伝導機構の解明
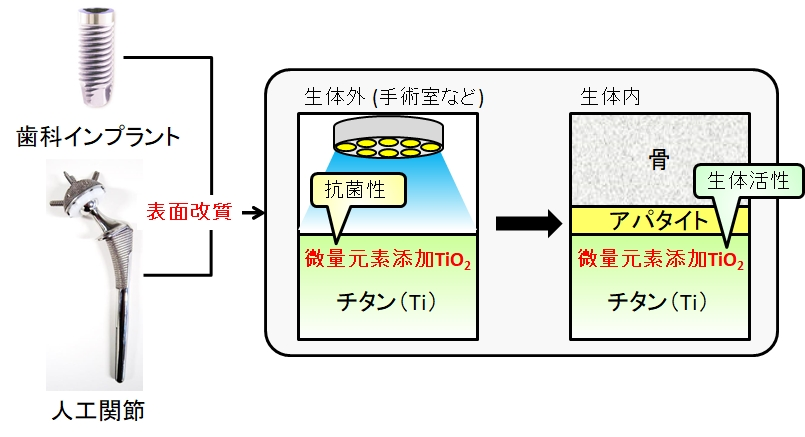
水酸アパタイト(HAp)は骨と結合する(骨伝導性を示す)ため、人工骨や医用金属材料のコーティング材料として広く用いられています。しかし、その骨伝導性の発現機構の詳細は未だ明らかでありません。
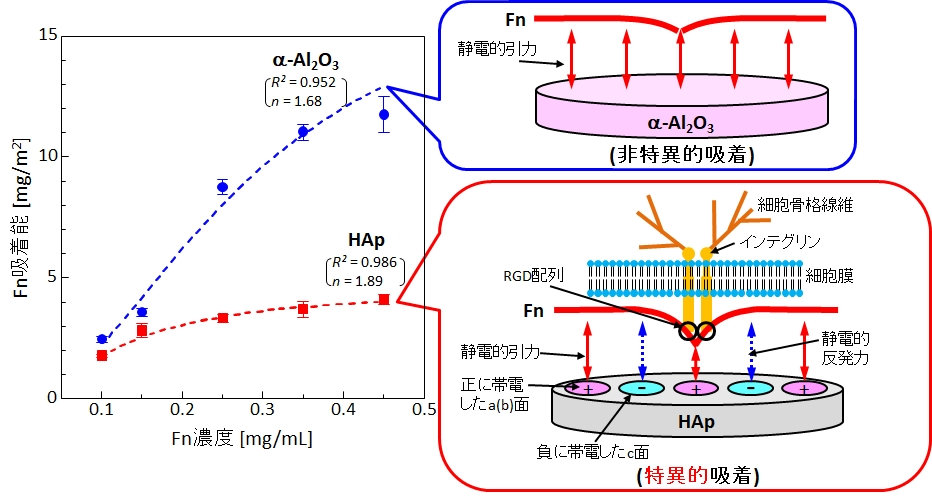
当研究室では、アルブミン、フィブロネクチン(Fn)、ラミニン(Ln)といった血清タンパク質のHApへの初期吸着に注目し、「HApに特異的に吸着する血清タンパク質が骨伝導性を引き起こすのではないか?」との仮説を立て、その検証を進めています(図10,11)。これまでに、私達は
- FnはHApよりも(骨伝導性を示さない)アルミナ(Al2O3)に多く吸着するが、LnはAl2O3よりもHApにわずかに多く吸着し、HApの結晶配向性がFnやLnの吸着に影響を及ぼす (M. Hasegawa et al., Biomed. Mater., 11 (2016) 045006; H. Fujita et al., ACS Biomater. Sci. Eng., 2 (2016) 1162)
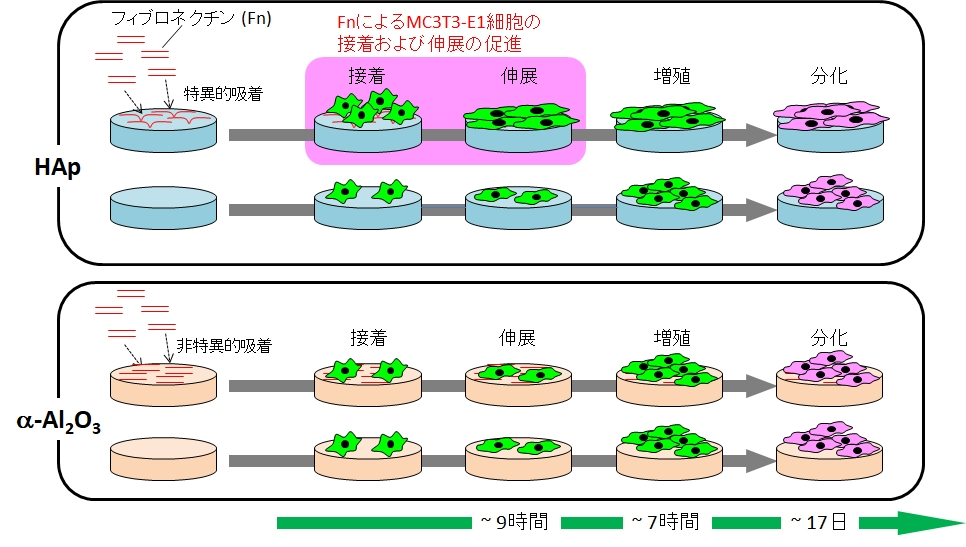
- HApに吸着したFnあるいはLnは、Al2O3に吸着したそれらよりも骨芽細胞様細胞の接着および伸展を促進することから、FnあるいはLnがHApに特異吸着し、それが骨芽細胞の接着および伸展を促進し、ひいては骨伝導性の発現に寄与している可能性がある (M. Kawashita et al., Mater. Sci. Eng. C, 69 (2016) 1268)
- HApおよびAl2O3に吸着するタンパク質のプロテオーム解析の結果、68種類のタンパク質がHApのみに吸着し、14種類のタンパク質がAl2O3よりもHApに多く吸着することから、この82(=68+14)種類のタンパク質の中にHApの骨伝導発現に寄与するタンパク質が含まれている可能性がある (第39回日本バイオマテリアル学会大会 シンポジウム2, 2017年11月21日)
ことを見出しています。
(M. Hasegawa et al., Biomed. Mater., 11 (2016) 045006より改変)
有機修飾型リン酸八カルシウムに関する研究
リン酸八カルシウム(OCP)はヒトの硬組織中に存在する水酸アパタイト(HAp)の前駆体と考えられており、硬組織に対して高い親和性を持つことから生体吸収性人工骨の素材として用いられています。OCPは層状の結晶構造を持ち、その層間に様々な有機分子を導入することができます。この性質を利用すれば、骨修復材料としての機能向上だけでなく、診断と治療を両立するセラノスティックマテリアルとしても利用できると期待されます。しかしながら、OCPが結晶中に有機分子を導入する性質についての理解は進んでおらず、有機修飾型OCPを医療材料として利用するためには、OCPの物理化学的・生物学的な性質に関する知見の充実が不可欠です。
これまでに私達は、
- 有機分子がOCPの結晶構造中に取り込まれる現象が起きる条件(Journal of the Ceramic Society of Japan, 126, 462-468 (2018).)
- 有機分子が取り込まれるナノ空間の広さの制御(Dalton Transactions, 44, 7943-7950 (2015).)
- OCPに取り込まれる有機分子の選択性(Chemical Communications, 53, 6524-6527 (2017).)
- 有機修飾型OCPの水溶液中における反応性(Chemistry Letters, 48, 855-858 (2019).)
- 有機修飾型OCPの結晶形態制御(図12)(Journal of the Ceramic Society of Japan, 118, 491$2012497 (2010).)
などに関する知見を得ています。
さらに最近の研究では蛍光性有機分子の導入にも成功し、診断と治療を両立する材料の開発に一歩ずつ近づいています。(図13)(Communications Chemistry, 4, 4 (2021).)
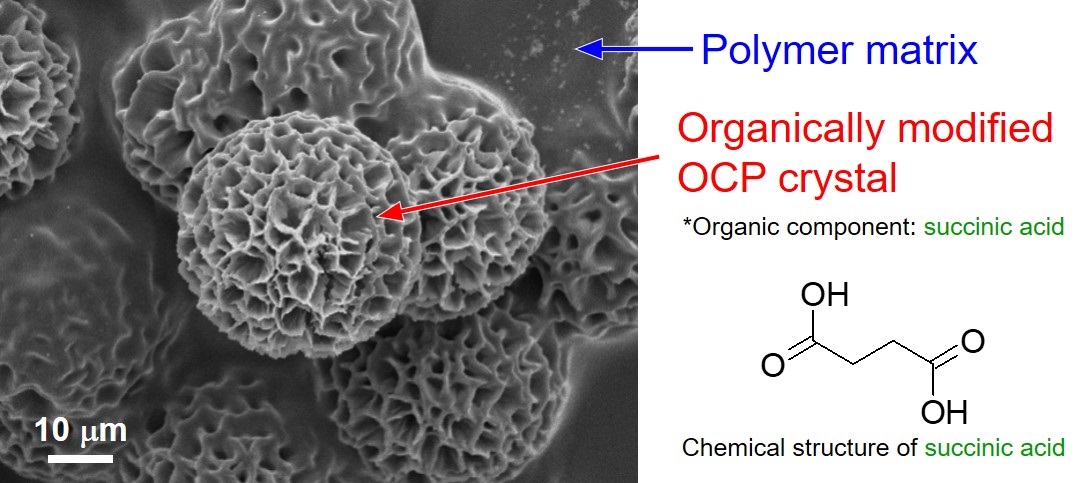
(Journal of the Ceramic Society of Japan, 118, 491$2012497 (2010).)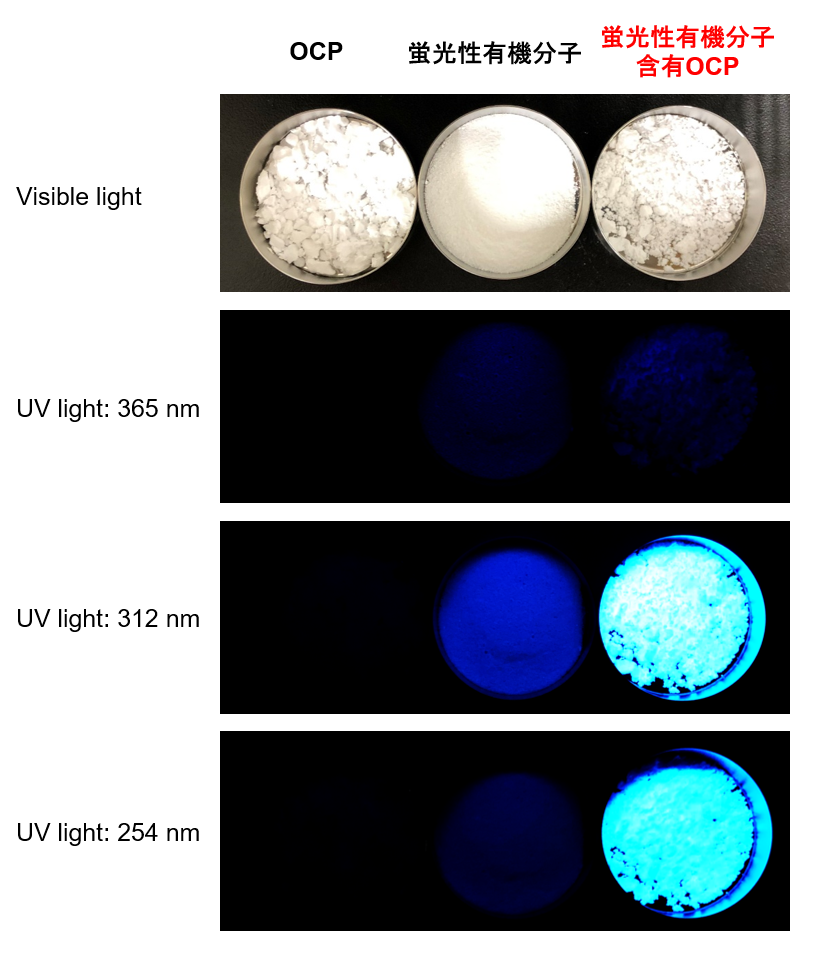
(Communications Chemistry, 4, 4 (2021).)