
1.タンパク質合成に関係する役者たち 2.リボソームの構造 3.リボソーム上での翻訳 4.タンパク質分子の構造 5.ゴルジ装置で分泌顆粒へ 関連するサイトとリンク(このページへ戻るときはブラウザーの戻るを選んでください) Protein: Life's Workhorse
更新日:2002/05/25
遺伝子(gene)の本体はDNAだったが、この遺伝情報を翻訳してタンパク質を作るためには、DNAとタンパク質の間をつなぐ役者が必要である。それがRNAである。
RNA分子がDNAと違う点は、
1)糖がデオキシリボースではなくリボースであること(五員環の2’に水酸基がつく)
2)塩基としてチミンのかわりにウラシルが使われること
3)2本鎖ではないこと
である。
すでに前回、核でリボソームをつくるときにRNAが出てきたが、リボソームの構成要素であるRNAは、rRNA(ribosomal RNA)と呼ばれる。
さらにDNAの情報を転写する場面で、mRNAが登場した。mRNAはDNAの一連の遺伝情報を読み出した一本鎖のRNAである。
最後の役者はtRNA(transfer RNA、運搬RNA)である。tRNAは次のような構造をしている。

上の図の左は実際の分子に似せた図、右はそれを模式化した図である。tRNAは一本鎖だが、分子内で塩基同士が水素結合を作っている。そのために上の図にあるような一定の形をしている。
3’末端にはアミノ酸が結合できるようになっている。どのアミノ酸が結合するかは、上の図でアンチコドンと書かれた部分の3つの塩基によって指定される。
こうして、tRNAはアンチコドンに対応するアミノ酸を運搬する役割を果たす。
リボソームは大小2つの構成単位(subunit)からできていて、それぞれの構成単位は数種のrRNAとさらに多数のタンパク質からできている(小単位は1900塩基対からなるRNAと33種類のタンパク質、大単位は4800+160塩基対のRNA複合体と120塩基対のRNAと50種類のタンパク質)。
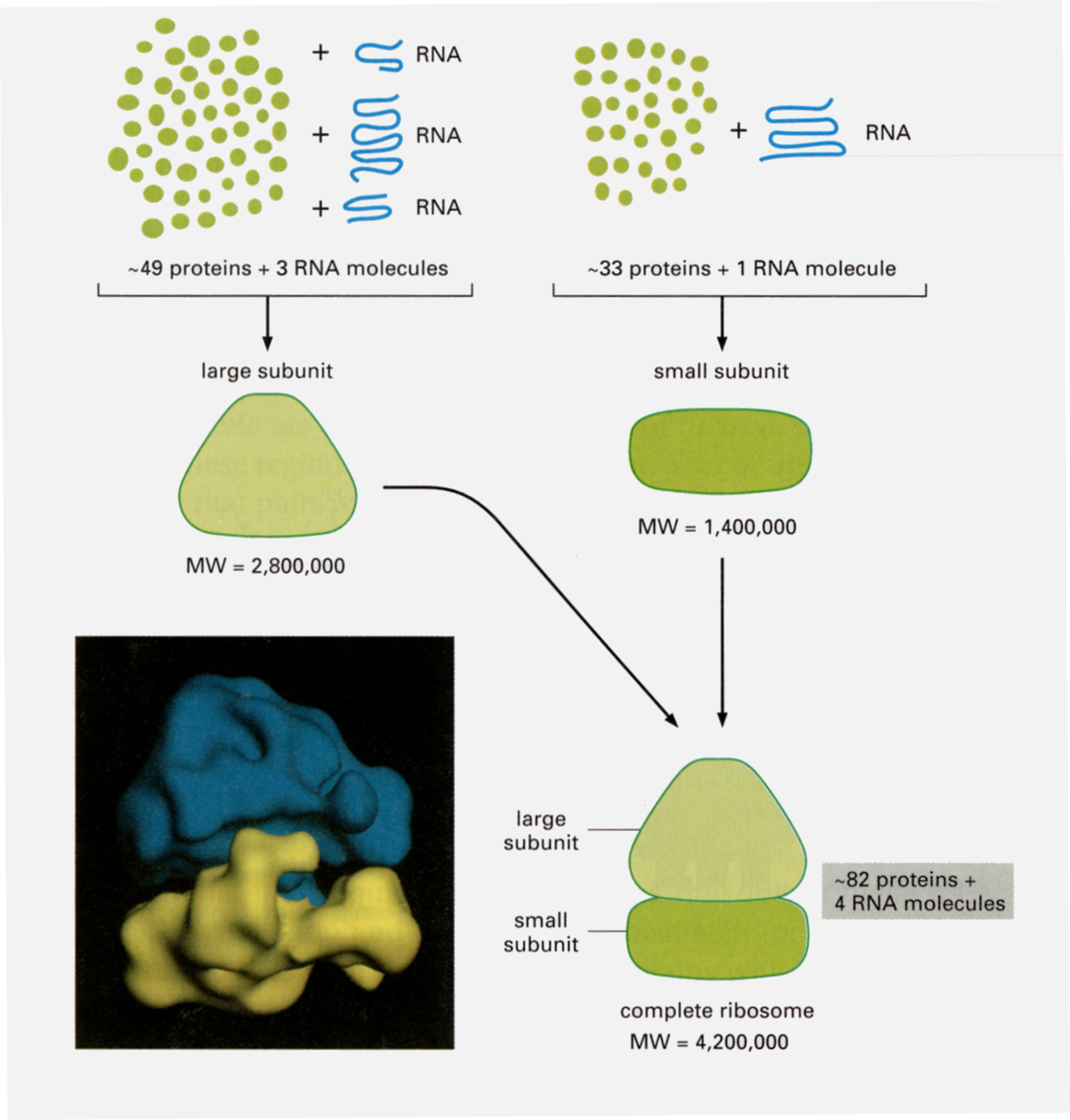
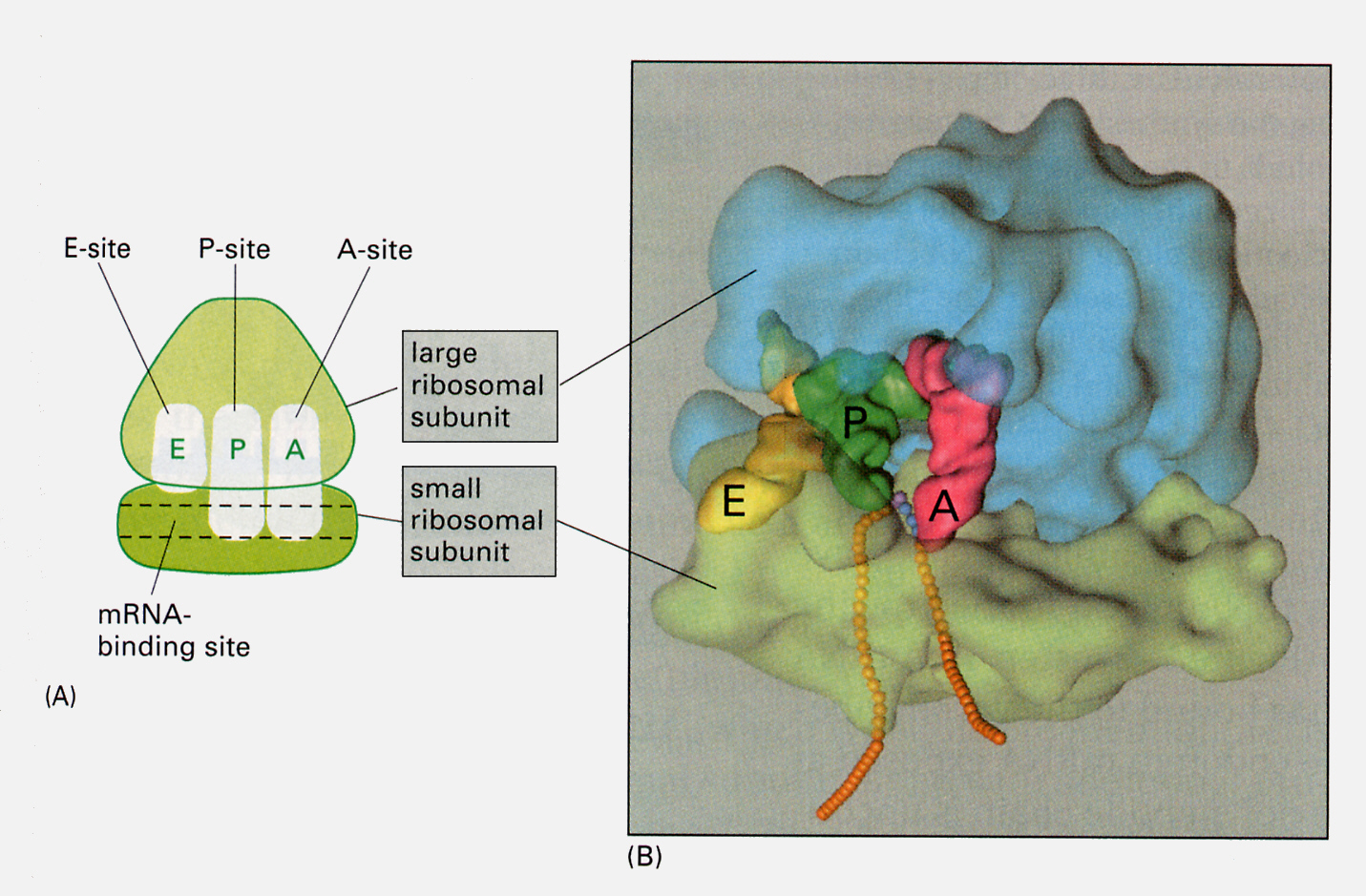
大小2つの単位はダルマのような形をとる。大単位上には、ペプチドを結合したtRNAが結合できるP-siteと、アミノ酸を結合したtRNAが結合できるA-siteがある。
関連するサイトとリンク(このページへ戻るときはブラウザーの戻るを選んでください)
Protein elongation
in a Ribosome
mRNAが核からやってくると、読み始めのコドンであるメチオニンを結合したtRNAとリボソームの大小単位が複合体を作る。メチオニン−tRNAはP-siteに結合し、アンチコドンはmRNAのAUGと結合する。
すると次にA-siteの位置に、メチオニンの次のコドンに対応するアンチコドンをもったtRNAが結合する。メチオニンはtRNAから切り離されA-siteのtRNAに結合しているアミノ酸とペプチド結合を作る。
するとP-siteのtRNAは外れ、A-siteのtRNAはmRNAと結合したまま隣りのP-siteへ移動する。
A-siteが空くので、次のtRNAが結合することができるようになる。
こうして次々とmRNAのコドンの順序にしたがってアミノ酸の鎖が伸びて行く。
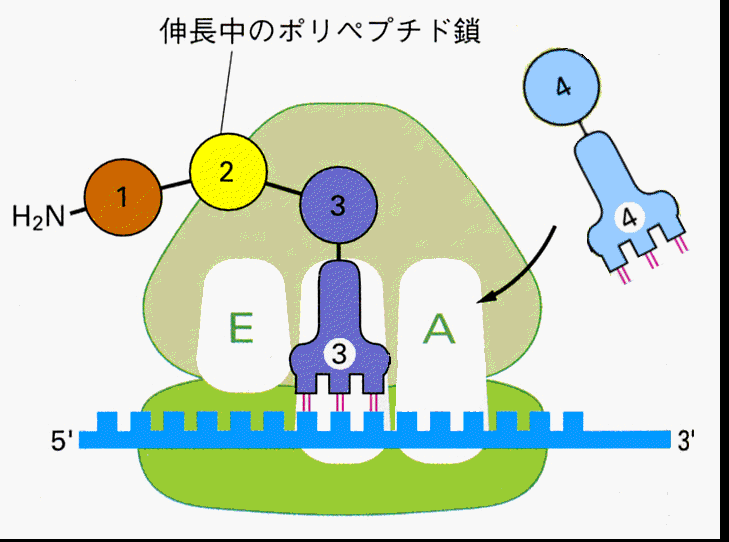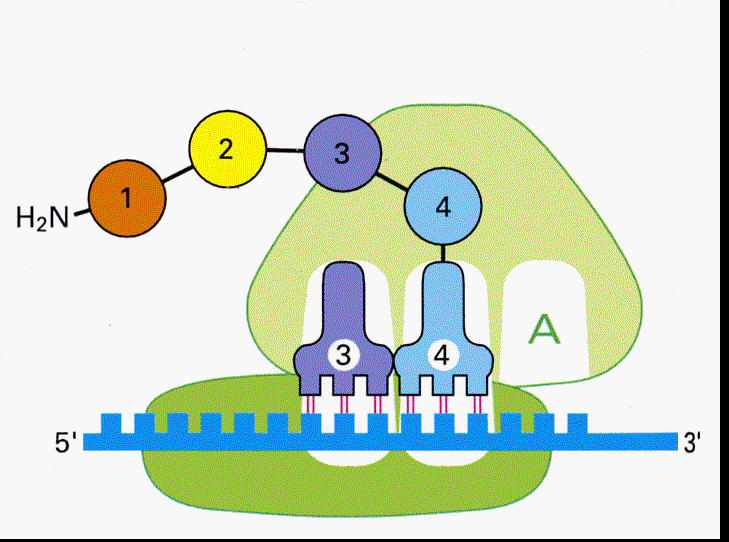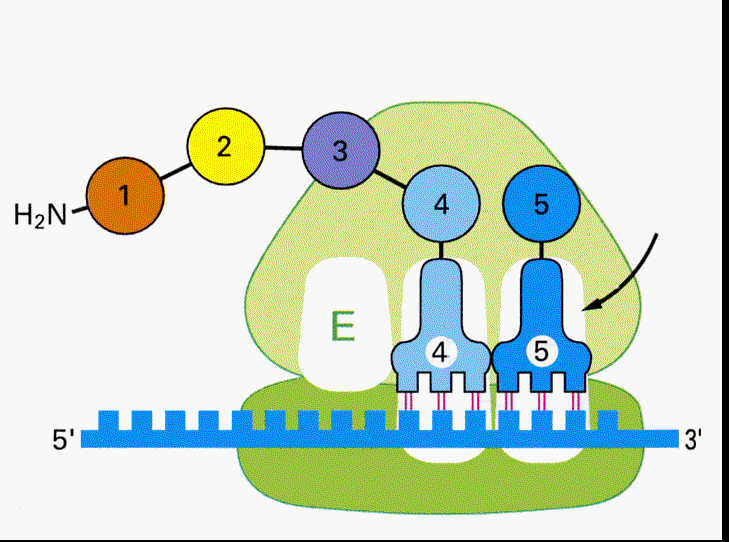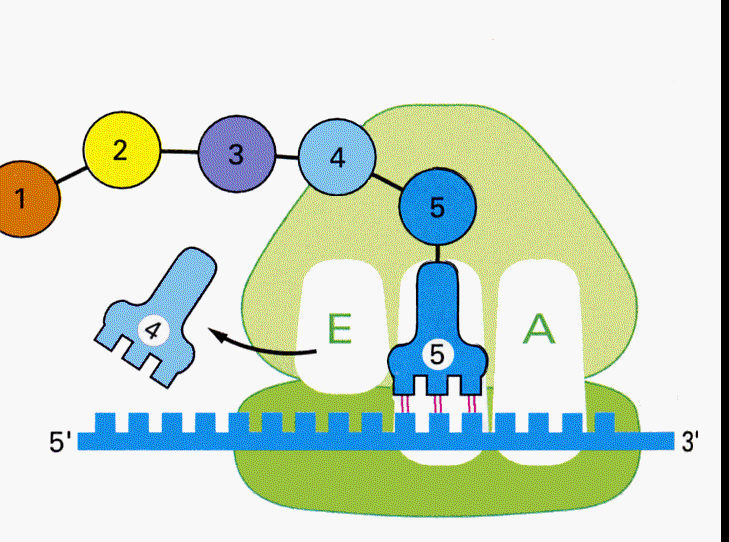
遺伝情報がアミノ酸に置き換えられて行くこの過程を、翻訳(translation)と呼ぶ。
終止コドンまでくると終止因子がこのコドンを認識して、完成したポリペプチド鎖を切り離すとともにmRNA、大小のリボソーム単位、tRNAをバラバラにする。こうして、DNAの遺伝子情報(コドン)をひとつづつ正確にミノ酸に置き換えたポリペプチド鎖が完成する。読み取り開始から終わりまで、平均して20秒から60秒ほどかかる。
翻訳の過程(WindowMediaPlayer/4.2M)(From Get*it Biology Cell Biology CD-ROM: Copyright A Monagroup Product)
ふつうは、上に述べたように1本のmRNAに1個のリボソームがついて、1本のポリペプチド鎖ができるのではなく、1本のmRNAにはたくさんのリボソームがついて次々とポリペプチド鎖を合成して行く。
このように1本のmRNAにたくさんのダルマさんがつながったようなものをポリリボソーム(あるいは単にポリソーム)という。その細胞で使われるタンパク質はその場でくるりと巻いて本来のタンパク質の形を作り、細胞質へ供給される。
上で「くるりと巻く」と書いたが、タンパク質はポリペプチド鎖がダラリと伸びた形をしているのではなく、何らかの立体構造(conformation)をとる。立体構造をとって初めて、酵素の作用など本来タンパク質がもっている機能を果たすことができる。どうして1本の鎖が決まった立体構造をとるのかを理解するためにはアミノ酸の性質を理解しなければならない。ちょっと復習をしよう。
関連するサイトとリンク(このページへ戻るときはブラウザーの戻るを選んでください)
アミノ酸の構造と化学
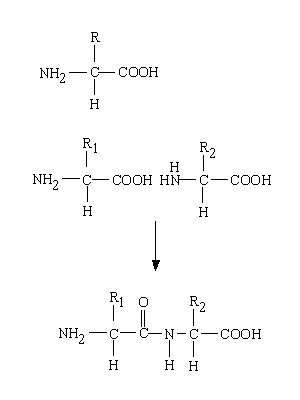
アミノ酸は上の図の一番上の構造式のように表され、その下の図のように脱水縮合してジペプチドができる。このような結合をペプチド結合(peptide bond)と呼ぶ。
結合したアミノ酸の数によって、ジペプチド(dipeptide)、トリペプチド(tripeptide)、、、、、デカペプチド(decapeptide)、、、、ポリペプチド(polypeptide)などと呼ぶ。
DNAの場合と同じように、骨格はどんなポリペプチドでも同じで、違いはRで表してある側鎖(side chain)にある。つまり、側鎖の配列(sequence)がタンパク質の性質や機能を規定していることになる。
タンパク質(ポリペプチド)におけるアミノ酸の並び方(配列、sequence)を、タンパク質の一次構造(primary structure)と呼ぶ。
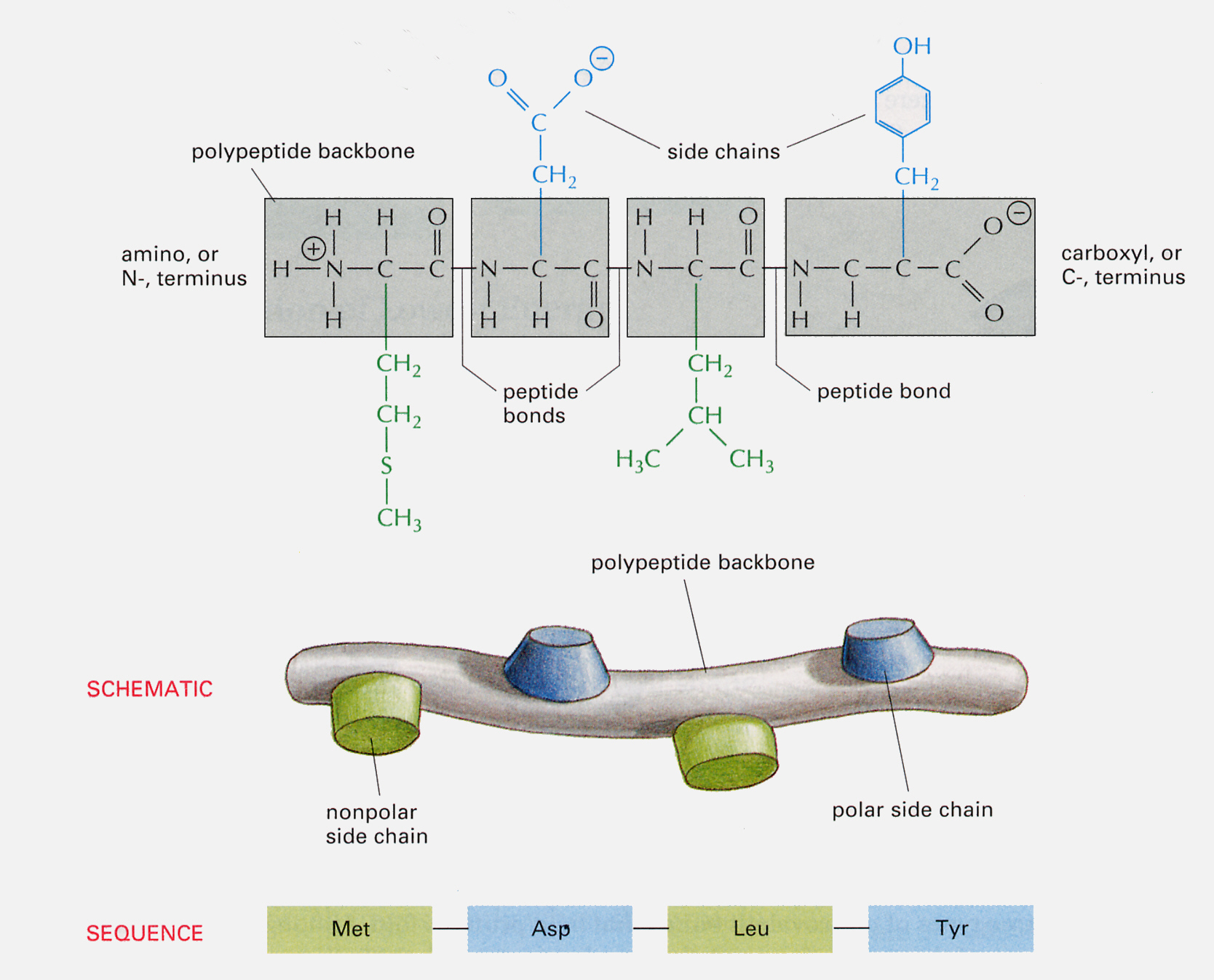
生体で見つかるアミノ酸は20種あるが、水との親和性によって大きく2つに分けられる。一つは疎水性(hydrophobic or nonpolar)、もう一つは極性(hydrophilic or polar)のある側鎖である。極性のある側鎖の場合は、さらに電荷を持つか持たないかの区別がある。すなわち側鎖は、
のように区別できる。もちろん、側鎖の分子群の大きさや形も重要である。
こうして、遺伝子の情報にしたがって1本の鎖となったポリペプチドは、ペプチド骨格内にできる水素結合によって安定したラセン構造をとり、側鎖はこのラセン構造から突き出すような構造をとる。この構造をαヘリックス(helix)構造と呼ぶ。1本の長いポリペプチド鎖では、全長にわたってαヘリックス構造をとるのではなく、ラセン構造がほどけた部分や、途中で隣り合った鎖どうしで水素結合を作るβシート(pleated sheet)構造をとる。こうした構造をとる部位は側鎖によって決まってくる。
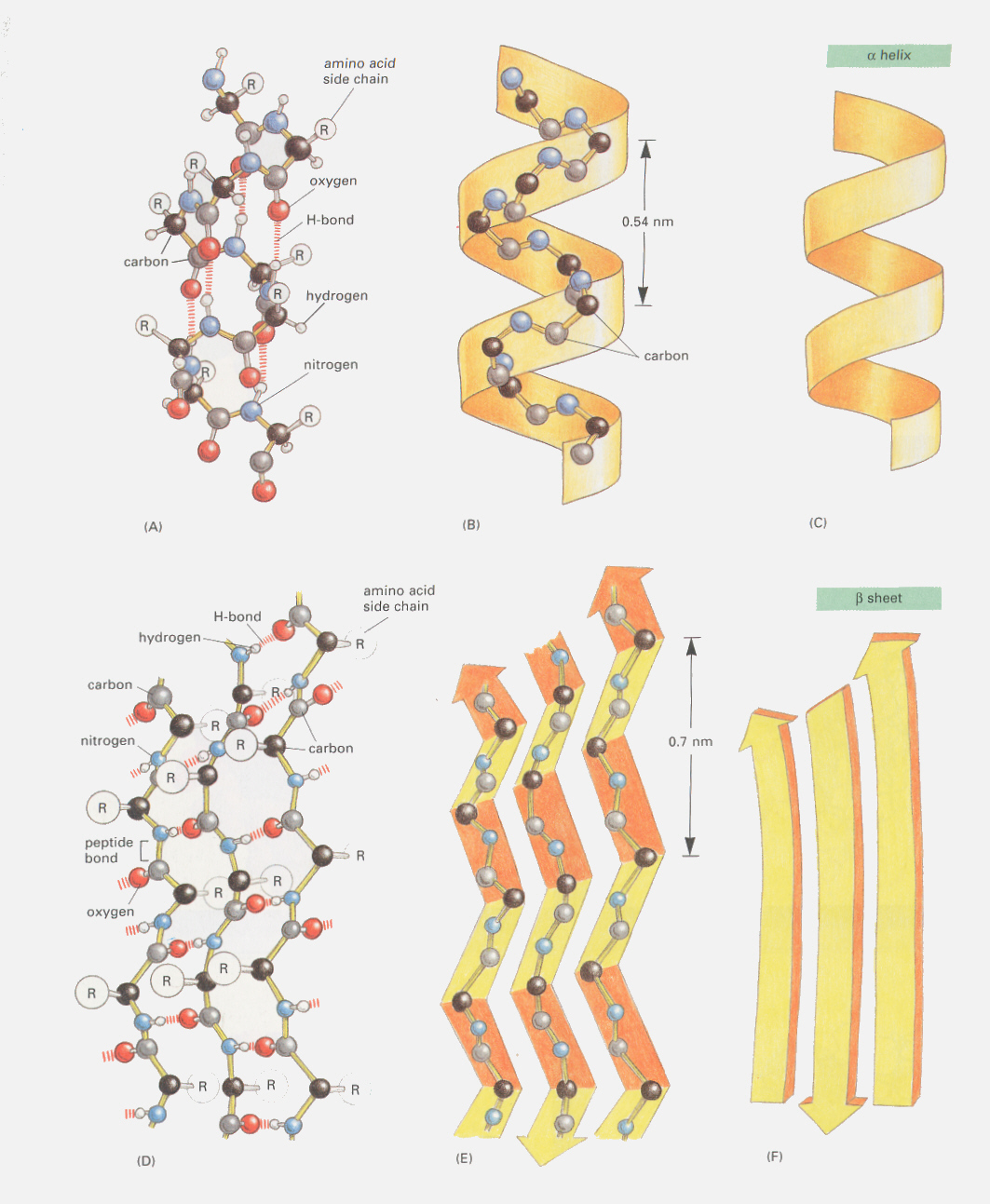
ポリペプチド鎖の一部でαへリックスやβシートを作っている部分は二次構造(secondary strucure)と呼ぶ。
関連するサイトとリンク(このページへ戻るときはブラウザーの戻るを選んでください)
Prediction:
Understanding how Proteins Fold
--------------------------------------------------------------------------------------
次の図を見るためには、下記のサイトからchimeをダウンロードして、インストールしてください(無料)。
http://www.mdlchime.com/chime/
あるいは講談社ブルーバックス「パソコンで見る動く分子事典」B1266の付録CD-ROMから同上のプラグインをインストールしてください。
chimeはブラウザーのプラグインで、分子の構造式を表示し、マウスによって回転して、いろいろな角度から分子を見たり、さまざまな表現方法を選んだりと、いろいろな使い道があります。
| On | Off | ||
| H-bonds | |||
| Highlight | |||
| Sidechains |
このαへリックスは、卵白リゾチームの4から15番目のアミノ酸残基を表示している。
4Gly
Arg Cys Glu Leu Ala Ala Ala Met Lys Arg His15
| On | Off |
||
| H-bonds | |||
| Highlight | |||
| Sidechains | |||
このβシートは卵白リゾチームの42−46、49−54、56−60番目のアミノ酸残基を表示している。
42Ala Thr Asn Arg Asn46
49Gly Ser Thr
Asp Tyr Gly54
56Leu Gln Ile
Asn Ser60
--------------------------------------------------------------------------------------
サイトゾルは水なので、極性のある側鎖は水に触れる位置に、疎水性の側鎖は水から逃れて分子の内側に位置しようとする。こうして、タンパク質は一定の三次元構造をとるのである。さらにシステイン残基が2つ近寄るとS−S結合をつくって三次元構造の安定化に寄与する。
このような三次元の構造を三次構造(tertiary structure)と呼ぶ。
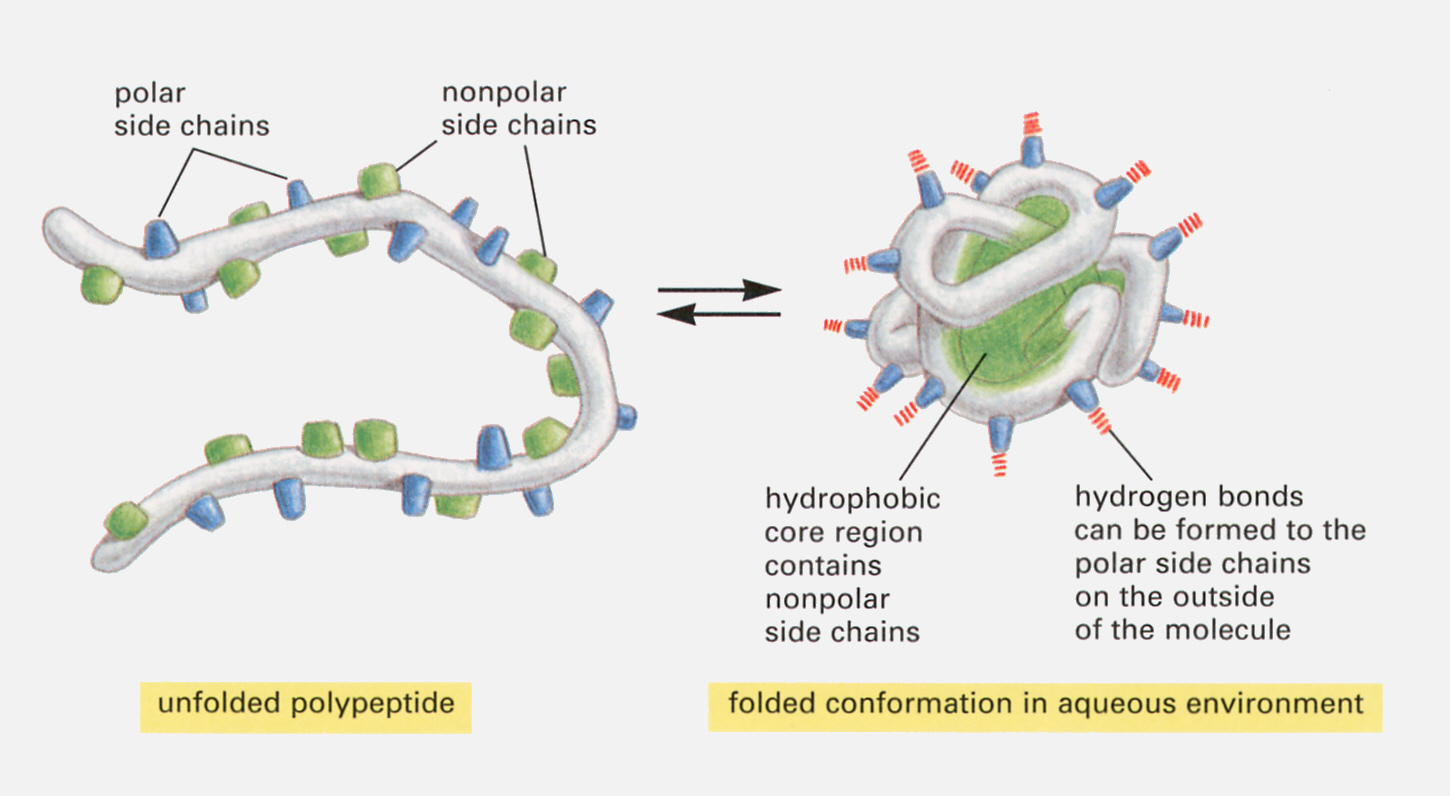
アミノ酸は3文字のアルファベットの省略形(最近では1文字)で表し、N末端を左にして次のように書くのが普通である。
Phe-Ala-Leu-His-Lys-Arg-Gly-Pro-................Pro-Ala-Thr-Cys-Ile-Gly-Tyr-Gly
--------------------------------------------------------------------------------------
次の図は、卵白リゾチームの三次構造を表示したものである。卵白リゾチームはアミノ酸残基129の一本鎖のポリペプチドで、分子量は14307の塩基性タンパク質である。4ヶ所のS-S結合があり、基質である多糖鎖が結合する活性部位は、4.5x3x3nmの側面にある溝の部分である。
卵白リゾチームの全アミノ酸配列は以下のとおりである。
1
2 3 4 5 6
7 8 9 10 11 12 13
14 15
1 Lys Val Phe Gly Arg Cys Glu Leu Ala Ala Ala Met
Lys Arg His 15
16 Gly Leu Asp Asn Tyr Arg Gly Tyr Ser Leu Gly Asn Trp Val Cys
30
31 Ala Ala Lys Phe Glu Ser Asn Phe Asn Thr Gln Ala Thr Asn Arg
45
46 Asn Thr Asp Gly Ser Thr Asp Tyr Gly Ile Leu Gln Ile Asn Ser
60
61 Arg Trp Trp Cys Asn Asp Gly Arg Thr Pro Gly Ser Arg Asn Leu
75
76 Cys Asn Ile Pro Cys Ser Ala Leu Leu Ser Ser Asp Ile Thr Ala
90
91 Ser Val Asn Cys Ala Lys Lys Ile Val Ser Asp Gly Asn Gly Met 105
106 Asn Ala Trp Val Ala Trp Arg Asn Arg Cys Lys Gly Thr Asp Val 120
121 Gln Ala Trp Ile Arg Gly Cys Arg Leu
一文字表記で表すと、次の通りである。
1
11
21
31
41 51
1 KVFGRCELAA AMKRHGLDNY RGYSLGNWVC AAKFESNFNT
QATNRNTDGS TDYGILQINS 60
61 RWWCNDGRTP GSRNLCNIPC SALLSSDITA SVNCAKKIVS DGNGMNAWVA WRNRCKGTDV
120
121 QAWIRGCRL
関連するサイトとリンク(このページへ戻るときはブラウザーの戻るを選んでください)
http://webhost.bridgew.edu/fgorga/proteins/default.htm
細胞の外へ分泌される消化酵素やホルモン、あるいは膜タンパク質などは、今まで述べたのとは少し違った作られ方をする。
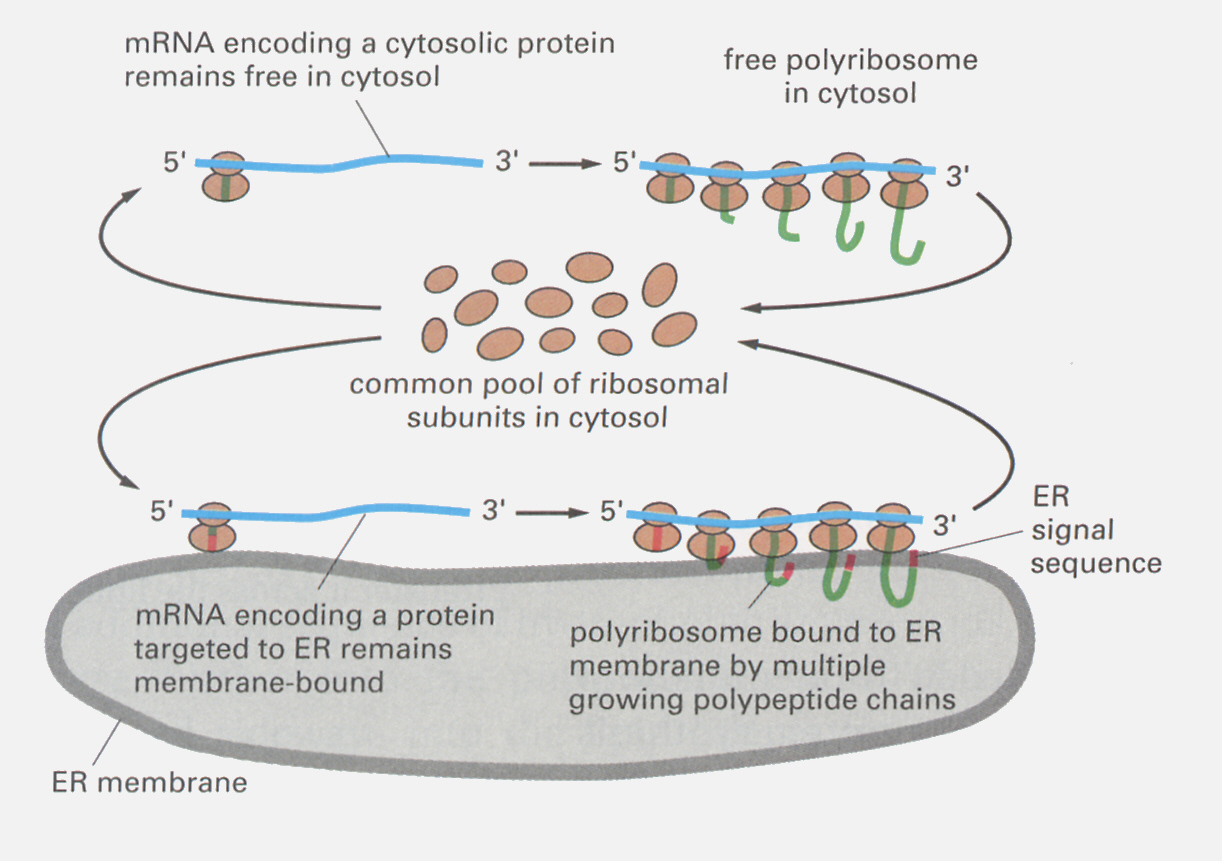
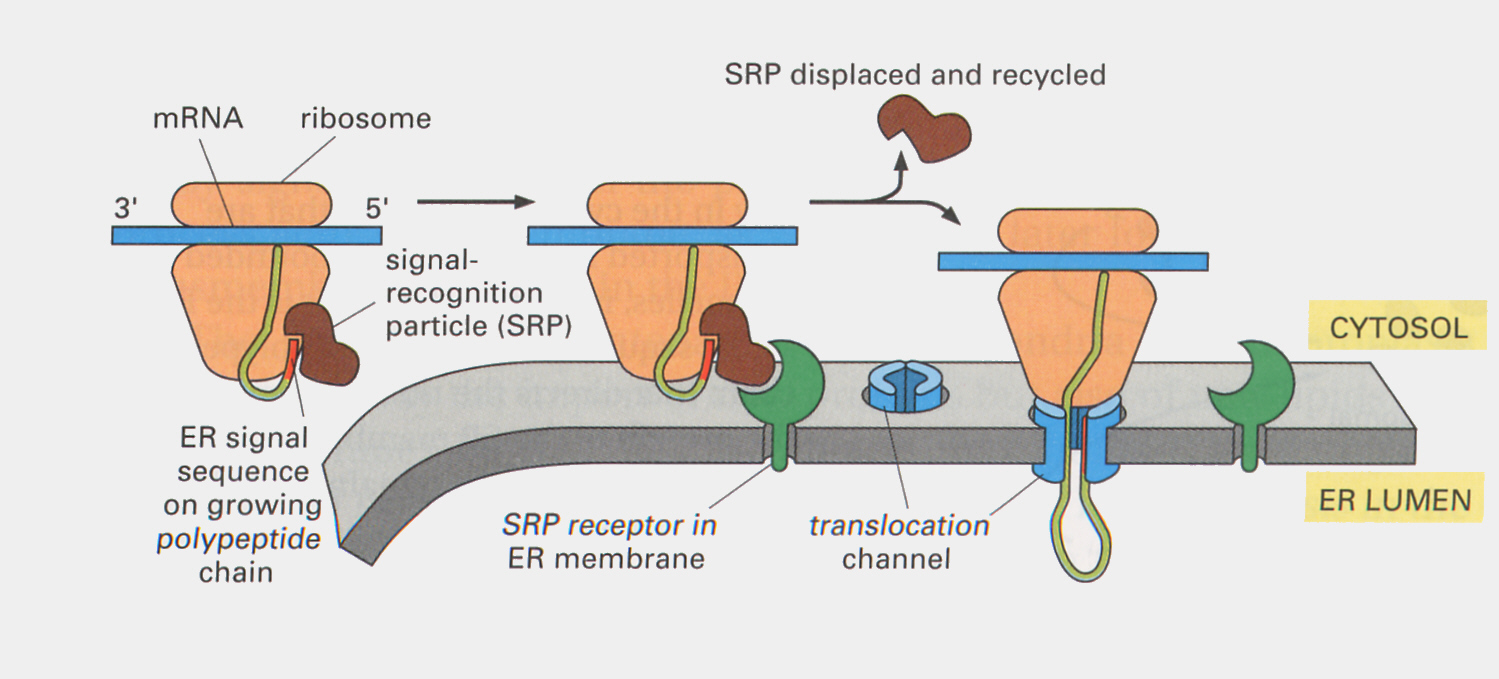
上で述べたリボソームはサイトゾルに浮かんでいるが、リボソームの中には小胞体の表面に付着したものが観察される。ホルモンなどの分泌されるポリペプチドの遺伝情報をコードするmRNAの先頭には、シグナルペプチドと呼ばれる共通のアミノ酸配列部分がある。翻訳が始まると、この先頭部分は粗面小胞体の表面に存在するシグナルペプチド受容体と結合する。そのため、活発に分泌性のポリペプチドを生産している細胞を電子顕微鏡で調べると、粗面小胞体の表面には多数のリボソームが付着しているのが観察される。伸長するポリペプチド鎖は受容体と結合した後、小胞体の空所へと取り込まれ、シグナルペプチドは取り除かれる。
ポリペプチド鎖は、小胞体の空所内で必要に応じて糖鎖などが付加された後に、小胞体のトンネルを運ばれ、顆粒となって粗面小胞体を離れ、ゴルジ装置と融合する。ゴルジ装置でさらにパックされ、分泌顆粒となって細胞内に蓄えられ、必要に応じて細胞外へ分泌される。
ゴルジ装置から細胞外へ(WindowMediaPlyaer/2.7M)
分泌されるときには、分泌顆粒は細胞膜に接近し、ついで分泌顆粒膜が細胞膜と融合し、中身が外に出て行く。この過程をエクソサイトーシス(exocytosis)と呼んでいる。
上に述べた卵白リゾチームの場合は、129アミノ酸残基に加えて18残基のシグナルペプチドが先頭に付加されている。
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
1 Met Arg Ser Leu Leu Ile Leu Val Leu Cys Phe Leu Pro Leu Ala 15
16 Ala Leu Gly Lys Val Phe Gly Arg Cys Glu Leu Ala Ala Ala Met 30
31 Lys Arg His Gly Leu Asp Asn Tyr Arg Gly Tyr Ser Leu Gly Asn 45
46 Trp Val Cys Ala Ala Lys Phe Glu Ser Asn Phe Asn Thr Gln Ala 60
61 Thr Asn Arg Asn Thr Asp Gly Ser Thr Asp Tyr Gly Ile Leu Gln 75
76 Ile Asn Ser Arg Trp Trp Cys Asn Asp Gly Arg Thr Pro Gly Ser 90
91 Arg Asn Leu Cys Asn Ile Pro Cys Ser Ala Leu Leu Ser Ser Asp 105
106 Ile Thr Ala Ser Val Asn Cys Ala Lys Lys Ile Val Ser Asp Gly 120
121 Asn Gly Met Asn Ala Trp Val Ala Trp Arg Asn Arg Cys Lys Gly 135
136 Thr Asp Val Gln Ala Trp Ile Arg Gly Cys Arg Leu