最新研究成果
清水重臣教授等 (難治病態研究部門病態細胞生物学分野)
「細胞を浄化する新たなメカニズムを発見」
"Discovery of Atg5/Atg7-independent alternative macroautophagy "
Yuya Nishida, Satoko Arakawa, Kenji Fujitani, Hirofumi Yamaguchi, Takeshi Mizuta, Toku Kanaseki, Masaaki Komatsu, Kinya Otsu, Yoshihide Tsujimoto & Shigeomi Shimizu
Nature 461, 654-658 (1 October 2009)
“オートファジー(自食作用)”とは,細胞が自己構成成分を分解・処理する生体機構を指し,酵母からヒトに至るまで、全ての真核生物が保有している。この機構は、細胞浄化(古い蛋白質やオルガネラを分解し,新陳代謝に貢献する)やストレス応答などにおいて重要な役割を果たしており,種々の疾患にも深く関連している。
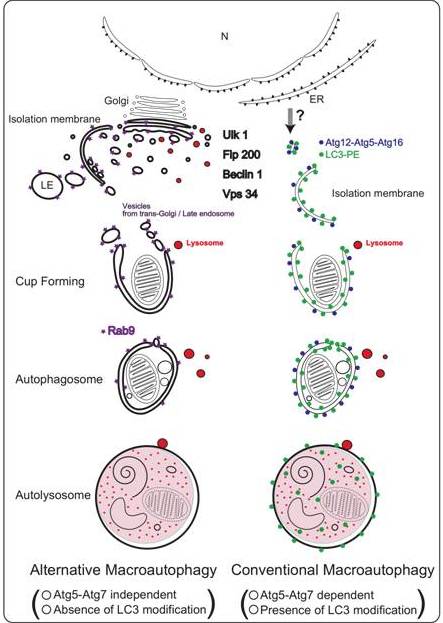
これまでは、哺乳動物におけるオーファジーの分子機構は,酵母のそれと基本的に同じ過程をたどると信じられてきた。即ち、酵母におけるオートファジーに不可欠な分子群(Atg5, Atg7, Atg8など)は、哺乳動物においてもオートファジーを支配していると考えられてきた。その結果、Atg5やAtg7を抑制する事は、オートファジーを抑制する事と同義に翻訳され、LC3(Atg8の哺乳動物相同分子)の変化の有無はオートファジー誘導の有無を示していると考えられてきた。しかし,我々は,Atg5欠損マウスが周産期まで正常であることや、哺乳動物では酵母よりも進化している可能性があることより、新たなオートファジー機構が存在しうると考えた。
実際に、野生型マウス線維芽細胞とAtg5欠損マウス線維芽細胞に,DNA傷害によるストレスを負荷しまうと,両方の細胞とも、ほぼ同程度にオートファジーが観察された。しかしながら、Atg5欠損細胞に見られるオートファジーは野生型細胞のオートファジーと異なり、LC3の変化を伴うことはなかった。これらの結果より、我々はAtg5を必要とするオートファジーを“conventional macroautophagy”新たなオートファジーを“alternative macroautophagy”と命名した。 “alternative macroautophagy”の実行には、形態学的にはtrans-Golgiとendosome(輸送小胞)の関与が示唆され、実行に関わる分子としてはUlk1、PI3kinase、Rab9などが重要であった。また、生体内では、赤血球の最終分化過程においてミトコンドリアの処理を担っていた。
今後は、分子機構の詳細を解明するとともに、生理的、病理的役割を明らかにして行く必要がある。
「細胞を浄化する新たなメカニズムを発見」
"Discovery of Atg5/Atg7-independent alternative macroautophagy "
Yuya Nishida, Satoko Arakawa, Kenji Fujitani, Hirofumi Yamaguchi, Takeshi Mizuta, Toku Kanaseki, Masaaki Komatsu, Kinya Otsu, Yoshihide Tsujimoto & Shigeomi Shimizu
Nature 461, 654-658 (1 October 2009)
“オートファジー(自食作用)”とは,細胞が自己構成成分を分解・処理する生体機構を指し,酵母からヒトに至るまで、全ての真核生物が保有している。この機構は、細胞浄化(古い蛋白質やオルガネラを分解し,新陳代謝に貢献する)やストレス応答などにおいて重要な役割を果たしており,種々の疾患にも深く関連している。
これまでは、哺乳動物におけるオーファジーの分子機構は,酵母のそれと基本的に同じ過程をたどると信じられてきた。即ち、酵母におけるオートファジーに不可欠な分子群(Atg5, Atg7, Atg8など)は、哺乳動物においてもオートファジーを支配していると考えられてきた。その結果、Atg5やAtg7を抑制する事は、オートファジーを抑制する事と同義に翻訳され、LC3(Atg8の哺乳動物相同分子)の変化の有無はオートファジー誘導の有無を示していると考えられてきた。しかし,我々は,Atg5欠損マウスが周産期まで正常であることや、哺乳動物では酵母よりも進化している可能性があることより、新たなオートファジー機構が存在しうると考えた。
実際に、野生型マウス線維芽細胞とAtg5欠損マウス線維芽細胞に,DNA傷害によるストレスを負荷しまうと,両方の細胞とも、ほぼ同程度にオートファジーが観察された。しかしながら、Atg5欠損細胞に見られるオートファジーは野生型細胞のオートファジーと異なり、LC3の変化を伴うことはなかった。これらの結果より、我々はAtg5を必要とするオートファジーを“conventional macroautophagy”新たなオートファジーを“alternative macroautophagy”と命名した。 “alternative macroautophagy”の実行には、形態学的にはtrans-Golgiとendosome(輸送小胞)の関与が示唆され、実行に関わる分子としてはUlk1、PI3kinase、Rab9などが重要であった。また、生体内では、赤血球の最終分化過程においてミトコンドリアの処理を担っていた。
今後は、分子機構の詳細を解明するとともに、生理的、病理的役割を明らかにして行く必要がある。