


1.はじめに 2.ホルモンと受容体 3.水溶性ホルモンの作用機構 4.脂溶性ホルモンの作用機構 関連するサイトとリンク(このページへ戻るときはブラウザーの戻るを選んでください) http://gened.emc.maricopa.edu/bio/bio181/BIOBK/BioBookENDOCR.html 更新日:2001年8月23日
細胞同士が情報交換する方法はいくつかあるが、主なものは次の通りである。
1)細胞同士がギャプジャンクションで接続し、小さな分子が直接、ジャンクションを通過する。
2)細胞膜の膜タンパク質を接触させて、情報交換する。
3)細胞が信号となる分子を放出する。



3)はさらに信号分子が効果を及ぼす範囲によって次の3つに分類することができる。
(1)細胞の一部が特殊化した軸索の末端から放出され、ごく狭い範囲に効果を及ぼす(neural)
(2)細胞の周囲の体液中に分泌され、比較的狭い範囲に効果を及ぼす(paracrine)
(3)細胞から血管系に放出され、体中に効果を及ぼす(endocrine)



(3)のような方式を内分泌といい、ここで使われる信号分子をホルモンと総称する。これまで述べてきたように、ホルモンは器官や組織の機能をコントロールしている。それでは、分子としてのホルモンは、どのようにして信号としての意味を相手に伝えるのだろうか。
ホルモン情報を受け取ることができるのは、細胞がそのホルモンに対する受容体(receptor)を備えているからである(上の図(3)を参照)。
このように、あるホルモンに対する受容体を備えた器官(細胞)を、そのホルモンの標的器官(細胞)(target organ, target cell)と呼ぶ。ホルモンを分泌する内分泌細胞は、普通は集合して血液の供給に富んだ腺(gland)を形成する。ホルモン分子は細胞周囲の細胞外液中へ分泌され、毛細血管を通って血流に入る。
標的器官では、ホルモン分子は毛細血管から出て細胞外液中へ入り、標的細胞の受容体に結合する。このようにホルモンの効き方は拡散と血流に依存するので、ふつう分泌されてから標的細胞に達するのに数分かかる。
ホルモンは血中で薄まるので、低い濃度でも効果を現す必要がある(通常<10 -8M)。したがってホルモン受容体は一般に親和性(affinity)が高い。
これに対して、神経伝達物質の受容体は親和性が低い。神経筋接合部ではアセチルコリンの濃度は5x10 -4Mで、親和性が低いほうが、狭い範囲にだけ効果を限局する(電話のように1:1の対応をつけるため)にはつごうがよい。拡散によって薄まり放出部位から離れると効果がなくなるからである。
ホルモン分子は、水溶性と非水溶性に分けられる。多くのホルモン(local chemical mediator、神経伝達物質も)は水溶性である。例外はステロイドホルモンと甲状腺ホルモンで、これらは脂溶性の性質を持っている。そのため血中では特別な運搬タンパク質(carrier protein)に結合して運ばれる。
水溶性ホルモンと非水溶性ホルモンの性質とふるまいには、次のような違いがある。
水溶性信号分子 →細胞膜を通らない →受容体は細胞膜表面
非水溶性信号分子 →細胞膜を通る →受容体は細胞質あるいは核内

もう一つの違いは、血中に留まっている時間である。
水溶性信号分子 →すぐに壊される
ホルモンはおよそ分のオーダー、それ以外は秒あるいはミリ秒で壊される
非水溶性信号分子 →比較的長い間血流に留まる
ステロイドは時間、甲状腺ホルモンは日のオーダー
あるホルモンが特定の作用をあらわすのは、ホルモン分子と受容体の化学的性質に依存している。すなわち、ホルモンと標的細胞の受容体には、鍵と鍵穴のような関係がなりたつ。
1)水溶性ホルモン受容体の種類
水溶性の信号分子(ホルモン、神経伝達物質、成長因子)は標的細胞の表面にある特異的な受容体と結合して、細胞内の信号に変換される。
受容体の数は、細胞1個あたり500-10万(細胞膜のタンパクの0.1%以下)である。
信号分子は、細胞の中に入って信号を伝えるのではない。エンドサイトーシス(endocytosis)によって信号分子-受容体複合体が細胞内に取り込まれることがあるが、これは分解のためである。信号分子が受容体と結合し、膜タンパク質である受容体の三次構造を変える(conformational changes)ことにより、次のステップへと信号が伝えられる。
細胞膜に埋め込まれた受容体には少なくとも3つのタイプがある。
①イオンチャンネル連結型受容体(channel-linked
receptors)
multipass transmembrane proteins、神経伝達物質の受容体
②酵素連結型受容体(catalytic receptors)
tyrosine-specific protein kinase
③Gタンパク質連結型型受容体(G protein-coupled
receptors、GPCR)
Gタンパク質の活性化を介して別の細胞膜タンパク質酵素あるいはイオンチャン
ネルを活性化する
ホルモンの受容体としては②と③が使われる。①については、神経伝達のところで述べる。ここでは③について述べてゆこう。
2)Gタンパク質連結型型受容体
これまで学習したホルモンを例にとって受容体の構造を調べてみよう。次の図は、ヒトLHRH受容体とヒトLH受容体のアミノ酸配列を一文字表記で表したものである。青い部分は7個の膜貫通ドメインをあらわす。
1 11 21 31 41 51
1 MANSASPEQN QNHCSAINNS IPLMQGNLPT LTLSGKIRVT VTFFLFLLSA TFNASFLLKL 60
61 QKWTQKKEKG KKLSRMKLLL KHLTLANLLE TLIVMPLDGM WNITVQWYAG ELLCKVLSYL 120
121 KLFSMYAPAF MMVVISLDRS LAITRPLALK SNSKVGQSMV GLAWILSSVF AGPQLYIFRM 180
181 IHLADSSGQT KVFSQCVTHC SFSQWWHQAF YNFFTFSCLF IIPLFIMLIC NAKIIFTLTR 240
241 VLHQDPHELQ LNQSKNNIPR ARLKTLKMTV AFATSFTVCW TPYYVLGIWY WFDPEMLNRL 300
301 SDPVNHFFFL FAFLNPCFDP LIYGYFSL
ヒトGnRH受容体(青い部分は膜貫通ドメイン)
1 11 21 31 41 51
1 MKQRFSALQL LKLLLLLQPP LPRALREALC PEPCNCVPDG ALRCPGPTAG LTRLSLAYLP 60
61 VKVIPSQAFR GLNEVIKIEI SQIDSLERIE ANAFDNLLNL SEILIQNTKN LRYIEPGAFI 120
121 NLPGLKYLSI CNTGIRKFPD VTKVFSSESN FILEICDNLH ITTIPGNAFQ GMNNESVTLK 180
181 LYGNGFEEVQ SHAFNGTTLT SLELKENVHL EKMHNGAFRG ATGPKTLDIS STKLQALPSY 240
241 GLESIQRLIA TSSYSLKKLP SRETFVNLLE ATLTYPSHCC AFRNLPTKEQ NFSHSISENF 300
301 SKQCESTVRK VSNKTLYSSM LAESELSGWD YEYGFCLPKT PRCAPEPDAF NPCEDIMGYD 360
361 FLRVLIWLIN ILAIMGNMTV LFVLLTSRYK LTVPRFLMCN LSFADFCMGL YLLLIASVDS 420
421 QTKGQYYNHA IDWQTGSGCS TAGFFTVFAS ELSVYTLTVI TLERWHTITY AIHLDQKLRL 480
481 RHAILIMLGG WLFSSLIAML PLVGVSNYMK VSICFPMDVE TTLSQVYILT ILILNVVAFF 540
541 IICACYIKIY FAVRNPELMA TNKDTKIAKK MAILIFTDFT CMAPISFFAI SAAFKVPLIT 600
601 VTNSKVLLVL FYPINSCANP FLYAIFTKTF QRDFFLLLSK FGCCKRRAEL YRRKDFSAYT 660
661 SNCKNGFTGS NKPSQSTLKL STLHCQGTAL LDKTRYTEC
ヒトLH受容体(赤い部分はシグナルペプチド、青い部分は膜貫通ドメイン)
このような膜7回貫通型のGタンパク質連結型受容体の構造を、模式的に表すと次のようになる。

http://www.kumc.edu/research/medicine/biochemistry/bioc800/start.htmlより
細胞外へ伸びたN末端側の鎖とループがホルモンの受容部を構成し、細胞内の鎖とループが次に述べるGタンパク質を活性化する部位となっている。
LHRH分子を模式的に描いたのが次の図である。膜貫通部は脂質二重膜に埋まり、細胞外へ出たN末端側とループと、細胞内に伸びたループと2個のアミノ酸からなるC末端側の鎖の区別ができる。
細胞外へ出た部分がLHRHを受容する部位を構成する。LHRH受容体ではC末端側の鎖は短い。

3)受容体にホルモンが結合するとGタンパク質を活性化
ホルモンが受容体と結合すると、受容体はもう一つの膜タンパク質であるGタンパク質(GTP-binding regulatory protein)を刺激する。受容体はGタンパク質と結合しているのではなく、別のユニットである。 そのためホルモンが結合した受容体は、複数のGタンパク質を活性化することができる。

http://www.kumc.edu/research/medicine/biochemistry/bioc800/start.htmlより
Gタンパク質にはいくつか種類がある。LHが結合して活性化するのはGs(stimulatory G protein)というGタンパク質である。
活性化したGタンパク質は、標的酵素であるアデニル酸シクラーゼ(adenylate cyclease)を活性化する。アデニル酸シクラーゼも別のユニットなので、Gタンパク質は複数のアデニル酸シクラーゼを活性化することができる。
Gタンパク質を介するようになったのは反応の増幅とコントロールレベルを増やすためだと考えられている。一つのホルモン分子が受容体に結合すると、上に述べたように二段階の増幅によって多数のアデニル酸シクラーゼが活性化されたことになる。このように、だんだんと下流に行くにしたがい増幅されるような反応をカスケード反応と呼んでいる。
抑制性Gタンパク質(inhibitory G protein、Gi)もあって、受容体によっては、ホルモンが結合すると抑制性Gタンパク質を活性化し、このGタンパク質はアデニル酸シクラーゼを不活性化する。
4)アデニル酸シクラーゼはcAMPを産生
活性化したアデニル酸シクラーゼは次の図の上の段の反応を触媒する。細胞質中には基質となる多数のATPがあるので、この反応は右へ進み、環状アデノシンモノリン酸(cyclic adenosine monophospahte、以下cAMPと省略)が生成する。

こうして細胞質中にはcAMPの濃度が高まる。
cAMPはcAMPホスホジエステラーゼによって加水分解されアデノシンモノリン酸になり、そのはたらきを失う(上の図の下の段)。細胞質中にいつまでもcAMPがあったらスイッチが入ったままになってしまうので、スイッチを切るはたらきが必要である。この酵素がスイッチを切るはたらきをしているのである。
ホルモンを第一のメッセンジャーと考えて、細胞の中に産生されたcAMPをセカンドメッセンジャーと呼んでいる。
5)cAMPはcAMP依存性タンパク質キナーゼを活性化
cAMPは細胞質中にあるcAMP依存性タンパク質キナーゼ(cyclic AMP-dependent protein kinase、以下Aキナーゼと省略)と結合して、この酵素を活性化する。Aキナーゼは次の標的タンパク質をリン酸化して活性化する。不活性だった酵素のスイッチを入れるようなはたらきをするのである。
LHの受容体は雄の場合、精巣の間細胞にあってテストステロンの産生を促す。LHが受容体に結合すると、これまで述べたような方式で細胞内にcAMPの濃度が高まり、Aキナーゼが活性化される。Aキナーゼは男性ホルモン合成の各段階を触媒している酵素の活性化して、原料であるコレステロールからテストステロンの合成を進めているのである。
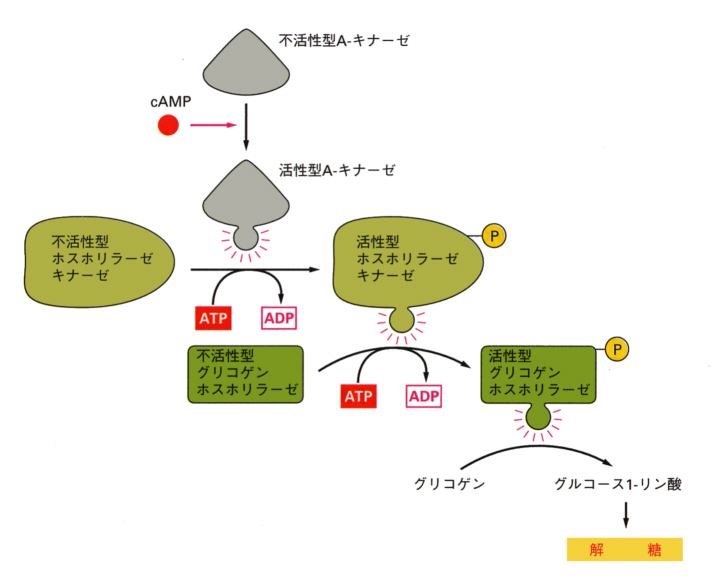
解糖の出発物質は血中から取り込んだグルコースだったが、血中へのグルコースは主として肝臓に蓄えられたグリコーゲンを分解して得られる。血糖量を増加させるためには、したがって肝臓でグリコーゲンをグルコースへ分解して血中へ放出すればいい。
グリコーゲンからグルコースへの分解は、アドレナリンとグルカゴンによって促進される。アドレナリンは肝臓細胞の膜にある細胞表面受容体に結合すると、上に述べたようにGタンパク質(Gs)が活性化され、Aキナーゼが活性化される。Aキナーゼはホスホリラーゼキナーゼを活性化し、ホスホリラーゼキナーゼはホスホリラーゼを活性化する。最後にホスホリラーゼがグリコーゲンからグルコースへの分解を触媒する。このように酵素反応の連鎖にも上に述べたカスケード反応が見られる。
6)イノシトールトリスリン酸(フォスフォイノシチド)系
(1)細胞内Caイオンの重要性
Caイオンの濃度は細胞内では10-7M、細胞外では10-3M以上である。このように細胞内Caイオンの濃度が低いのは、常に細胞膜のNa+-driven Ca2+ antiportとCa2+-ATPaseによって、Caイオンが細胞外へ排出されたり、Ca2+-ATPaseによってカルシュウム貯蔵部へ取り込まれるからである。この貯蔵部は滑面小胞体で、筋肉のところで話をした筋小胞体(sarcoplasmic reticulum)と同じものである。
このように細胞内ではCaイオンの濃度を低く抑えているので、Caイオンの濃度が細胞質内で高まると信号のはたらきをする。ホルモンの受容体のなかにも、このような方式で信号を細胞内へ伝える方式がある。LHRHがこの方式を使っている。
(2)イノシトールトリスリン酸の産生
LHRが受容体に結合すると、GsやGiとは異なる、Gタンパク質(Gq)が活性化される。このGタンパク質は細胞膜に埋め込まれたホスホリパーゼ(phosphoinositide-specific phspholipase C)を活性化する。
この酵素は、細胞膜の成分であるホスフォチジルイノシトールビスリン酸に作用して、頭部のイノシトールトリスリン酸(inisitol 1,4,5-trisphosphate、以下IP3と省略)を切り離し、細胞膜内にジアシルグリセロール(diacylglycerol)を残す。
(3)IP3は貯蔵部からCaイオンを放出
IP3は、下の図のようにCaイオンの貯蔵部である小胞体のCaイオンチャンネルに結合し、Caイオンを細胞質内に放出させる。放出されたCaイオンの一部は、カルモジュリン(Calmodulin)というCaイオン結合タンパク質と結合して情報を伝える。

カルモジュリンは1分子当たりCaイオンを4個結合し、他の酵素タンパク質と結合してその酵素を活性化する。有名なのは、Ca2+/calmodulin-dependent protein kinase (Ca-kinases)で、この酵素はタンパク質中のセリンとスレオニンをリン酸化する。
(4)ジアシルグリセロールはタンパク質キナーゼを活性化
ジアシルグリセロールは、Ca依存性のタンパク質キナーゼ(Protein Kinase C、Cキナーゼ)を活性化する。この反応に必要なCaイオンはIP3によってすでに放出されている。Cキナーゼは標的となるタンパク質をリン酸化して、活性化のスイッチを入れる。
こうしてCa濃度の上昇によって、貯蔵されていたゴナドトロピンの分泌を促すとともに、キナーゼは細胞内の種々のリン酸化反応を触媒し、ゴナドトロピンの合成を誘導する。
7)cAMPとCaは相互に関係しあう
cAMPとCaのセカンドメッセンジャー系は独立しているのではなく、相互に関係しあう。どのように関係しあうかをまとめると、次のようになる。
①細胞内のCa2+とcAMPのレベルは相互に影響されあう
Ca2+-カルモジュリン複合体は、cAMP ホォスホジエステラーゼ(phosphodiesterase)やアデニル酸シクラーゼと結合してその活性を調節し、A-Kinaseは逆にCa2+ チャンネルやポンプをリン酸化し、活性を変化させる。
②Ca-Kinaseの中にはA-Kinaseによってリン酸化されるものがある。
③A-KinaeとCa-Kinaseは同じタンパク質の異なる部位をリン酸化して調節しあうことがある。
1)ステロイドホルモンと受容体
ステロイドホルモンは菌類からヒトまでにひろく見られる信号分子で、いずれもコレステロールから合成され、分子量はおよそ300以内である。細胞膜を拡散によって通過し、細胞内受容体としかっりと結合する。



テストステロン(Ball & Stick
model) 赤:酸素、灰色:炭素、白:水素
右はテストステロン分子を横から見たもの
ステロイドホルモンは、上右図のようにほぼ平面のステロイド骨格構造を有し、官能基の位置と向きによってはたらきが異なる。
ステロイドホルモンの標的細胞はおよそ10000個の受容体を持っており、親和性(affinity)は高い。ステロイドホルモン受容体は、細胞のタンパク質の0.01%にしかならないので単離が困難であった。最近の遺伝操作法により、受容体の構造が明らかにされ、互いによく似ていることが判明した。
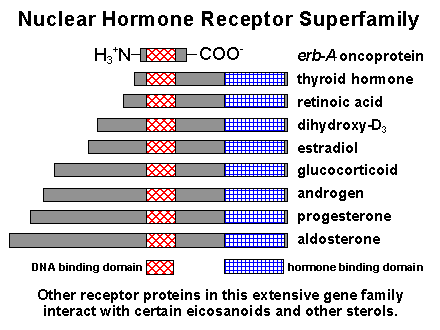
およそ800個のアミノ酸からなるポリペプチド鎖は、少なくとも3つのドメインから構成されている。N端は転写調節ドメイン、中間部はDNA結合ドメイン、C端はホルモン結合ドメインである。
次の図は、ラットアンドロジェン受容体のアミノ酸配列を一文字表記で表したものである。青い部分はDNA結合ドメイン、赤い部分はホルモン結合ドメインをあらわす。
1 11 21 31 41 51
1 MEVQLGLGRV YPRPPSKTYR GAFQNLFQSV REAIQNPGPR HPEAASIAPP GACLQQRQET 60
61 SPRRRRRQQH PEDGSPQAHI RGTTGYLALE EEQQPSQQQS ASEGHPESGC LPEPGAATAP 120
121 GKGLPQQPPA PPDQDDSAAP STLSLLGPTF PGLSSCSADI KDILSEAGTM QLLQQQQQQQ 180
181 QQQQQQQQQQ QQQQQEVISE GSSSVRAREA TGAPSSSKDS YLGGNSTISD SAKELCKAVS 240
241 VSMGLGVEAL EHLSPGEQLR GDCMYASLLG GPPAVRPTPC APLAECKGLS LDEGPGKGTE 300
301 ETAEYSSFKG GYAKGLEGES LGCSGSSEAG SSGTLEIPSS LSLYKSGAVD EAAAYQNRDY 360
361 YNFPLALSGP PHPPPPTHPH ARIKLENPSD YGSAWAAAAA QCRYGDLASL HGGSVAGPST 420
421 GSPPATASSS WHTLFTAEEG QLYGPGGGGG SSSPSDAGPV APYGYTRPPQ GLASQEGDFS 480
481 ASEVWYPGGV VNRVPYPSPS CVKSEMGPWM ENYSGPYGDM RLDSTRDHVL PIDYYFPPQK 540
541 TCLICGDEAS GCHYGALTCG SCKVFFKRAA EGKQKYLCAS RNDCTIDKFR RKNCPSCRLR 600
601 KCYEAGMTLG ARKLKKLGNL KLQEEGENSS AGSPTEDPSQ KMTVSHIEGY ECQPIFLNVL 660
661 EAIEPGVVCA GHDNNQPDSF AALLSSLNEL GERQLVHVVK WAKALPGFRN LHVDDQMAVI 720
721 QYSWMGLMVF AMGWRSFTNV NSRMLYFAPD LVFNEYRMHK SRMYSQCVRM RHLSQEFGWL 780
781 QITPQEFLCM KALLLFSIIP VDGLKNQKFF DELRMNYIKE LDRIIACKRK NPTSCSRRFY 840
841 QLTKLLDSVQ PIARELHQFT FDLLIKSHMV SVDFPEMMAE IISVQVPKIL SGKVKPIYFH 900
901 TQ

ラットアンドロジェン受容体のホルモン結合部分の構造模型
右下に薄くステロイド骨格が見える
ステロイドが結合すると、受容体の立体構造(conformation)が変わって、DNAと結合できるようになり、転写調節因子として特定の遺伝子の転写を活性化する。
エストロジェンやプロジェストロン、甲状腺ホルモンも非常によく似た受容体に同じ様に結合する。レチノイン酸やビタミンD3の受容体もよく似ている。
以下のアミノ酸配列は核受容体データベースで検索して転載した。
1 11 21 31 41 51
1 MTMTLHTKAS GMALLHQIQG NELEPLNRPQ LKMPMERALG EVYVDNSKPA VFNYPEGAAY 60
61 EFNAAAAAAA AGASAPVYGQ SSITYGPGSE AAAFGANSLG AFPQLNSVSP SPLMLLHPPP 120
121 HVSPFLHPHG HQVPYYLENE PSAYAVRDTG PPAFYRSNSD NRRQNGRERL SSSSEKGNMI 180
181 MESAKETRYC AVCNDYASGY HYGVWSCEGC KAFFKRSIQG HNDYMCPATN QCTIDKNRRK 240
241 SCQACRLRKC YEVGMMKGGI RKDRRGGRML KHKRQRDDLE GRNEMGTSGD MRAANLWPSP 300
301 LVIKHTKKNS PALSLTADQM VSALLDAEPP LIYSEYDPSR PFSEASMMGL LTNLADRELV 360
361 HMINWAKRVP GFGDLNLHDQ VHLLECAWLE ILMIGLVWRS MEHPGKLLFA PNLLLDRNQG 420
421 KCVEGMVEIF DMLLATSSRF RMMNLQGEEF VCLKSIILLN SGVYTFLSST LKSLEEKDHI 480
481 HRVLDKINDT LIHLMAKAGL TLQQQHRRLA QLLLILSHIR HMSNKGMEHL YNMKCKNVVP 540
541 LYDLLLEMLD AHRLHAPASR MGVPPEEPSQ SQLTTTSSTS AHSLQTYYIP PEAEGFPNTI
ラットエストロジェン受容体(青い部分はDNA結合ドメイン、赤い部分はホルモン結合ドメイン)
1 11 21 31 41 51
1 MTELQAKDPR TLHTSGAAPS PTHVGSPLLA RLDPDPFQGS QHSDASSVVS PIPISLDRLL 60
61 FSRSCQAQEL PDEKTQNQQS LSDVEGAFSG VEASRRRSRN PRAPEKDSRL LDSVLDTLLA 120
121 PSGPEQSQTS PPACEAITSW CLFGPELPED PRSVPATKGL LSPLMSRPES KAGDSSGTGA 180
181 GQKVLPKAVS PPRQLLLPTS GSAHWPGAGV KPSQQPATVE VEEDGGLETE GSAGPLLKSK 240
241 PRALEGMCSG GGVTANAPGA APGGVTLVPK EDSRFSAPRV SLEQDAPVAP GRSPLATTVV 300
301 DFIHVPILPL NHALLAARTR QLLEGDSYDG GAAAQVPFAP PRGSPSAPSP PVPCGDFPDC 360
361 TYPPEGDPKE DGFPVYGEFQ PPGLKIKEEE EGTEAASRSP RPYLLAGASA ATFPDFPLPP 420
421 RPPRAPPSRP GEAAVAAPSA AVSPVSSSGS ALECILYKAE GAPPTQGSFA PLPCKPPAAS 480
481 SCLLPRDSLP AAPTSSAAPA IYPPLGLNGL PQLGYQAAVL KDSLPQVYPP YLNYLRPDSE 540
541 ASQSPQYGFD SLPQKICLIC GDEASGCHYG VLTCGSCKVF FKRAMEGQHN YLCAGRNDCI 600
601 VDKIRRKNCP ACRLRKCCQA GMVLGGRKFK KFNKVRVMRA LDGVALPQSV AFPNESQTLG 660
661 QRITFSPNQE IQLVPPLINL LMSIEPDVVY AGHDNTKPDT SSSLLTSLNQ LGERQLLSVV 720
721 KWSKSLPGFR NLHIDDQITL IQYSWMSLMV FGLGWRSYKH VSGQMLYFAP DLILNEQRMK 780
781 ELSFYSLCLT MWQIPQEFVK LQVTHEEFLC MKVLLLLNTI PLEGLRSQSQ FEEMRSSYIR 840
841 ELIKAIGLRQ KGVVPSSQRF YQLTKLLDSL HDLVKQLHLY CLNTFIQSRA LAVEFPEMMS 900
901 EVIAAQLPKI LAGMVKPLLF HKK
ラットプロジェステロン受容体(青い部分はDNA結合ドメイン、赤い部分はホルモン結合ドメイン)
1 11 21 31 41 51
1 MNYCMQEIYE VHPAAGSNCY MQSTDYYAYF EDSPGYSGCD AQAVPSNNIY MEQAWAVNQP 60
61 YTCSYPGNMF KSKDSDLDMA LNQYSQPEYF TEEKPTFSQV QSPSYSQKKG YIPSYLDKDE 120
121 LCVVCGDKAT GYHYRCITCE GCKGFFRRTI QKNLHPSYSC KYEGKCVIDK VTRNQCQECR 180
181 FKKCIYVGMA TDLVLDDSKR LAKRKLIEEN REKRRREELQ KSIGHKPEPT DEEWELIKTV 240
241 TEAHVATNAQ GSHWKQKPKF LPEDIGQAPI VNAPEGGKVD LEAFSHFTKI ITPAITRVVD 300
301 FAKKLPMFCE LPCEDQIILL KGCCMEIMSL RAAVRYDPES ETLTLNGEMA VTRGQLKNGG 360
361 LGVVSDAIFD LGMSLSSFNL DDTEVALLQA VLLMSSDRPG LACVERIEKY QDSFLLAFEH 420
421 YINYRKHHVT HFWPKLLMKV TDLRMIGACH ASRFLHMKVE CPTELLPPLF LEVFED
ヒト甲状腺ホルモン受容体β2(青い部分はDNA結合ドメイン、赤い部分はホルモン結合ドメイン)
1 11 21 31 41 51
1 MASNSSSCPT PGGGHLNGYP VPPYAFFFPP MLGGLSPPGA LTTLQHQLPV SGYSTPSPAT 60
61 IETQSSSSEE IVPSPPSPPP LPRIYKPCFV CQDKSSGYHY GVSACEGCKG FFRRSIQKNM 120
121 VYTCHRDKNC IINKVTRNRC QYCRLQKCFE VGMSKESVRN DRNKKKKEVP KPECSESYTL 180
181 TPEVGELIEK VRKAHQETFP ALCQLGKYTT NNSSEQRVSL DIDLWDKFSE LSTKCIIKTV 240
241 EFAKQLPGFT TLTIADQITL LKAACLDILI LRICTRYTPE QDTMTFSDGL TLNRTQMHNA 300
301 GFGPLTDLVF AFANQLLPLE MDDAETGLLS AICLICGDRQ DLEQPDRVDM LQEPLLEALK 360
361 VYVRKRRPSR PHMFPKMLMK ITDLRSISAK GAERVITLKM EIPGSMPPLI QEMLENSEGL 420
421 DTLSGQPGGG GRDGGGLAPP PGSCSPSLSP SSNRSSPATH SP
ヒトレチノイン酸受容体α(青い部分はDNA結合ドメイン、赤い部分はリガンド結合ドメイン)
1 11 21 31 41 51
1 MEATAASTSL PDPGDFDRNV PRICGVCGDR ATGFHFNAMT CEGCKGFFRR SMKRKALFTC 60
61 PFNGDCRITK DNRRHCQACR LKRCVDIGMM KEFILTDEEV QRKREMIMKR KEEEALKDSL 120
121 RPKLSEEQQH IIAILLDAHH KTYDPTYADF RDFRPPVRMD GSTGSYSPRP TLSFSGNSSS 180
181 SSSDLYTTSL DMMEPSGFSN LDLNGEDSDD PSVTLDLSPL SMLPHLADLV SYSIQKVIGF 240
241 AKMIPGFRDL TSDDQIVLLK SSAIEVIMLR SNQSFTMDDM SWDCGSQDYK YDVTDVSKAG 300
301 HTLELIEPLI KFQVGLKKLN LHEEEHVLLM AICIVSPDRP GVQDAKLVEA IQDRLSNTLQ 360
361 TYIRCRHPPP GSHQLYAKMI QKLADLRSLN EEHSKQYRSL SFQPENSMKL TPLVLEVFGN 420
421 EIS
ラットビタミンD3受容体(青い部分はDNA結合ドメイン、赤い部分はリガンド結合ドメイン)
これら一群の受容体を、細胞質受容体スーパーファミリーと呼んでいる。
2)ステロイドホルモン受容体複合体は遺伝子の転写を制御
受容体は細胞質にあるが、ホルモンが結合すると核に入って、ニ量体となって特定のヌクレオチドと結合し、転写を開始させる。結合部分のモチーフはZnフィンガーである。

受容体が結合するのは、少数のヌクレオチド配列でホルモン応答エレメント(hormone response element、HRE)と言う。
エストロジェンのHREは、5’-AGGTCAnnnTGACCT-3’(上の図の色の付いた塩基の相当する。nは何でもいい)である。
この配列を除くと転写は起こらなくなるし、この配列を本来ホルモンとは関係ない遺伝子の上流に埋め込むと、ステロイドによって転写が起こるようになる。受容体が結合する場所は多くの場合、コード領域の上流で、何箇所か存在する。転写を開始させるとともに、転写の促進がおこる。
こうしてできたmRNAは核外に出て、タンパク質に翻訳される。
ステロイドホルモンの効果には、一次反応(primary response)と二次反応(secondary response)に分けられる。
一次反応は、ステロイド受容体複合体が遺伝子に働いて、新しいタンパク質の転写と翻訳を起こし、このタンパク質が特定の働きを示す場合である。ホルモン量が減少すれば、ホルモンの効果はなくなり、可逆的である。
一方、二次反応は、一次反応で最初に作られたタンパク質が転写調節タンパク質で、これが再び別の遺伝子に働いて、ニ次的にタンパク質の転写と翻訳を促す場合である。発生に伴ってステロイドホルモンや甲状腺ホルモンやレチノイン酸による不可逆的な形態の形成が行われるが、これは二次的なタンパクによるものだと考えられている。二次反応の場合は、非可逆的である。
これまで述べたように、ステロイドホルモンは遺伝子に働いてその作用を表す場合が多い。これをgenomicな作用という。ステロイドホルモンにはこれ以外にnon-genomicな素早い反応をひきおこすはたらきがある。詳しいことは不明だが、細胞膜に受容体があると言われている。
ページ先頭へ戻る
![]() この章のpdfファイルをダウンロードするには、左のアイコンを右クリックしてください。
この章のpdfファイルをダウンロードするには、左のアイコンを右クリックしてください。