- Abe, C., K. Iwai, R. Mikami, et al.
Frequent
isolation of Propionibacterium acnes from sarcoidosis lymph nodes.
Zentbl. Bakteriol. Mikrobiol. Hyg. A 1984; 256: 541-547.
- Ishige I, Usui Y, Takemura T, et
al. Quantitative
PCR of mycobacterial and propionibacterial DNA in lymph nodes of
Japanese patients with sarcoidosis. Lancet 1999; 354: 120-123.
- Eishi Y, Suga M, Ishige I, et al.
Quantitative
analysis of mycobacterial and propionibacterial DNA in lymph nodes from
Japanese and European patients with sarcoidosis. J Clin Microbiol 2002;
40: 198-204.
- Yamada T, Eishi Y, Ikeda S, et al.
In situ
localization of Propionibacterium acnes DNA in lymph nodes from
sarcoidosis patients by signal amplification with catalysed reporter
deposition. J Pathol 2002; 198: 541-547.
- Negi M, Takemura T, Guzman J, et
al. Localization
of Propionibacterium acnes in granulomas supports a possible etiologic
link between sarcoidosis and the bacterium. Modern Pathology 2012; 25:
(in press).
- Ebe Y, Ikushima S, Yamaguchi T, et
al.
Proliferative response of peripheral blood mononuclear cells and levels
of antibody to recombinat protein from Propionibacterium acnes DNA
expression library in Japanese patients with sarcoidosis. Sarcoidosis
Vasc Diffuse Lung Dis 2000; 17: 256-265.
- Minami J, Eishi Y, Ishige Y, et al.
Pulmonary
granulomas caused experimentally in mice by a recombinant
trigger-factor protein of Propionibacterium acnes. J Med Dent Sci 2003;
50: 245-252.
- Ishige I, Eishi Y, Takemura T, et
al.
Propionibacterium acnes as the most common bacterium commensal in
peripheral lung tissue and mediastinal lymph nodes from subjects
without sarcoidosis. Sarcoidosis Vasc Diffuse Lung Dis, 2005; 22: 33-42.
- Nishiwaki T, Yoneyama H, Eishi Y,
et al.
Indigenous pulmonary Propionibacterium acnes primes the host in the
development of sarcoid-like pulmonary granulomatosis in mice. Am J
Pathol 2004; 165: 631-639.
- Eishi Y. Propionibacteria as a
cause of
sarcoidosis. In “Sarcoidosis”, ed. by Baughman R. Marcel Dekker, New
York, 2006: 277-296.
- Bachelez H, Senet P, Cadranel J, et
al. The use
of tetracyclines for the treatment of sarcoidosis. Arch Dermatol 2001;
137: 69-73.
- Baba K, Yamaguchi E, Matsui S, et
al. A case of
sarcoidosis with multiple endobronchial mass lesions that disappeared
with antibiotics. Sarcoidosis Vasc Diffuse Lung Dis 2006; 23: 78-79.
- Park DJ, Woog JJ, Pulido JS, et al.
Minocycline
for the treatment of ocular and ocular adnexal sarcoidosis. Arch
Ophthalmol 2007; 125: 705-709.
- Miyazaki E, Ando M, Fukami T, et
al. Minocycline
for the treatment of sarcoidosis: is the mechanism of action
immunomodulating or antimicrobial effect? Clin Rheumatol 2008; 27:
1195-1197.
- Marshall TG, Marshall FE.
Sarcoidosis succumbs to
antibiotics--implications for autoimmune disease. Autoimmun Rev 2004;
3: 295-300.
- The Marshall Protocol Study Site,
Autoimmunity
Research Foundation http://www.marshallprotocol.com
|










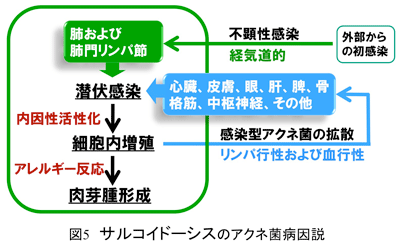
 サルコイドーシス病変部から分離培養可能な唯一の微生物がアクネ菌であることは1970年代から知られている。阿部らの報告1では分離頻度は78%、その後の培地改良により92%と上昇し、活動性患者病巣材料からは
ほぼ全例に分離されている。ところが他疾患リンパ節でもその21%
に本菌が検出されたこと
から、培養結果のみでアクネ菌を原因細菌と特定することはできなかった。定量系PCR法
を用いた定量解析2では、本症リンパ節か
らアクネ菌
(Propionibacterium acnes)あるいはP.
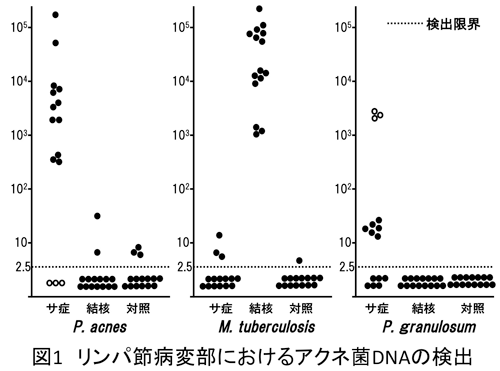
granulosum由来のDNAが例外なく検出され、その検出量は結核症における結核菌DNA量に匹敵するほど多量であった(図1)。先の培養結果と同様に、対照群リンパ節でも一部にアクネ菌が検出されたがその検出量は微量であった。国際共同研究では結核菌原因説が主流である欧米諸国の患者においてもアクネ菌が原因となっている可能性が示唆された3。その後、高感度ISH法を用いた解析から、アクネ菌DNAが肉芽腫内部に集積して存在することも明らかとなった4。
サルコイドーシス病変部から分離培養可能な唯一の微生物がアクネ菌であることは1970年代から知られている。阿部らの報告1では分離頻度は78%、その後の培地改良により92%と上昇し、活動性患者病巣材料からは
ほぼ全例に分離されている。ところが他疾患リンパ節でもその21%
に本菌が検出されたこと
から、培養結果のみでアクネ菌を原因細菌と特定することはできなかった。定量系PCR法
を用いた定量解析2では、本症リンパ節か
らアクネ菌
(Propionibacterium acnes)あるいはP.
granulosum由来のDNAが例外なく検出され、その検出量は結核症における結核菌DNA量に匹敵するほど多量であった(図1)。先の培養結果と同様に、対照群リンパ節でも一部にアクネ菌が検出されたがその検出量は微量であった。国際共同研究では結核菌原因説が主流である欧米諸国の患者においてもアクネ菌が原因となっている可能性が示唆された3。その後、高感度ISH法を用いた解析から、アクネ菌DNAが肉芽腫内部に集積して存在することも明らかとなった4。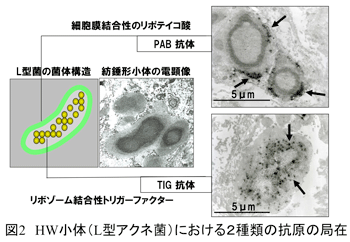 病変部
リンパ節の組織懸濁液をマウスに免疫することで、肉芽腫内部に存在するサ症起因体に対し単クローン抗体が作成された。本抗体は、結核菌や他の一般細菌類と
はまったく反応せずアクネ菌と特異的に反応する。サルコイドーシス病変部に反応するアクネ菌・単クローン抗体はこれまでに2種類完成している5。PAB抗体はアクネ菌に特異的な抗体で、菌体細胞膜から細胞壁を貫いて分布するリポタイコ酸と呼ばれる糖脂質抗原を認識する。他方、TIG抗体もアクネ菌に高い特異性を示し、細胞質内に多量に存在するリボゾーム結合性シャペロン蛋白トリガーファクターを認識す2つの抗体はいずれも、結核菌を含むマイコバクテリアには反応せず、他の一般細菌ともまったく反応しない。サ
ルコイドーシスリンパ節に高率に出現する抗酸性の大型紡錘形小体(HW小体)には、小体外周を取り巻くようにPAB抗体が陽性となり、小体内部領域には細
胞内リボゾームの分布に一致してTIG抗体がドット状に陽性となることから、HW小体が単一のアクネ菌体そのものであることがわかる(図2)。
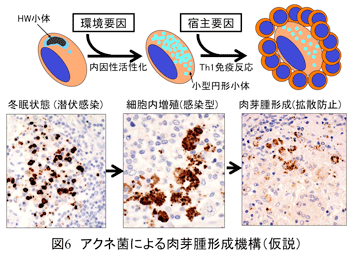
電顕観察にてこれらの病変部アクネ菌は、通常型細菌が有する細胞壁構造を欠失しており、L型細菌に特徴的な出芽様分裂像を呈する。病変部マクロファージ内
に充満するPAB抗体陽性の小型円形小体も、大型紡錘形HW小体から出芽様に分裂増殖したL型アクネ菌そのものであろう。サイズや形態の多様性はL型細菌
の特徴でもある。
病変部
リンパ節の組織懸濁液をマウスに免疫することで、肉芽腫内部に存在するサ症起因体に対し単クローン抗体が作成された。本抗体は、結核菌や他の一般細菌類と
はまったく反応せずアクネ菌と特異的に反応する。サルコイドーシス病変部に反応するアクネ菌・単クローン抗体はこれまでに2種類完成している5。PAB抗体はアクネ菌に特異的な抗体で、菌体細胞膜から細胞壁を貫いて分布するリポタイコ酸と呼ばれる糖脂質抗原を認識する。他方、TIG抗体もアクネ菌に高い特異性を示し、細胞質内に多量に存在するリボゾーム結合性シャペロン蛋白トリガーファクターを認識す2つの抗体はいずれも、結核菌を含むマイコバクテリアには反応せず、他の一般細菌ともまったく反応しない。サ
ルコイドーシスリンパ節に高率に出現する抗酸性の大型紡錘形小体(HW小体)には、小体外周を取り巻くようにPAB抗体が陽性となり、小体内部領域には細
胞内リボゾームの分布に一致してTIG抗体がドット状に陽性となることから、HW小体が単一のアクネ菌体そのものであることがわかる(図2)。
電顕観察にてこれらの病変部アクネ菌は、通常型細菌が有する細胞壁構造を欠失しており、L型細菌に特徴的な出芽様分裂像を呈する。病変部マクロファージ内
に充満するPAB抗体陽性の小型円形小体も、大型紡錘形HW小体から出芽様に分裂増殖したL型アクネ菌そのものであろう。サイズや形態の多様性はL型細菌
の特徴でもある。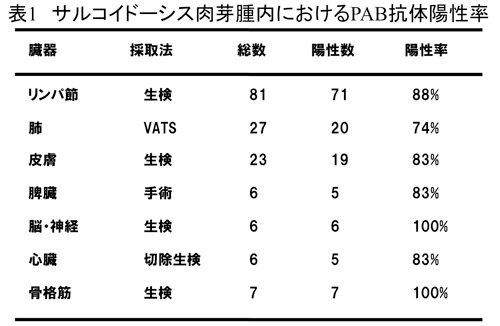
 L
型アクネ菌は細胞壁の主要成分であるペプチドグリカンを欠如するが、細胞膜から細胞壁を貫通して存在するリポタイコ酸は保持(エピトープ構造はむしろ露
出)されることから、リポタイコ酸を認識するPAB抗体は細胞内のL型アクネ菌を検出するのに適した抗体である。PAB抗体を用いた免疫染色では、罹患臓
器を問わずその74%から100%の症例で肉芽腫内にアクネ菌が検出される(表1)。肉
芽腫の成熟に伴いリゾチーム活性や細胞内消化能は亢進することから、成熟肉芽腫よりもリンパ球浸潤のめだつ未熟な肉芽腫において陽性所見を認めることが多
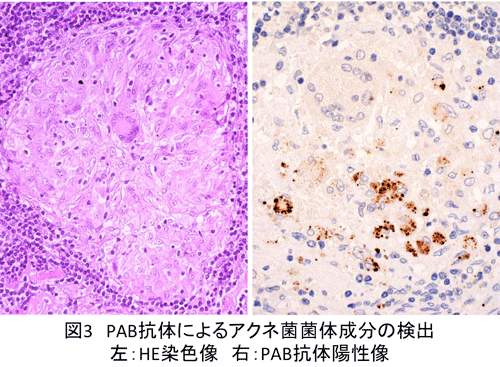
い。多くは類上皮細胞内や巨細胞内にサイズの異なる小型円形小体として同定される(図3)。ときに大型のHW小体様のものを認めることもある。PAB抗体
はサルコイド反応と呼ばれる肉芽腫内には陰性となることから、本症とサルコイド反応を区別する上で有用である。また結核性肉芽腫内にPAB抗体陽性像は認
められないことから、サルコイドーシスを臨床的に疑う症例で壊死を伴う肉芽腫がみられるような場合、PAB抗体の免疫染色がその鑑別診断に役立つ。
L
型アクネ菌は細胞壁の主要成分であるペプチドグリカンを欠如するが、細胞膜から細胞壁を貫通して存在するリポタイコ酸は保持(エピトープ構造はむしろ露
出)されることから、リポタイコ酸を認識するPAB抗体は細胞内のL型アクネ菌を検出するのに適した抗体である。PAB抗体を用いた免疫染色では、罹患臓
器を問わずその74%から100%の症例で肉芽腫内にアクネ菌が検出される(表1)。肉
芽腫の成熟に伴いリゾチーム活性や細胞内消化能は亢進することから、成熟肉芽腫よりもリンパ球浸潤のめだつ未熟な肉芽腫において陽性所見を認めることが多
い。多くは類上皮細胞内や巨細胞内にサイズの異なる小型円形小体として同定される(図3)。ときに大型のHW小体様のものを認めることもある。PAB抗体
はサルコイド反応と呼ばれる肉芽腫内には陰性となることから、本症とサルコイド反応を区別する上で有用である。また結核性肉芽腫内にPAB抗体陽性像は認
められないことから、サルコイドーシスを臨床的に疑う症例で壊死を伴う肉芽腫がみられるような場合、PAB抗体の免疫染色がその鑑別診断に役立つ。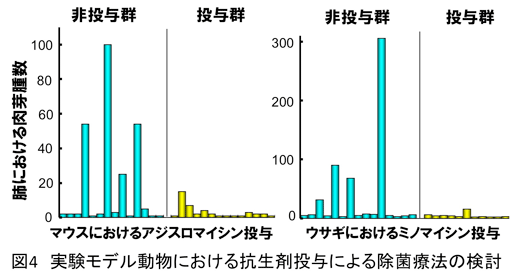 宿主の本菌に対する
過敏性免疫反応が素因となりサルコイドーシスが発症しているとい
う考え方からすれば、本実験系をサルコイドーシスの実験モデルとみなすことができる。抗生剤投与が本実験モデルにおける肺肉芽腫の形成を防止できたことか
ら9、サルコイドーシス患者においても除菌療法が有効である可能性がでてきた(図4)。
宿主の本菌に対する
過敏性免疫反応が素因となりサルコイドーシスが発症しているとい
う考え方からすれば、本実験系をサルコイドーシスの実験モデルとみなすことができる。抗生剤投与が本実験モデルにおける肺肉芽腫の形成を防止できたことか
ら9、サルコイドーシス患者においても除菌療法が有効である可能性がでてきた(図4)。