キナーゼの細胞内局在機構解明のためのツールとしてのケージド化合物
(1東京医歯大・生材研、2東京医歯大・院医歯学総合、3Laboratory of Cancer Biology and Genetics, NCI, NIH、4東京医歯大・院生命情報、5東京医歯大・難治研、6東邦大・理)
〇野村 渉1・芹澤 雄樹1,2・大橋 南美1,2・Nancy E. Lewin3・奥田 善章1,4・鳴海 哲夫1 ・吉田 清嗣5・Peter M. Blumberg3・古田 寿昭1,6・玉村 啓和1,2
第24回生体関連化学シンポジウム 第12回バイオテクノロジー部会シンポジウム
福岡:2009年9月13-15日
Caged molecules as tools for translocation
analysis of protein kinases in cell (Inst. Biomater. Bioeng.,
プロテインキナーゼC (PKC) はジアシルグリセロール (DAG) をセカンドメッセンジャーとするセリン・スレオニン特異的リン酸化酵素であり, がんやアルツハイマー病の治療薬創製の標的酵素として注目されている。演者らはケージド基で保護したPKC特異的リガンドを創製し, 紫外光照射によるPKC活性化の時間・空間的な制御を試みた。DAGを環化することによって結合活性を上昇させたDAG–ラクトンの重要なファーマコフォアである水酸基を光分解性保護基である6-Bromo-7-methoxycoumarin
(Bmc)または6-Bromo-7-hydroxycoumarin
(Bhc) により保護したケージドDAG–ラクトン誘導体を合成した。ケージドDAG–ラクトンを緩衝液中で紫外光照射し, Bmc基の脱保護及びDAG–ラクトンの出現をHPLC分析により確認した。また, その結果から分解反応 (Figure 1A) の量子収率等を算出した。ケージドDAG-ラクトンのPKCd活性化能について, 試験管内での3H[PDBu] (ホルボールエステル) との競合阻害活性, リン酸化アッセイ, およびCHO-K1細胞内におけるGFP融合PKCdの細胞内局在変化 (Figure 1B) によって検討した。その結果, ケージドDAGラクトンはいずれの場合もPKCdに対する結合活性および活性化能を持たず, 紫外光照射によってケージド基を脱保護した場合においてのみPKCdに対する結合活性を出現させ, 活性化も行うことが確認された。以上のことから, ケージドDAG–ラクトンへの紫外光照射による脱保護, それに伴う結合活性の回復を用いてPKCdの活性化を時間・空間的に制御できる可能性が示された。
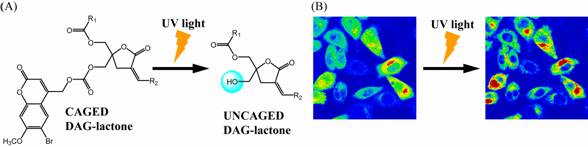
Figure 1. Uncaging of
DAG-lactones (A) and activation of translocation (B) by UV irradiation.