FSHDの研究
This is the homepage of FSHD research laboratory at TMDU in Japan. Please find a link to english pages at the bottom of this page.
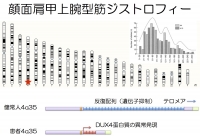
顔面肩甲上腕型筋ジストロフィーでは、第4番染色体のテロメア近傍にあるD4Z4反復配列が短縮しています。その結果、D4Z4領域のゲノム構造が変化しD4Z4にコードされる転写因子DUX4が異常発現することによって筋肉細胞死が引き起こされます。D4Z4の転写活性化にはヒストンメチル基転移酵素の一つASH1が関係しており、ヒストンメチル化を介したゲノム高次構造の制御が病態の解明と治療法の開発に重要であると考えられます。
顔面肩甲上腕型筋ジストロフィーでは、第4番染色体のテロメア近傍にあるD4Z4反復配列が短縮しています。その結果、D4Z4領域のゲノム構造が変化しD4Z4にコードされる転写因子DUX4が異常発現することによって筋肉細胞死が引き起こされます。D4Z4の転写活性化にはヒストンメチル基転移酵素の一つASH1が関係しており、ヒストンメチル化を介したゲノム高次構造の制御が病態の解明と治療法の開発に重要であると考えられます。
進行性筋ジストロフィー症について
■筋ジストロフィーとは
進行性筋ジストロフィー症は、進行性の骨格筋変性・壊死とそれによる筋力低下を主症状とする遺伝性疾患です。様々な遺伝子の変異が原因となることが分かっていますが、今日まで根治療法が無く、昭和47年に定められた「難病対策要項」の対象疾患になっています。頻度の多い順に、デュシェンヌ・ベッカー型、筋硬直型、顔面肩甲上腕型、そして日本にしか患者が居ない福山型などが知られています。日本では、主に患者の多いデュシェンヌ型筋ジストロフィーに対する臨床評価基準の策定、遺伝子治療に向けた臨床研究が進められています。
■顔面肩甲上腕型筋ジストロフィー(FSHD: Facio-Scapulo-Humeral Muscular Dystrophy)について
顔面肩甲上腕型筋ジストロフィー(FSHD)は、主として第4番染色体のテロメア(染色体の末端)近傍にあるゲノム反復配列(D4Z4)の短縮を伴うことが以前から知られていました。その結果ゲノム構造に変化を来し、本来筋(前駆)細胞では発現していない遺伝子(DUX4転写因子)が異所性に発現され細胞死を引き起こすと考えられています。FSHDという疾患の病態の本質がゲノム構造異常であることは、第4番染色体のゲノム反復配列の短縮を伴わない一部のFSHD患者で、遺伝子発現を抑制するゲノム構造制御因子の一つSMCHD1に遺伝子変異が見つかったことからも強く示唆されます。
FSHDの臨床症状は、初期に顔面と上半身の筋力低下(表情が乏しい、肩から上に手が挙げられない)が認められ、徐々に全身の筋力低下を来します。特に、左右差が見られることが他の筋ジストロフィーと異なる特徴とされています。心筋や呼吸筋は侵されないため生命予後は良好です。また、難聴や視力低下の合併症が比較的高頻度に見られます。10万人当たり約5人の発症率とされ、世界的に大きな差はありません。FSHDの確定診断は、末梢血検査で第4番染色体のD4Z4反復配列が短縮しているかどうか、SMCHD1遺伝子に変異があるかどうかを決定する必要があります。
これまで日本であまりFSHDの基礎研究が行われて来なかった背景には、患者が多くないこと、原因と確定診断が比較的最近(2010年~2011年頃)まで不明であったこと、ゲノム構造制御の異常という稀な分子作用機序が関係していることなどが挙げられるかも知れません。
本研究室では、これまでヒストン修飾酵素の一つASH1(正式名はAbsent, small or homeotic discs-1)の細胞・分子機能の解明を目指した研究を進め、ASH1がヒストンH3のリジン36を選択的にメチル化することなどを発表して来ました。また、2011年にイタリアのFSHD研究グループとの共同研究を行い、ASH1がFSHD患者由来の細胞で第4番染色体のD4Z4反復領域に結合し、その転写活性化を引き起こしているということが初めて分かりました。現在、ASH1がどのような分子機序でD4Z4領域の転写を活性化するのか、またどうすればASH1によるD4Z4の転写活性化を抑制できるかを調べると共に、FSHDの確定診断を簡便化するための新たな技術開発にも取り組んでいます。
進行性筋ジストロフィー症は、進行性の骨格筋変性・壊死とそれによる筋力低下を主症状とする遺伝性疾患です。様々な遺伝子の変異が原因となることが分かっていますが、今日まで根治療法が無く、昭和47年に定められた「難病対策要項」の対象疾患になっています。頻度の多い順に、デュシェンヌ・ベッカー型、筋硬直型、顔面肩甲上腕型、そして日本にしか患者が居ない福山型などが知られています。日本では、主に患者の多いデュシェンヌ型筋ジストロフィーに対する臨床評価基準の策定、遺伝子治療に向けた臨床研究が進められています。
■顔面肩甲上腕型筋ジストロフィー(FSHD: Facio-Scapulo-Humeral Muscular Dystrophy)について
顔面肩甲上腕型筋ジストロフィー(FSHD)は、主として第4番染色体のテロメア(染色体の末端)近傍にあるゲノム反復配列(D4Z4)の短縮を伴うことが以前から知られていました。その結果ゲノム構造に変化を来し、本来筋(前駆)細胞では発現していない遺伝子(DUX4転写因子)が異所性に発現され細胞死を引き起こすと考えられています。FSHDという疾患の病態の本質がゲノム構造異常であることは、第4番染色体のゲノム反復配列の短縮を伴わない一部のFSHD患者で、遺伝子発現を抑制するゲノム構造制御因子の一つSMCHD1に遺伝子変異が見つかったことからも強く示唆されます。
FSHDの臨床症状は、初期に顔面と上半身の筋力低下(表情が乏しい、肩から上に手が挙げられない)が認められ、徐々に全身の筋力低下を来します。特に、左右差が見られることが他の筋ジストロフィーと異なる特徴とされています。心筋や呼吸筋は侵されないため生命予後は良好です。また、難聴や視力低下の合併症が比較的高頻度に見られます。10万人当たり約5人の発症率とされ、世界的に大きな差はありません。FSHDの確定診断は、末梢血検査で第4番染色体のD4Z4反復配列が短縮しているかどうか、SMCHD1遺伝子に変異があるかどうかを決定する必要があります。
これまで日本であまりFSHDの基礎研究が行われて来なかった背景には、患者が多くないこと、原因と確定診断が比較的最近(2010年~2011年頃)まで不明であったこと、ゲノム構造制御の異常という稀な分子作用機序が関係していることなどが挙げられるかも知れません。
本研究室では、これまでヒストン修飾酵素の一つASH1(正式名はAbsent, small or homeotic discs-1)の細胞・分子機能の解明を目指した研究を進め、ASH1がヒストンH3のリジン36を選択的にメチル化することなどを発表して来ました。また、2011年にイタリアのFSHD研究グループとの共同研究を行い、ASH1がFSHD患者由来の細胞で第4番染色体のD4Z4反復領域に結合し、その転写活性化を引き起こしているということが初めて分かりました。現在、ASH1がどのような分子機序でD4Z4領域の転写を活性化するのか、またどうすればASH1によるD4Z4の転写活性化を抑制できるかを調べると共に、FSHDの確定診断を簡便化するための新たな技術開発にも取り組んでいます。
ゲノム構造の制御機構
ヌクレオソームの3Dモデル
■ゲノム構造の制御
DNAの塩基配列にコードされる蛋白質の設計図を遺伝子と言います。また、ヒトなどの細胞が持つ全遺伝子情報をゲノムと呼びます。ヒトゲノムは30億塩基対の長さのDNA分子から成り、様々な蛋白質性因子がDNAからRNA(転写)、さらにRNAから蛋白質(翻訳)を合成する反応をそれぞれ制御しています。鎖状のDNAは、H2A、H2B、H3、H4という4種類のヒストンタンパク質複合体に2回巻き付いた構造(ヌクレオソーム)をとり、ヌクレオソームが更に規則的に重なり合い複雑な高次構造を作ると考えられています。遺伝子のはたらきを制御する蛋白質の中には、DNA或いはヒストン蛋白質を生化学的に修飾する酵素が沢山知られており、特定の修飾を受けたDNAやヒストン蛋白質に転写制御因子が結合することによって、遺伝子のスイッチをオンにしたりオフにしたりすると考えられています。
第4番染色体のテロメア近傍は、筋細胞では本来遺伝子が転写されにくいゲノム構造になっているのに対し、FSHD患者の細胞ではDNAやヒストン蛋白質の修飾パターンが変化し、その結果ゲノム構造が転写されやすくなっていることが分かっています。特にASH1というヒストンH3のリジン36を特異的にメチル化する酵素がFSHD患者由来の細胞で特異的にD4Z4反復配列の近くに結合していることは上に紹介した通りです。
DNAの塩基配列にコードされる蛋白質の設計図を遺伝子と言います。また、ヒトなどの細胞が持つ全遺伝子情報をゲノムと呼びます。ヒトゲノムは30億塩基対の長さのDNA分子から成り、様々な蛋白質性因子がDNAからRNA(転写)、さらにRNAから蛋白質(翻訳)を合成する反応をそれぞれ制御しています。鎖状のDNAは、H2A、H2B、H3、H4という4種類のヒストンタンパク質複合体に2回巻き付いた構造(ヌクレオソーム)をとり、ヌクレオソームが更に規則的に重なり合い複雑な高次構造を作ると考えられています。遺伝子のはたらきを制御する蛋白質の中には、DNA或いはヒストン蛋白質を生化学的に修飾する酵素が沢山知られており、特定の修飾を受けたDNAやヒストン蛋白質に転写制御因子が結合することによって、遺伝子のスイッチをオンにしたりオフにしたりすると考えられています。
第4番染色体のテロメア近傍は、筋細胞では本来遺伝子が転写されにくいゲノム構造になっているのに対し、FSHD患者の細胞ではDNAやヒストン蛋白質の修飾パターンが変化し、その結果ゲノム構造が転写されやすくなっていることが分かっています。特にASH1というヒストンH3のリジン36を特異的にメチル化する酵素がFSHD患者由来の細胞で特異的にD4Z4反復配列の近くに結合していることは上に紹介した通りです。
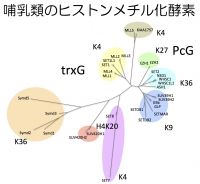
■ヒストンリジンメチル基転移酵素ASH1について
ASH1はS-アデノシルメチオニンという補酵素からメチル基(CH3)をヒストン蛋白質に転移させる酵素です。名前の由来はAbsent small or homeotic discs-1で、ショウジョウバエの発生原基(imaginal disc)の形成に重要な遺伝子の一つとして、約40年前にアメリカ・ジョンスホプキンス大学のAllen Shearnらによって発見されました。ASH1はショウジョウバエの体の前後軸の形成に関わるhox遺伝子の発現維持に必要とされるtrithoraxグループに属し、hox遺伝子を抑制するPolycombグループ因子の作用に拮抗します。1997年にはショウジョウバエのash1遺伝子がクローニングされ、続いて2000年に私たちがマウスのASH1遺伝子を、アメリカの別のグループがヒトのASH1遺伝子をクローニングすることに成功しました。2002年にドイツのグループが、ASH1はヒストンH3のリジン4(K4、Kはリジンアミノ酸の略号)、K9、ヒストンH4のK20をメチル化すると発表しましたが、私たちはこれが誤りであり本当はヒストンH3のK36だけを特異的にメチル化するという証拠を2007年に報告しています。その後、ASH1がK4とK36のどちらをメチル化するか混乱がありましたが、2011年にASH1酵素はDNAが存在しない条件下では活性が無いことを示す結晶構造が発見され、DNA存在下でのみ活性があることを見出した私たちの報告が受け入れられるようになりました。
マウスASH1遺伝子は長さが約10Kbもあり、アミノ酸で3000近く、非常に大きな蛋白質です。ASH1はどの組織でも発現していますが、特に胸腺のT前駆細胞や造血幹細胞で高発現することが分かっています。また、同じtrithoraxグループのMLL(K4メチル化酵素)と協調的にHox遺伝子を活性化する機能があります。ChIP-seqという解析法で、ASH1のゲノム標的の探索が行われていますが、まだ細胞の中でどのような機能を果たしているのか不明な点が多く残されています。
ASH1はS-アデノシルメチオニンという補酵素からメチル基(CH3)をヒストン蛋白質に転移させる酵素です。名前の由来はAbsent small or homeotic discs-1で、ショウジョウバエの発生原基(imaginal disc)の形成に重要な遺伝子の一つとして、約40年前にアメリカ・ジョンスホプキンス大学のAllen Shearnらによって発見されました。ASH1はショウジョウバエの体の前後軸の形成に関わるhox遺伝子の発現維持に必要とされるtrithoraxグループに属し、hox遺伝子を抑制するPolycombグループ因子の作用に拮抗します。1997年にはショウジョウバエのash1遺伝子がクローニングされ、続いて2000年に私たちがマウスのASH1遺伝子を、アメリカの別のグループがヒトのASH1遺伝子をクローニングすることに成功しました。2002年にドイツのグループが、ASH1はヒストンH3のリジン4(K4、Kはリジンアミノ酸の略号)、K9、ヒストンH4のK20をメチル化すると発表しましたが、私たちはこれが誤りであり本当はヒストンH3のK36だけを特異的にメチル化するという証拠を2007年に報告しています。その後、ASH1がK4とK36のどちらをメチル化するか混乱がありましたが、2011年にASH1酵素はDNAが存在しない条件下では活性が無いことを示す結晶構造が発見され、DNA存在下でのみ活性があることを見出した私たちの報告が受け入れられるようになりました。
マウスASH1遺伝子は長さが約10Kbもあり、アミノ酸で3000近く、非常に大きな蛋白質です。ASH1はどの組織でも発現していますが、特に胸腺のT前駆細胞や造血幹細胞で高発現することが分かっています。また、同じtrithoraxグループのMLL(K4メチル化酵素)と協調的にHox遺伝子を活性化する機能があります。ChIP-seqという解析法で、ASH1のゲノム標的の探索が行われていますが、まだ細胞の中でどのような機能を果たしているのか不明な点が多く残されています。
本研究事業の目的と方法
■本研究の目的
■研究方法
■研究方法
本事業に関連する業績
1. Cabianca DS, Casa V, Bodega B, Carvalho C, Ginelli E, Tanaka Y, Carmo-Fonseca M, Gabellini D. A ncRNA regulating a Polycomb/Trithorax epigenetic switch in muscular dystrophy. Cell, 149(4):819-31, 2012.
2. Tanaka Y, Kawahashi K, Katagiri Z, Nakayama Y, Mahajan M, Kioussis D. Dual function of histone H3 lysine 36 methyltransferase ASH1 in regulation of Hox gene expression. PLoS One;6(11):e28171. Epub 2011 Nov 28., 2011
3. Tanaka Y, Nakamura A, Morioka MS, Inoue S, Tamamori-Adachi M, Yamada K, Taketani K, Kawauchi J, Tanaka-Okamoto M, Miyoshi J, Tanaka H, Kitajima S. Systems analysis of ATF3 in stress response and cancer reveals opposing effects on pro-apoptotic genes in p53 pathway. PLoS One;6(10):e26848, 2011.
4. Mori S, Iwase K, Iwanami N, Tanaka Y, Kagechika H, Hirano T. Development of novel bisubstrate-type inhibitors of histone methyltransferase SET7/9. Bioorg Med Chem.;18(23):8158-66, 2010.
5. Tanaka Y, Nakayama Y, Taniguchi M, Kioussis D. Regulation of early T cell development by the PHD finger of histone lysine methyltransferase ASH1. Biochem Biophys Res Commun., 365(3):589-94, 2008
6. Tanaka Y, Katagiri Z, Kawahashi K, Kioussis D, Kitajima S. Trithorax-group protein ASH1 methylates histone H3 lysine 36. Gene, 397(1-2):161-8, 2007.
2. Tanaka Y, Kawahashi K, Katagiri Z, Nakayama Y, Mahajan M, Kioussis D. Dual function of histone H3 lysine 36 methyltransferase ASH1 in regulation of Hox gene expression. PLoS One;6(11):e28171. Epub 2011 Nov 28., 2011
3. Tanaka Y, Nakamura A, Morioka MS, Inoue S, Tamamori-Adachi M, Yamada K, Taketani K, Kawauchi J, Tanaka-Okamoto M, Miyoshi J, Tanaka H, Kitajima S. Systems analysis of ATF3 in stress response and cancer reveals opposing effects on pro-apoptotic genes in p53 pathway. PLoS One;6(10):e26848, 2011.
4. Mori S, Iwase K, Iwanami N, Tanaka Y, Kagechika H, Hirano T. Development of novel bisubstrate-type inhibitors of histone methyltransferase SET7/9. Bioorg Med Chem.;18(23):8158-66, 2010.
5. Tanaka Y, Nakayama Y, Taniguchi M, Kioussis D. Regulation of early T cell development by the PHD finger of histone lysine methyltransferase ASH1. Biochem Biophys Res Commun., 365(3):589-94, 2008
6. Tanaka Y, Katagiri Z, Kawahashi K, Kioussis D, Kitajima S. Trithorax-group protein ASH1 methylates histone H3 lysine 36. Gene, 397(1-2):161-8, 2007.
本事業に関係のあるホームページ
■筋ジストロフィー関連
・難病情報センター
・筋ジストロフィー治験グループ
・厚生労働省
■ゲノム構造関連
・chromatinstructure.wordpress.com
・難病情報センター
・筋ジストロフィー治験グループ
・厚生労働省
■ゲノム構造関連
・chromatinstructure.wordpress.com
研究室へのアクセスと大学院生の募集
■研究室の住所と連絡先
〒101-0062東京都千代田区神田駿河台2-3-10 515号室
東京医科歯科大学難治疾患研究所遺伝生化学分野・難病基盤応用研究プロジェクト研究室
Tel. 03-5280-8064(直通)(湯島地区からの内線は97-8064)
Fax. 03-5803-0248
E-mail. ytanaka.bgenアットマークmri.tmd.ac.jp
■アクセス
JR御茶ノ水駅の御茶ノ水橋改札、または東京メトロ丸ノ内線出口からお茶の水橋を渡り、水道橋方面へ約200メートル(徒歩3分)進んだ右手の奥の建物。
■大学院生の募集 <エピジェネティクスと難病研究>
東京医科歯科大学大学院医歯学総合研究科修士課程、生命理工学系専攻ゲノム構造制御分野博士課程の大学院生を募集しています。
難病研究、エピジェネティクス、マウス初期発生におけるゲノム構造制御、ヒストン修飾酵素活性のライブセルイメージングに興味のある方。発生工学(CRISPRによるノックアウトマウス作成)やプロテオミクス(最新型質量分析装置による蛋白質複合体解析)などの実験技術に興味のある方。
〒101-0062東京都千代田区神田駿河台2-3-10 515号室
東京医科歯科大学難治疾患研究所遺伝生化学分野・難病基盤応用研究プロジェクト研究室
Tel. 03-5280-8064(直通)(湯島地区からの内線は97-8064)
Fax. 03-5803-0248
E-mail. ytanaka.bgenアットマークmri.tmd.ac.jp
■アクセス
JR御茶ノ水駅の御茶ノ水橋改札、または東京メトロ丸ノ内線出口からお茶の水橋を渡り、水道橋方面へ約200メートル(徒歩3分)進んだ右手の奥の建物。
■大学院生の募集 <エピジェネティクスと難病研究>
東京医科歯科大学大学院医歯学総合研究科修士課程、生命理工学系専攻ゲノム構造制御分野博士課程の大学院生を募集しています。
難病研究、エピジェネティクス、マウス初期発生におけるゲノム構造制御、ヒストン修飾酵素活性のライブセルイメージングに興味のある方。発生工学(CRISPRによるノックアウトマウス作成)やプロテオミクス(最新型質量分析装置による蛋白質複合体解析)などの実験技術に興味のある方。

